骨髓间充质干细胞对COPD-OSA重叠综合征大鼠肺血管内皮损伤的修复作用观察
2020-12-23陈敏黄照明郭翔毕虹杜俊毅杨超杨丽娟王丽艳邱云花金志贤昆明市第一人民医院附属甘美医院昆明650224
陈敏,黄照明,郭翔,毕虹,杜俊毅,杨超,杨丽娟,王丽艳,邱云花,金志贤 昆明市第一人民医院附属甘美医院,昆明650224
慢性阻塞性肺疾病(COPD)-阻塞性睡眠呼吸暂停(OSA)重叠综合征是由COPD和OSA重叠构成的一种疾病。研究表明,COPD、OSA均存在血管内皮损伤,而COPD-OSA重叠综合征患者内皮功能紊乱更重,且与疾病严重程度相关[1]。在前期研究中,本课题组成功采用烟熏联合间歇低氧法构建出COPD-OSA重叠综合征大鼠模型,并证实COPD-OSA重叠综合征大鼠体内存在血管内皮损伤[2],但对于该重叠综合征血管内皮损伤修复治疗的研究目前尚处于初始阶段。Kim等[3]研究发现,间充质干细胞(MSCs)通过静脉输注后主要滞留在肺组织,并且肺气肿模型组比正常组MSCs数量更多。骨髓间充质干细胞(BMSCs)具有多向分化潜能,可能通过迁移、趋化到达病变部位发挥免疫调节功能,并具有抑制炎症反应、分泌细胞信号进行细胞间信息传递的功能[4,5]。2016年10月~2018年12月,本研究对COPD-OSA重叠综合征大鼠尾静脉注入BMSCs,观察其对大鼠肺血管内皮损伤的修复作用。现报告如下。
1 材料与方法
1.1 材料 动物:SPF级雌性SD大鼠18只,6~8周龄,体质量150~180 g,购自湖南斯莱克景达实验动物有限公司;饲养和实验均在成都军区昆明总医院实验动物中心屏障环境中进行,饲养环境温度20~25 ℃,湿度60%±5%。主要试剂:99%氮气购自昆明氧气厂,DMEM/F12、胎牛血清(FBS)、细胞培养瓶、0.25%胰酶均购自昆明贝尔吉生物科技有限公司,内皮素1(ET-1)、血管内皮生长因子(VEGF)、基质细胞衍生因子1α(SDF-1α)ELISA试剂盒均购自青岛华美生物科技有限公司,内皮型一氧化氮合酶(eNOS)购自武汉优尔生生命科学装备有限公司,BMSCs表面标记CD90-FITC抗体、CD45-FITC抗体、CD29-FITC抗体、CD19-Fluor 488抗体均购自美国 eBioscience公司,CD34-cy3荧光抗体购自武汉赛维尔生物科技有限公司。
1.2 BMSCs的分离、培养及鉴定 取SPF级雌性SD大鼠2只,采用颈椎脱臼法处死大鼠,无菌条件下取大鼠双侧股骨及胫骨;清除骨表面筋膜及肌肉,剪断骨骺端,暴露骨髓腔。使用10 mL无菌注射器吸取无FBS的DEME-F12培养基,反复冲洗骨髓腔;将骨髓液收集至离心管中,1 200 r/min离心5 min,反复吹打成单细胞悬液。弃上清,用含FBS的DMEM/F12完全培养基重悬稀释;移至T75细胞培养瓶中,置于37 ℃、5% CO2饱和湿度培养箱中培养,48 h后首次换液。去除未贴壁细胞,根据细胞生长速度,2~3 d换液1次。待细胞融合度达90%时,用0.25%胰蛋白酶消化细胞,按1∶3传代,继续培养。取第3代纯化的细胞,100倍显微镜下观察细胞形态,结果显示细胞呈长梭形、漩涡状生长;采用流式细胞仪检测BMSCs表面标记CD19-Fluor 488、CD29-FITC、CD45-FITC、CD90-FITC表达,结果显示分离的细胞表达CD29、CD90,不表达CD19、CD45;参照BMSCs成骨诱导分化、成脂诱导分化试剂盒说明书对其进行体外诱导分化实验,结果显示其具有成骨、成脂分化能力。所培养的细胞表型及功能鉴定均符合BMSCs特点,证实分离培养的细胞为BMSCs。
1.3 建模及分组处理 取SPF级雌性SD大鼠16只,参照前期试验采用烟熏联合间歇低氧的方法制备COPD-OSA重叠综合征大鼠模型,并进行验证[2]。将16只COPD-OSA重叠综合征大鼠随机分为观察组和对照组,每组8只。取第3代BMSCs,经消化、离心、生理盐水重悬,制备密度为2×106/mL的细胞悬液。自建模开始后第4周开始,观察组经尾静脉注射BMSCs 1 mL/次,1次/周,共4次;对照组经尾静脉注射等体积、等次数的生理盐水。
1.4 肺组织标本获取 两组治疗后1周,给予10%水合氯醛(0.3 mL/100 g)腹腔注射麻醉,取右肺下叶于4%多聚甲醛固定24 h,避光保存待检;取左肺组织,置入冻存管,-70 ℃冰箱保存待检。
1.5 肺组织及肺小动脉病理观察 取两组4%多聚甲醛固定的右肺下叶,乙醇脱水后常规石蜡包埋、3 μm厚切片。行HE染色,观察肺组织病理改变;行MASSON染色,观察肺小动脉病理改变。
1.6 肺组织血管内皮细胞凋亡情况观察 采用DAPI-CD34-TUNEL三重定性法。取两组4%多聚甲醛固定的右肺下叶,乙醇脱水后常规石蜡包埋、3 μm厚切片。进行DAPI细胞核染色(蓝光),CD34免疫荧光(红光)和TUNEL法检测凋亡细胞(绿光)。观察标本的特异性红色荧光强度,同时显示蓝光和红光的细胞为CD34阳性的血管内皮细胞,同时显示蓝光、红光、绿光的细胞为凋亡的CD34阳性血管内皮细胞。针对每例标本的蓝光-红光-绿光合成图,每组内每张切片挑选至少3个400倍视野进行截图,截图时尽量让组织充满整个视野,保证每张照片的背景光一致。采用Image-Pro Plus6.0软件选取发出红色-绿色荧光的细胞核定义为阳性细胞,选取发出蓝色的细胞核定义为总细胞,分析每张照片的阳性细胞数以及总细胞数。细胞凋亡率=阳性细胞数/总细胞数×100%,取平均值。
1.7 肺组织ET-1、eNOS、VEGF、SDF-1α表达检测 采用ELISA法。取两组冰箱保存的左肺组织,匀浆后离心;设标准孔、待测样本孔,每孔加标准品或待测样本100 μL,37 ℃孵育2 h;分别加入生物素标记抗体工作液、加辣根过氧化物酶标记亲和素工作液,避光显色;使用酶标仪检测各孔的光密度(OD)值。严格按照ELISA试剂盒说明书进行操作。

2 结果
2.1 两组肺组织、肺小动脉病理改变情况 ①肺组织病理改变:对照组呈现明显的肺气肿特征,肺泡腔扩大,部分肺泡破裂融合,肺泡腔内见炎性渗出;支气管壁大量淋巴细胞增生,细支气管管壁平滑肌增生、杯状细胞增生;肺间质淋巴细胞浸润,间质增厚,气管壁淋巴细胞浸润,部分血管壁淋巴细胞、浆细胞浸润。观察组肺气肿程度较轻,肺间质淋巴细胞、中性粒细胞浸润以及支气管壁淋巴细胞增生、细支气管管壁平滑肌增生、杯状细胞增生等改变均较对照组减轻。见图1。②肺小动脉病理改变:对照组肺小动脉肌化明显增强,外膜胶原纤维高度沉积,血管壁正常结构丧失,血管周围炎症明显,肺间质增厚明显;观察组肺小动脉肌化、外膜胶原纤维沉积、血管壁结构异常、血管周围炎症、肺间质增厚等均较对照组减轻。见图2。
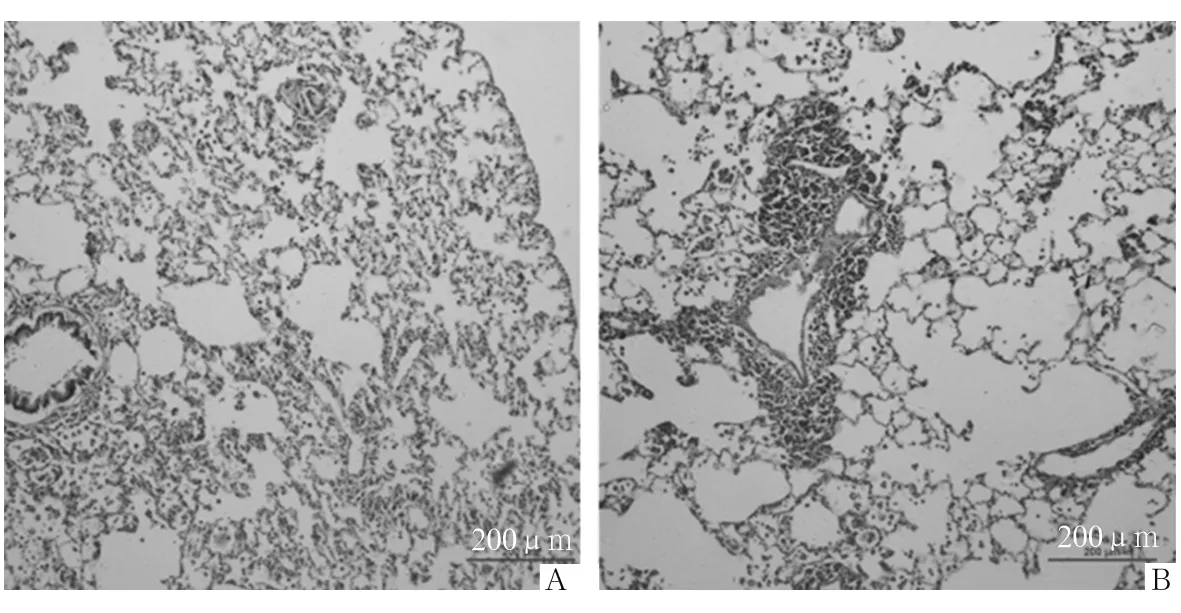
注:A为观察组;B为对照组。
2.2 两组肺组织血管内皮细胞凋亡率比较 观察组与对照组肺组织血管内皮细胞凋亡率分别为2.355 2%±0.392 3%、1.333 9%±0.155 3%,两组比较P<0.01。
2.3 两组肺组织ET-1、eNOS、VEGF、SDF-1α表达比较 观察组肺组织ET-1、VEGF表达均低于对照组,eNOS表达高于对照组(P均<0.05)。两组肺组织SDF-1α表达比较P>0.05。见表1。

注:A为观察组;B为对照组。

表1 两组肺组织ET-1、eNOS、VEGF、SDF-1α表达比较
3 讨论
血管内皮的完整性对于人体血液循环和全身组织的生理屏障作用至关重要,但缺氧、炎症、氧化应激、交感神经活性改变等因素均参与了COPD、OSA的发生、发展,这些因素均可引起血管内皮损伤及功能障碍[6,7],从而导致血管收缩、血液高凝甚至形成血栓,从而引发心脑血管事件的发生。在前期研究中我们已证实COPD-OSA重叠综合征大鼠体内存在血管内皮损伤,但目前对于这种损伤的修复治疗尚处于初始阶段。
BMSCs是未分化的细胞,能从骨髓动员到其他器官,归巢到受损伤组织,可以分化血管内皮细胞在内的多种细胞,从而发挥修复功能。BMSCs具有取材方便、培养简单、增殖快、免疫原性低等特点,并具有免疫调节作用,可调节炎症及氧化应激。既往研究发现,BMSCs条件培养基可以抑制低氧诱导的主动脉血管内皮细胞凋亡,从而修复血管内皮损伤[8]。有研究将BMSCs条件培养基注射到大鼠皮肤伤口,发现BMSCs可修复血管内皮损伤、促进新生血管形成,从而促进皮肤伤口愈合[9]。研究显示,BMSCs可修复野百合碱所致肺动脉高压大鼠模型的血管内皮损伤、减轻肺血管重塑、改善血管舒张功能、有效降低肺动脉压力及改善心功能[10]。结合既往关于COPD、OSA及肺动脉高压等动物模型实验结果,推测BMSCs修复血管内皮损伤的机制可能有:①下调多种炎症介质(如IL-6、IL-1β、C反应蛋白等)来抑制炎症反应[11,12];②抑制氧化应激反应[13,14];③分泌某些抗细胞凋亡因子(如IL-6、人单核细胞趋化蛋白1)及促进血管生长因子(如VEGF),从而抑制血管内皮细胞凋亡,还可能分泌某些细胞因子激活PI3K/AKT通路而抑制血管内皮细胞凋亡[8];④分化为血管内皮细胞及平滑肌细胞,以减轻血管内皮细胞凋亡[10,15]。
NO和ET-1是相拮抗的内皮源性舒张因子,可有效反映血管内皮损伤的状态。NO由eNOS催化底物L-精氨酸合成,低氧可造成内皮细胞eNOS合成减少、活性降低。VEGF是特异性促进血管内皮细胞有丝分裂的生长因子,其合成和分泌受缺氧、癌基因、细胞因子、细胞间质成分等多种因素影响[16]。SDF-1α是细胞膜半胱氨酸-X-半胱氨酸趋化因子之一,可动员内皮祖细胞到外周血,并迁移到血管受损处,具有修复损伤血管内皮及促进新生血管形成的作用[17,18]。本研究结果显示,对照组呈现明显的肺气肿特征,具有肺间质淋巴细胞、中性粒细胞浸润以及支气管壁淋巴细胞增生、细支气管管壁平滑肌增生、杯状细胞增生等明显改变,肺小动脉病理变化显示肌化、外膜胶原纤维沉积、血管壁结构异常、血管周围炎症、肺间质增厚等明显改变,而观察组上述变化均较对照组减轻,说明BMSCs对COPD-OSA重叠综合征大鼠的肺血管内皮损伤具有明显的修复作用。本研究结果显示,观察组肺组织血管内皮细胞凋亡率及ET-1表达均低于对照组,eNOS表达高于对照组;说明BMSCs可能通过降低血管内皮损伤因子ET-1表达及升高血管内皮保护因子eNOS表达,而发挥减轻血管内皮损伤的作用。
研究表明,缺氧可引起血管内皮细胞合成缺氧诱导因子,激活缺氧感受基因,继而引起 VEGF表达上调[19]。间歇低氧可刺激HIF-1α、VEGF、SDF-1α为主的大量交感刺激因子逐渐释放以适应低氧[20]。COPD-OSA重叠综合征患者血清VEGF水平高于中重度COPD及中重度OSA患者[21]。另有研究表明,BMSCs本身具有分泌VEGF的作用,尾静脉移植BMSCs可在COPD大鼠模型肺组织定植、分化为肺泡壁细胞,肺泡壁细胞亦可分泌VEGF等物质[22]。本研究结果显示,观察组肺组织VEGF表达低于对照组;结合目前相关研究,分析原因可能为BMSCs尾静脉移植治疗通过改善大鼠缺氧、炎症、氧化应激等机制,导致其对VEGF的降低作用超过了BMSCs通过自身分泌及转化为肺泡壁细胞后分泌对VEGF的升高作用,但仍需进一步研究证实。
