多通道电化学基因传感阵列快速联检AML相关耐药基因的新方法
2020-12-23张书仪颜志文魏吟秋李碧艳
王 昆,张书仪,颜志文, 魏吟秋,李碧艳,陈 方,陈 庆
(1. 厦门大学附属第一医院药剂科,福建 厦门 361003; 2. 厦门大学药学院,福建 厦门 361102)
0 引言
急性髓系白血病(acute myeloid leukemia,AML)是髓系造血干/祖细胞异常增生的血液系统恶性疾病,自然病程仅为数周到数月,严重危害人类健康[1]. 虽有50%~80% 的患者通过初始治疗的标准诱导化疗方案可以获得完全缓解(complete remission,CR),但即使在CR后并经过巩固、 强化和维持治疗,仍然存在超过50%获得缓解的患者出现耐药、 复发、 预后不良,甚至最终演变为难治白血病,导致治疗失败而死亡[2].
多药耐药(multidrug resistance,MDR)已经成为临床治愈AML的主要障碍之一[3]. 而现有评估耐药的标准都是基于治疗中肿瘤细胞遗传学或形态学上的改变而做出的,耽误了宝贵的治疗时机. MDR相关基因的异常表达是目前公认的AML相关耐药主要机制之一[4]. 研究显示,AML化疗耐药、 难治、 复发与基因编码P糖蛋白的多药耐药基因1 (multidrug resistance gene 1,MDR1)和多药耐药相关蛋白基因(multidrug resistance-associated protein gene,MRP)的异常表达有着密切关系[5]. 目前,MDR研究的主要检测方法均存在一定局限性:免疫组化法操作复杂、 重复性差、 易受非肿瘤抗原干扰; 荧光原住杂交法(FISH)灵敏度低,涉及复杂的荧光显色系统,易出现假阳性; 基因芯片灵敏度、 特异性不高,同样涉及使用复杂光学系统; 实时定量荧光聚合酶链反应(RT-PCR)为单基因筛查,不利于综合分析,且操作繁琐、 价格昂贵,因而限制了临床的大规模应用. 因此,能够开发研制一种快速、 简便、 灵敏、 准确、 经济的AML多药耐药基因检测技术,对于AML耐药发生的预测及判定具有重大意义.
作为一种全新的基因快速检测技术,多通道电化学基因传感阵列已在传感技术研究领域备受关注[6-7]. 该项技术结合了高特异性的核酸分子杂交手段和高灵敏的电化学传感检测技术[8],可实现高通量、 高灵敏度的微量检测,且快捷便携、 价格低廉,为临床研究提供了一种全新的、 强有力的手段[9-10].
本研究筛选并制备高特异性DNA探针,与纳米粒子标记技术相结合,设计多通道电化学基因传感阵列检测方法,建立灵敏、 快速、 简便、 经济的AML相关多药耐药基因检测的新方法,为预测肿瘤治疗效果和临床制定治疗方案提供参考依据,对于AML的治愈具有重大的意义.
1 材料与方法
1.1 仪器和试剂
CHI1030C电化学工作站(上海辰华仪器公司); 金电极(φ2 mm) 、 铂丝电极、 Ag/AgCl参比电极(上海辰华仪器公司); Talos透射电子显微镜(美国赛默飞世尔科技公司); Spectronic 200紫外可见分光光度计(美国赛默飞世尔科技公司).
1.2 试剂及探针序列
三(羟甲基)胺基甲烷(Tris)、 乙二胺四乙酸二钠(EDTA)、 巯基乙醇(MCH,AR)、 牛血清白蛋白(BSA)等购于美国Sigma公司; 3, 3′, 5, 5′-四甲基联苯(TMB)由美国Neogen公司生产; 链霉亲和素标记辣根过氧化物酶(Streptavidin-HRP)由美国Roche公司生产; 实验所需其他试剂均为分析纯,来自上海国药集团化学试剂有限公司.
寡核苷酸探针序列均从宝生物工程(大连)有限公司(TaKaRa)购得,详见表1.

表1 基因序列Tab.1 Gene sequences
1.3 实验方法
TE缓冲液(含10 mmol·L-1Tris,1.0 mmol·L-1EDTA,pH=8.0)作为捕获探针组装液,10 mmol·L-1PBS(pH=7.4)作为杂交反应液,1 mmol·L-1MCH为电极封闭液(避光保存). 上述实验用水为去离子水,配制后于4 ℃ 保存. 1 g·L-1BSA封闭液和1∶1 000(体积比,下同)稀释的Streptavidin-HRP用灭菌水配置而成,4 ℃保存. 根据文献提供方法制备纳米金颗粒(AuNPs)溶液[11],制备得到的AuNPs置于烧瓶中,4 ℃保存. 向AuNPs水溶液中分别加入50 μL信号探针S1和辅助探针A1,静置16 h后,将其置于10 mmol·L-1PBS(0.1 mol·L-1NaCl,pH=7.0)中,静置40 h,然后在14 000 r·min-1下离心5 min 3次后,去除多余的DNA,即得到AuNPs-DNA复合物.
金电极预处理后,在其表面滴加捕获探针组装液3 μL,室温静置2 h,置于100 μL的1 mmol·L-1的MCH溶液1 h. 将组装后的电极置于含有待测靶序列、 AuNPs-DNA和报告探针的杂交溶液中于59 ℃孵育60 min,PBS洗脱. 置于 100 μL 1 g ·L-1BSA溶液30 min室温封闭后,PBS洗脱,氮气吹干,滴加3 μL 1∶1 000稀释的Streptavidin-HRP,15 min后,依次用PBS(含0.05%(体积分数)吐温)和PBS洗脱,待测. 工作电极为金电极,参比电极为Ag/AgCl电极,对电极为铂电极,在三电极体系下,采用循环伏安法 (CV)、 电流时间曲线(i-t)进行检测.
2 结果与讨论
2.1 电化学基因传感阵列检测模式设计
本研究针对 AML相关耐药基因MDR1和MRP,分别设计了两组检测探针,每组探针各包含一条捕获探针(capture probe,C)、 一条报告探针(report probe,R)、 一条信号探针(signal probe,S)和一条辅助探针(Assistant,A),利用酶放大技术、 纳米技术,构建一种新型的多重信号放大的多通道电化学基因传感阵列模式,用于MDR1和MRP的同时检测,检测机理见图1.

图1 AML相关多药耐药基因电化学基因传感检测模式机理图Fig.1 Mechanism of electrochemical gene sensor mode for AML related multidrugs resistance genes
以单通道MDR1检测体系为例,该体系包含有一条3′端修饰巯基的C 、 一条R和一条 5′端修饰有生物素、 3′端修饰巯基的S和一条3′端修饰巯基的A. C、 R分别与靶标序列(target,T)部分基因序列存在互补. S、 A序列相同,按一定比例自组装到AuNPs表面(S-AuNPs),因序列与R的部分序列互补. 将C固定在阵列电极表面后,置于含有R、 S-AuNPs和待测T的杂交溶液中进行杂交,在电极表面形成含有biotin的DNA复合物传感模式. Streptavidin-HRP通过与biotin相结合,将HRP修饰到电极表面上,催化氧化含有H2O2的TMB进而发生电化学信号的改变. 若溶液中不含T,则杂交反应无法进行,电极表面无法修饰HRP催化TMB,检测到的电流信号很弱. 通过比较电流信号变化就可以说明杂交反应是否进行,溶液中是否含有靶标序列.
2.2 AuNPs及AuNPs-DNA生物复合物的表征
从AuNPs透射电镜图(见图2(a))可以看到,合成的呈球形颗粒的AuNPs具有较好的单分散性,其平均尺寸约为 20 nm. AuNPs-DNA紫外吸收光谱(见图2(b))中,AuNPs在与DNA修饰后,除了在260 nm处出现了DNA的特征吸收峰,其原本在520 nm处的特征吸收峰红移至522 nm,说明AuNPs与DNA已成功键合[12].

图2 AuNPs及AuNPs-DNA生物复合物的表征图Fig.2 Characterization graph of AuNPs and AuNPs-DNA
2.3 Streptavidin-HRP催化行为的电化学研究
以 MDR1 检测体系为例,试验考察了杂交前后的电极界面电化学行为. 无靶标序列的情况下,修饰C的电极(C/MCH/AuC)与杂交溶液中的R和S-AuNPs完成杂交后,置于含有H2O2的TMB中进行CV扫描,可以发现其CV曲线出现两对的氧化还原峰(见图3(a)曲线1). 而当其他条件不变,C/MCH/AuC置于含有T的杂交液中进行反应,所得曲线2的电流信号较曲线1明显放大. 这是因为通过杂交和亲和素-生物素结合,可将Streptavidin-HRP修饰到电极表面,催化氧化TMB转变为双偶氮联苯胺类物质,产生信号显著的催化还原峰. 若杂交溶液中不含T,则无法将Streptavidin-HRP固定到电极表面,所得电流信号很小. 从图3(b)可看出,在与T完成杂交后,测得的电流强度为3.20 μA(曲线 2),远大于无杂交反应检测到的电流信号(0.07 μA,曲线1),说明试验所设计的传感模式能够检测溶液中是否含有靶标序列.

图3 不同修饰电极在TMB中的电化学行为表征图Fig.3 Characterization graph of electrochemical behavior in TMB substrate
2.4 [Fe(CN)6]3-/4-在不同修饰电极上的交流阻抗行为
图4(a)曲线1为无DNA修饰的AuC上 [Fe(CN)6]3-/4-电子传输过程,其半圆直径小,线性频率范围宽,说明电极表面电子传输速度快,电解质溶液在电极表面的扩散作用控制了整个电极过程. 修饰C后,电极表面修饰带负电荷的DNA磷酸骨架,与同样带负电荷 [Fe(CN)6]3-/4-相排斥,电子传递受阻,电阻增大(曲线2). 杂交后,虽引入AuNPs增大表面积,但AuNPs表面已有大量的带负电荷的信号探针,在AuC表面的[Fe(CN)6]3-/4-交换仍受排斥,电极表面电阻进一步增加(曲线3). 当蛋白大分子streptavidin-HRP修饰到电极表面,更进一步阻碍电极表面的电子传递,电阻值继续增大(曲线4). 结果表明,探针已修饰到电极表面且能很好地识别靶标进行杂交.
相同条件下,未含AuNPs的检测模式组装步骤阻抗变化趋势(见图4(b))与含有AuNPs的检测模式结果相一致. 比较图4(a)和(b),完成探针组装的电极表面(C/MCH/AuC)电阻值相差不大,修饰AuNPs后,含有AuNPs的检测模式的电阻值比相应的未含AuNPs检测模式的电阻值小,说明加入AuNPs能够加快电子传递速度,从而提高体系的灵敏度与特异性.
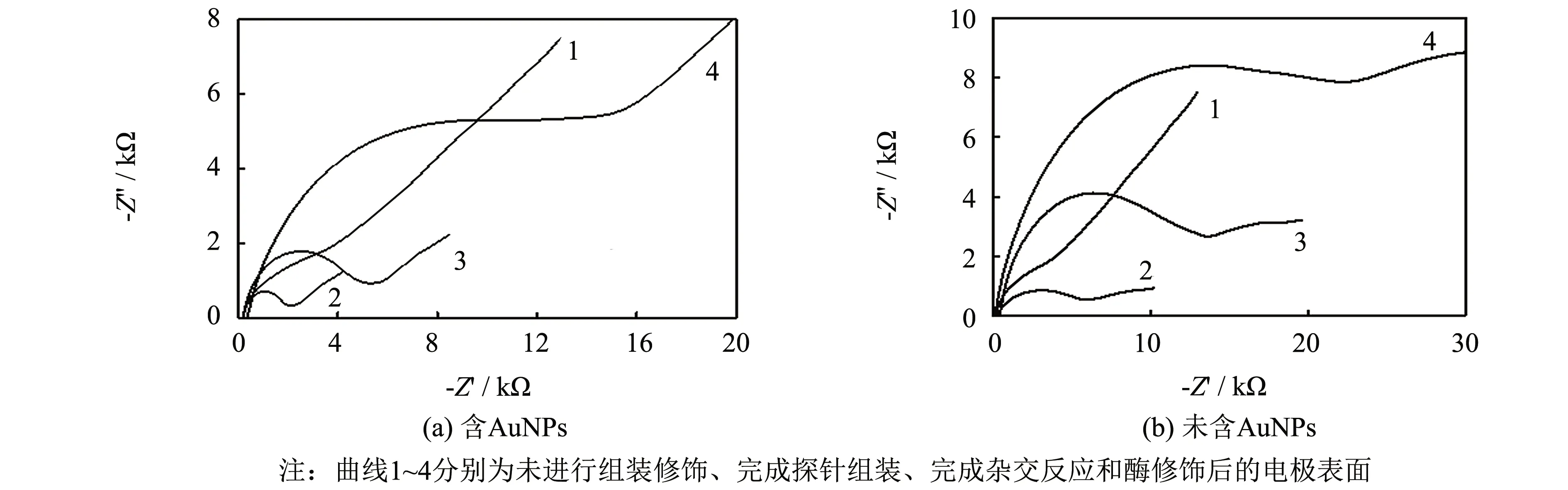
图4 检测模式组装步骤交流阻抗图Fig.4 Impedance spectra graphs (Nyquist plot) of detection modes
2.5 实验条件优化
探针设计过程中,利用计算机Zucher折叠程序[13]针对MDR1和MRP序列的解链温度进行杂交模拟,使得探针与靶标链各杂交互补序列(C-T/T-R/R-S)的解链温度均落在75~80 ℃之间,并对MDR1和MRP的杂交温度进行考察. 在MDR1和MPR两个杂交体系中,当温度达到 59 ℃时,探针与MDR1和MPR的杂交效率最佳. 试验还考察了杂交液中Na+浓度,发现当Na+浓度为1 mol·L-1时,杂交效率最优. 此外,检测过程的杂交顺序优化结果表明,电极表面的C置于含T、 R、 S-AuNPs的杂交液中同时进行杂交的结果优于不同序列先后杂交的结果,可能是因为在一定浓度下,四条序列同时杂交既能避免空间位阻又能减少先后杂交操作的误差影响.
2.6 电化学基因传感阵列检测模式特异性考察
在最佳的条件下,试验对比了含有AuNPs与未含AuNPs的检测模式的选择性能(见图5). 两种检测模式与互补 T 杂交后所检测到的I均达最大值(T1,T2). 在MDR1和MRP两个杂交体系中均可看出当待测序列中含有一个错配碱基(M1-1,M2-1)时,含有AuNPs的检测模式所检测出来的含有错配碱基序列 的I与完全互补序列的I二者之间的差值 ΔI(ΔI=I互补-I错配)明显大于未含AuNPs的检测模式检测所得ΔI. 说明加入AuNPs除了提高检测信号,还能更有效地区分错配序列. 随着错配碱基对数量的增加,对杂交效率的影响越大,当待测碱基序列中存在至少3个错配碱基对时,检测所得的I与空白对照组(1)的I基本一致.

图5 不同序列MDR1和MRP杂交后电流信号直方图Fig.5 Current signals (I) corresponding to the hybridization with different gene sequences of MDR1 and MRP
2.7 不同靶标序列杂交线性及检测限考察
采用i-t法对MDR1和MRP进行定量考察,结果见图6. 从图6可以看出,电流随着互补序列浓度的增加而增大. 因为AuNPs的加入,含有AuNPs的传感阵列具有较高的灵敏度,检测范围可达 10 f mol·L-1~10 nmol·L-1,比不含AuNPs的传感阵列的检测范围(1 pmol·L-1~10 nmol·L-1)多出两个数量级.
图7(a)为MDR1标准曲线,MDR1检测体系在1.0×10-14~ 1.0×10-12mol·L-1范围内,ΔI与靶标序列浓度对数间表现出较好的线性关系,线性回归方程为ΔI(nA)=83.094 7 lgcDNA(fmol·L-1)+ 7.708 7,r2=0.992 6,检出限(S/N=3)为4.8 fmol·L-1. 图7(b)为MRP标准曲线,MRP检测体系在5.0×10-14~ 5.0×10-12mol·L-1范围内,ΔI与靶标序列浓度对数线性关系良好, 线性回归方程为ΔI(nA)=91.595 8 lgcDNA(fmol·L-1)+36.324 4,r2=0.981 5,检出限(S/N= 3)为7.4 fmol·L-1. 结果表明检测含AuNPs的传感阵列可以实现对MDR1和MRP的定量检测,且具有较高的灵敏度.
2.8 重现性考察
重现性考察中,MDR1和MRP的靶标溶液均为1 nmol·L-1,平行测定5次后,分别观察其电化学信号的变化. 结果表明,MDR1和MRP的相对标准偏差(RSD)分别为8.9%和7.4%.
3 结语
本研究设计出高特异性、 高灵敏度的AML相关耐药基因(MDR1和MRP)检测探针,并成功制备出生物相容性较好、 粒径均一性良好的AuNPs,构建用于AML多药耐药基因检测的多通道电化学基因传感阵列的新方法,该方法具有较好的特异性、 灵敏度和重现性,能够在一定浓度范围内实现对MDR1和MRP的定量检测.
