致泻大肠埃希氏菌检验用标准菌株的研究
2020-12-22张彩文李金霞陈怡文都海渤刘佳奇辛迪石靓崔生辉姚粟
张彩文,李金霞,陈怡文,都海渤,刘佳奇,辛迪,石靓,崔生辉,姚粟*
1(中国食品发酵工业研究院有限公司,北京,100015) 2(中国食品药品检定研究院,北京,100050)
大肠埃希氏菌(Escherichiacoli)又称大肠杆菌,是人类目前研究最多的微生物,在全球不同的科学领域均有广泛应用[1]。E.coli是人和动物肠道中的正常栖居菌,大部分E.coli在正常情况不仅不会损害人类健康,而且在一定程度上能够保障人体肠道功能[2]。然而有些E.coli菌株携带致病基因,称之为致泻大肠埃希氏菌(diarrheogenicE.coli,DEC),可导致人或动物腹泻、腹痛甚至出血性腹泻[2-4]。根据DEC的毒力因子、致病机理和流行病学特征,通常将其分为5类:产肠毒素大肠埃希氏菌(enterotoxigenicE.coli,ETEC)、肠道集聚性大肠埃希氏菌(enteroaggregativeE.coli,EAEC)、肠道出血性大肠埃希氏菌(enterohemorrhagicE.coli,EHEC)、肠道侵袭性大肠埃希氏菌(enterotoxigenicE.coli,EIEC)和肠道致病性大肠埃希氏菌(enteropathogenicE.coli,EPEC)[5]。其中EHEC是由产志贺毒素大肠埃希氏菌(shiga toxin-producingE.coli,STEC)进化而来的,是STEC的主要亚群[6]。DEC是导致全球胃肠道疾病的主要原因之一,是人类公共卫生领域需要解决的一个重要问题,而腹泻病主要是通过“粪便-口腔”途径传播[7],因此食品中DEC的检测工作至关重要。
DEC传统的鉴定检测方法包括分离培养、形态观察、16S rDNA系统发育分析、生化鉴定及血清学鉴定等。DEC血清学鉴定方法是依据细菌表面的单一抗原表位对目标菌进行分型,但具有局限性,不能完全反映菌株间的遗传关系,也不能有效区分致泻大肠埃希氏菌和非致泻大肠埃希氏菌,从而导致鉴定结果不准确[3],建议将其作为初步检测或补充验证方法[5]。在DEC传统的检测方法基础上,有必要进行E.coli毒力基因的检测,以提高其检出率[8]。
标准菌株是由国内或国际菌种保藏机构保藏,分类学地位明确,具有特定生物学性能、遗传学稳定并且可溯源的特殊标准样品[9]。标准菌株在食品微生物检验工作中发挥着重要的辅助作用[10],是保证食品检测质量、确保检测数据准确可靠的标准参照物[11]。国家标准GB 4789.6—2016《食品微生物学检验 致泻大肠埃希氏菌检验》[12]对我国食品行业中DEC的检验工作具有重要的指导意义,标准方法要求DEC特征性基因PCR确认试验需要使用阳性、阴性对照菌株,但未明确阳性对照标准菌株菌号。本文利用细菌多相分类学鉴定方法确认了7株E.coli的分类学地位,并根据GB 4789.6—2016标准方法检验7株菌的DEC相关毒力基因携带情况,评价其作为标准菌株的可行性,以期为我国食品微生物检验工作提供有效参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
7株供试菌株均来源于中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC),分别是产肠毒素大肠埃希氏菌CICC 10667、产志贺毒素大肠埃希氏菌CICC 10670、肠道集聚性大肠埃希氏菌CICC 24186、肠道出血性大肠埃希氏菌CICC 24187、肠道侵袭性大肠埃希氏菌CICC 24188、肠道致病性大肠埃希氏菌CICC 24189和大肠埃希氏菌CICC 10003。
1.1.2 试剂
商品化试剂盒:革兰氏染色试剂盒,北京陆桥技术股份有限公司;E.Z.N.A.®Bacterial DNA Kit、E.Z.N.A.®Cycle Pure Kit,Omega Bio-Tek公司;EPEC-STEC-EHEC多重PCR检测试剂盒、EAEC多重PCR检测试剂盒、ETEC多重PCR检测试剂盒、EIEC多重PCR检测试剂盒,环凯微生物科技有限公司。
引物:16S rRNA基因扩增选择通用引物27F/1492R;参照GB 4789.28—2016标准中5种致泻大肠埃希氏菌的目标基因uidA、bfpB、escV、invE、sth、stp、lt、stx1、stx2、pic、astA、aggR所对应的引物序列信息,由生工生物工程(上海)股份有限公司合成相关引物。
PCR试剂:2×EasyTaq®PCR SuperMix (+dye),北京全式金生物生物技术(TransGen Biotech)有限公司。
生理生化试剂:营养肉汁琼脂(nutrient agar,NA)培养基、大豆酪蛋白琼脂培养基(tryptose soya agar,TSA),北京陆桥技术股份有限公司;VITEK微生物鉴定系统革兰氏阴性杆菌(gram negative,GN)鉴定卡,法国生物梅里埃公司。
1.2 仪器与设备
Nikon ECLIPSE Ni-U光学显微镜,日本尼康(Nikon)公司;VITEK®2 Compact全自动微生物鉴定系统,法国生物梅里埃公司;Eppendorf Centrifuge 5424R高速离心机、Eppendorf Research®plus单道系列移液器,德国Eppendorf公司;Biometra Tprofessional Thermocycler TRIO 48 PCR仪,德国Biometra公司;Thermo EC250-90电泳仪,赛默飞世尔科技(中国)有限公司;Bio-Rad Gel DOCTM EZ凝胶成像系统,美国Bio-Rad公司。
1.3 实验方法
1.3.1 形态学观察
将7株供试菌株分别接种于NA或TSA固体培养基上,置于37 ℃培养24 h后,观察其在培养基上的菌落形态,并利用光学显微镜进行菌体特征观察。
1.3.2 基因组DNA提取
采用商品化试剂盒E.Z.N.A.®Bacterial DNA Kit提取7株细菌基因组,具体方法和步骤参照试剂盒说明书。所提取的菌株DNA采用E.Z.N.A.®Cycle Pure Kit进行纯化,利用核酸蛋白分析仪检测基因组DNA的浓度和纯度,并通过1%琼脂糖凝胶电泳检测DNA的完整性。
1.3.3 16S rRNA基因PCR扩增及分析
分别以7株供试菌株的基因组DNA为模板,利用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增16S rRNA基因,PCR反应体系:2×EasyTaq®PCR SuperMix (+dye) 25 μL,DNA模板2 μL,引物各1 μL,补充去离子水至50 μL;PCR 反应条件:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃后延伸10 min。PCR扩增产物使用1.0%的琼脂糖凝胶电泳进行验证后,送于北京诺赛基因组研究中心有限公司进行测序。将16S rRNA基因测序结果分别在EzBiocould数据库(https://www.ezbiocloud.net/)进行相似性比对,并采用ClustalX程序进行同源性序列分析,使用MEGA 5.0构建系统发育树。
1.3.4 生理生化鉴定
采用VITEK®2 GN鉴定卡与VITEK®2 Compact全自动微生物分析系统对7株供试菌株的碳源利用、耐药性以及酶类活性47种生化指标进行检测鉴定。
1.3.5 致泻性大肠埃希氏菌毒力基因检测
参照GB 4789.6—2016《食品安全国家标准 食品微生物学检验 致泻大肠埃希氏菌检验》方法,对7株供试菌株进行毒力基因PCR扩增,并用2%琼脂糖凝胶电泳检测PCR产物[13],同时分别采用商品化EPEC-STEC-EHEC多重PCR检测试剂盒、EAEC多重PCR检测试剂盒、ETEC多重PCR检测试剂盒和EIEC多重PCR检测试剂盒验证其毒力基因检测结果。将检测出的毒力基因PCR产物送于北京诺赛基因组研究中心有限公司进行测序,并将获得的毒力基因序列与GB 4789.6—2016中提供的相关目标基因进行序列对比分析。
2 结果与分析
2.1 形态学特征
7株供试菌株在NA或TSA培养基上菌落分别呈乳白色或微黄色,圆形,表面光滑,半透明,边缘整齐;菌体短杆状,单个或成对排列,不产芽胞,革兰氏阴性。
2.2 16S rRNA基因序列分析
7株供试菌株采用引物27F和1492R扩增获得16S rRNA基因序列,利用EzBiocloud数据平台进行同源性比对分析,结果显示与其序列相似度>98.65%[13]的菌种均属于肠杆菌科(Enterobacteriaceae),主要包括弗氏埃希氏菌Escherichiafergusonii、弗氏志贺氏菌Shigellaflexneri、宋内氏志贺氏菌Shigellasonnei、大肠埃希氏菌E.coli、鲍氏志贺氏菌Shigellaboydii、阿氏埃希氏菌Escherichiaalbertii、痢疾志贺氏菌Shigelladysenteriae、旱獭埃希氏菌Escherichiamarmotae。以模式菌株PantoeaagglomeransDSM 3493T为外群,采用邻近法构建7株供试菌株与相关近源模式菌株的系统发育树。由图1可知,7株供试菌株的16S rDNA序列在埃希氏菌属(Escherichiasp.)与志贺菌属(Shigellasp.)之间无法区分,因此不能通过16S rDNA系统发育分析将其鉴定到种水平。

图1 7株供试菌株16S rRNA基因序列发育分析Fig.1 The phylogenetic analysis of tested strains based on 16S rRNA gene注:邻位连接法显示7株供试菌株与相关种的16S rDNA序列系统发育树,进行1000次的相似度重复计算,图中发育树节点只显示Bootstrap值大于50%数值,上标的“T”表示模式菌株
2.3 生理生化鉴定
VITEK®2微生物鉴定系统中的GN鉴定卡可以自动鉴定大多数具有临床意义的发酵和非发酵革兰氏阴性杆菌,其中包括大部分肠杆菌科细菌。CROWLEY等[14]采用VITEK®2 GN鉴定卡与VITEK 2全自动微生物鉴定系统对720株革兰氏阴性菌进行鉴定分析,评估了VITEK®2 GN鉴定卡的性能,其中60株E.coli的鉴定结果正确率高达100%。E.coli的16S rDNA系统发育分析常在Escherichiasp.与Shigellasp.之间无法区分,可利用VITEK全自动微生物鉴定系统将其精确到种水平[15]。使用GN鉴定卡对7株肠杆菌科供试菌株的碳源利用、耐药性及酶活性生理生化指标进行检测。运用VITEK全自动微生物鉴定系统分析得知,7株供试菌株鉴定结果均为E.coli,鉴定概率百分比均在95%~99%(表1),鉴定结果可靠。
2.4 致泻性大肠埃希氏菌毒力基因检测结果
根据GB 4789.6—2016标准方法,对7株E.coli进行管家基因uidA以及11种毒力基因PCR扩增,琼脂糖凝胶电泳检测结果见图2,共扩增出21个目的条带。采用4种商品化多重PCR检测试剂盒验证其毒力基因检测结果。如表2所示,供试菌株CICC 10667、CICC 10670、CICC 24186、CICC 24187、CICC 24188、CICC 24189检测出不同的毒力基因组合:菌株CICC 10003只检出uidA基因,属于非致泻E.coli;CICC 10667检出uidA、sth、lt基因,属于ETEC;CICC 10670和CICC 24187检出uidA、escV、stx1、stx2基因,未检出bfpB基因,属于STEC/EHEC;CICC 24186检出uidA、pic、astA、aggR基因,属于EAEC;CICC 24188检出uidA、invE基因,属于EIEC;CICC 24189检出uidA、bfpB、escV基因,未检出stx1、stx2基因,属于EPEC。
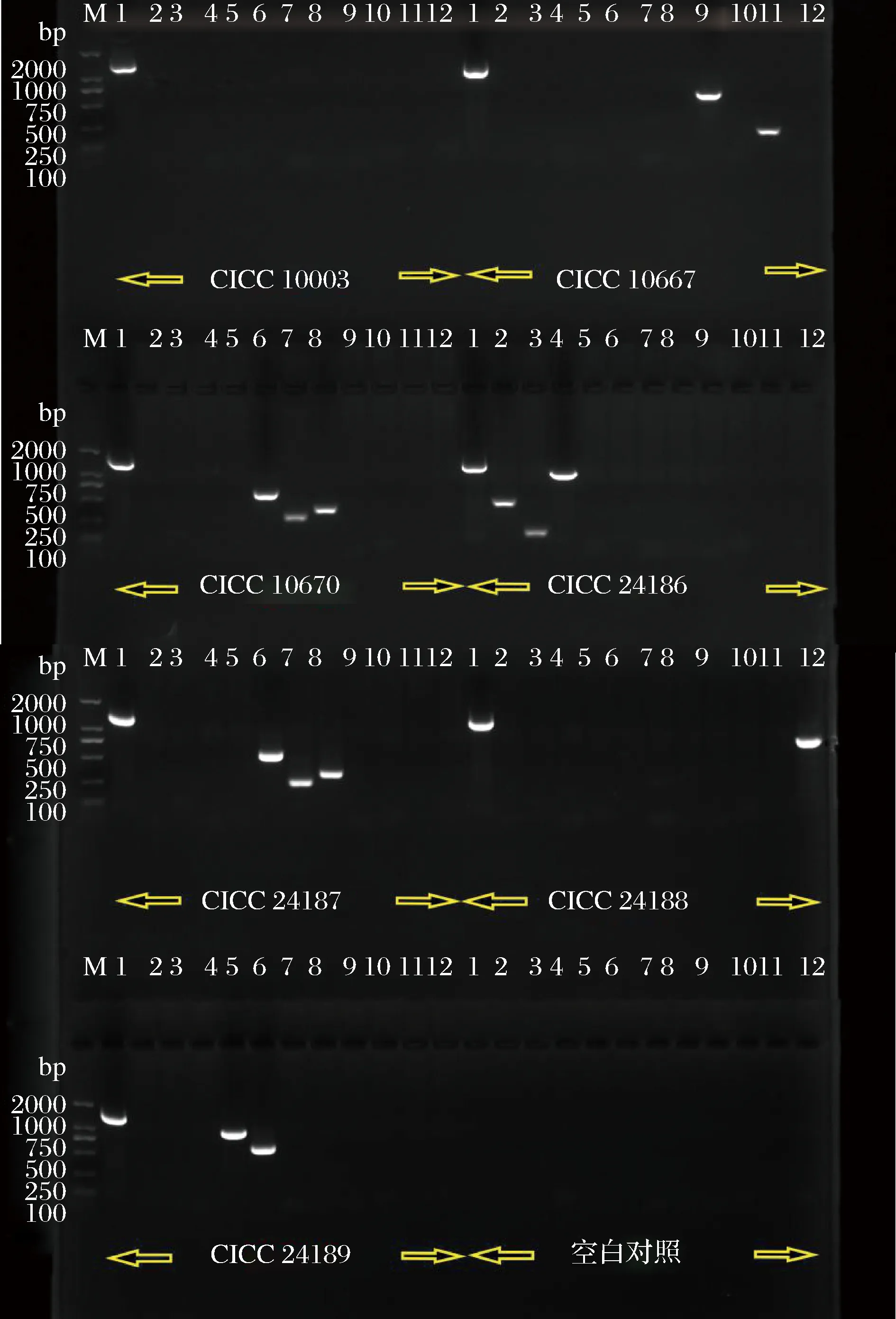
图2 7株供试菌株毒力基因电泳检测结果Fig.2 The electrophoretic detection of virulence gene of E.coli strains注:M, DL2000 Marker;1, uidA;2, aggR;3, astA;4, pic;5, bfpB;6, escV;7, stx1;8, stx2;9, lt;10, stp;11, sth;12, invE

表2 7株大肠埃希氏菌毒力基因特征Table 2 The characteristics of virulence gene of E.coli strains
将7株供试菌株的21个检出基因测序结果分别与GB 4789.6—2016中提供的相关目标基因已知序列进行序列比对。如表3所示,7株菌的各个特征性基因与已知序列同源性达96%~100%。
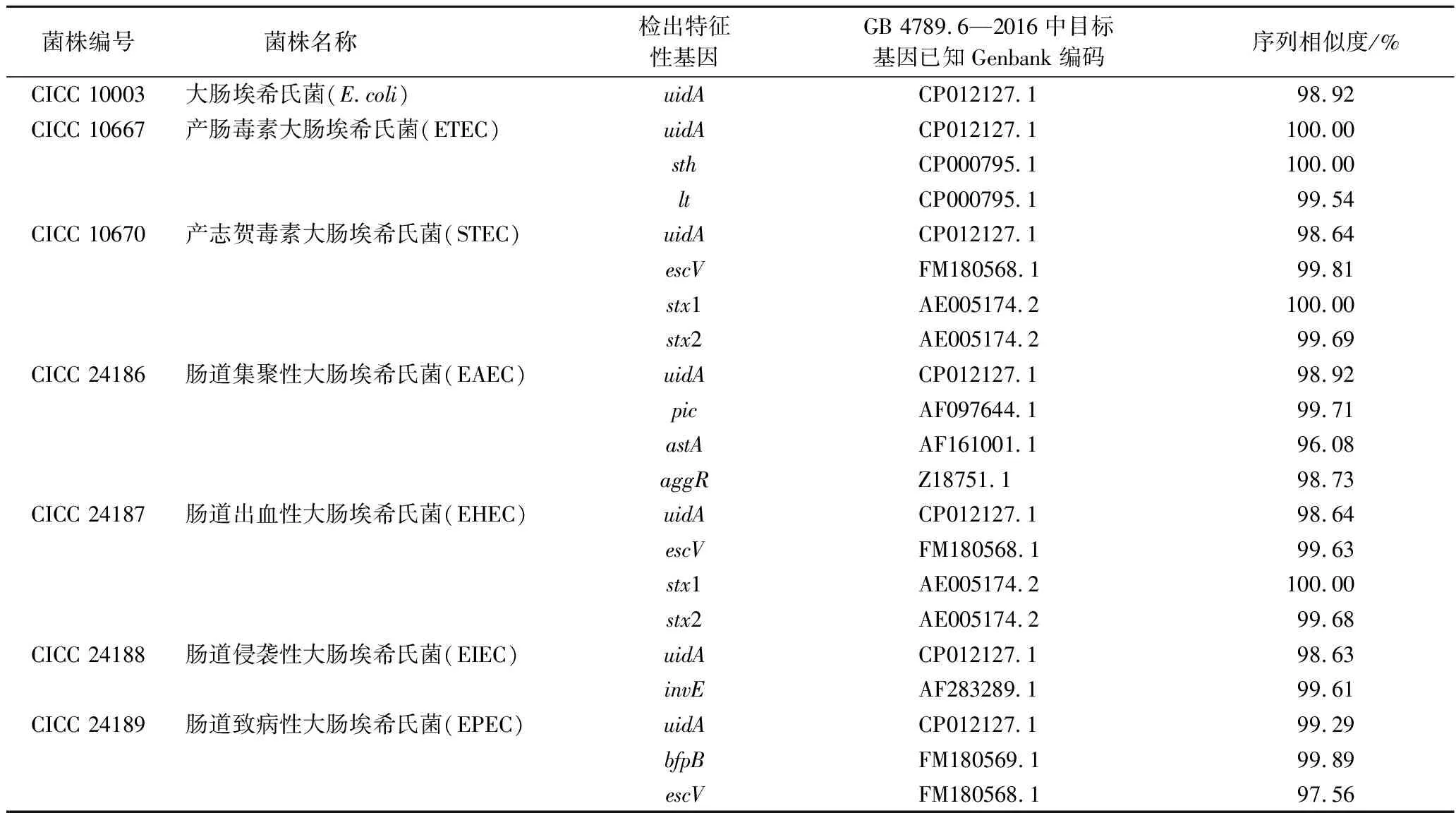
表3 7株大肠埃希氏菌特征性基因序列分析Table 3 The analysis of characteristic gene of of E.coli strains
3 结论与讨论
DEC是造成人体中、重度腹泻的重要病原菌,开展食品中DEC检测工作对维护食品安全意义重大。DEC血清分型是一种常规的病原鉴定和诊断方法,不同的DEC病理类型具备特异的毒力基因库。研究表明DEC血清型与毒力基因存在一定程度差异[2],毒力基因相对于血清型具备更好的稳定性,因此在食品安全风险监测中开展DEC毒力基因检测有利于辨别其致病类型。随着分子生物学技术的快速发展,多重PCR方法在DEC检测中的应用越来越广泛[2-3,5],已经有成熟的商品化多重PCR检测试剂盒在市场上推广应用,提高了食品中DEC检验工作效率。此外,高通量基因组学也逐渐融入到菌株流行病学研究中,全基因组分析方法的应用正成为DEC基因组学研究的常态,通过对其全基因组序列的解码将揭示出更多的菌株信息,反映出更清晰的致病机理[16-17]。
本文采用细菌多相鉴定方法对7株E.coli进行分类学鉴定,并根据GB 4789.6—2016标准方法对其进行DEC相关毒力基因PCR确认试验。结果表明:CICC 10003只携带uidA基因,符合标准中阴性对照菌株特征;其余6株E.coli分别携带不同组合的毒力基因,符合该标准中相应DEC菌株特征。因此菌株CICC 10667、CICC 24186、CICC 24188、CICC 24189可分别作为GB 4789.6—2016中ETEC、EAEC、EIEC、EPEC的阳性对照菌株,CICC 10670和CICC 24187可作为STEC/EHEC的阳性对照菌株,CICC 10003可作为阴性对照菌株。同时这7株菌有望成为商品化DEC多重PCR检测试剂盒的质控菌株,以期为我国食品中DEC检验工作提供有效参考,保证标准实施的一致性和检测结果的准确性。
