Orai1体外干预对宫颈息肉炎症反应的作用
2020-12-22任国强
兰 晶,任国强
(复旦大学附属华山医院北院 1.妇产科;2.病理科,上海 201907)
宫颈息肉(cervical polyps,CP)常位于子宫颈管内,其发病率在育龄期妇女为2%~5%[1]。CP的病理表现是以纤维血管基质为中心、表面上皮呈乳头状增生的组织[2]。无症状CP患者常在例行妇科检查时发现,有症状的CP患者常在月经间期、性交后和/或绝经后出现阴道内出血。大规模的临床研究显示,CP为良性赘生物,但也有0.1%的恶变几率[3]。CP发生的病理生理学机制目前尚不清楚,可能的机制包括慢性炎症、激素刺激和/或子宫血管淤血等[3]。为了进一步研究CP可能的发病机制及相应的治疗措施,我们课题组设计了本项研究,旨在探讨Orai1蛋白在CP中的表达及该蛋白的体外干预对CP患者炎症反应的影响。
1 材料与方法
1.1 材料
收集复旦大学附属华山医院北院病理科2016年至2019年间证实为CP的组织标本40例。CP组织在手术中直接获取,而且所有标本均经资深病理医师严格复检。纳入标准为26~61岁CP女性患者。排除标准:伴有淋病奈瑟菌感染、阴道滴虫感染、沙眼衣原体感染、生殖器支原体感染、解脲支原体感染或恶性肿瘤病史者;孕妇、激素替代治疗者、宫内节育器使用者或口服避孕药者。该研究经复旦大学附属华山医院伦理审查委员会认可,所有患者术前均签署了知情同意书。
1.2 CP组织体外培养
将CP组织以器官培养的方法进行体外培养[4]。将获取的息肉组织在无菌条件下分割成2~3mm3大小的组织块,用含有5μg/mL两性霉素B和300μg/mL青霉素G的磷酸盐缓冲液清洗,再用含有10%小牛血清和20μg/mL庆大霉素的浓度为98%的达尔伯克(氏)必需基本培养基(Dulbecco’ s minimum essential medium,DMEM)再清洗,随后加入50μmol/L 2-氨基乙基联苯基硼酸酯(2-aminoethoxydiphenyl borate,2-APB)(美国Sigma-Aldrich)共孵育1h,接着将组织块置于1cm×1cm大小的湿明胶海绵上,息肉面朝上,另一面朝下,将明胶海绵置于含有3mL培养液的6孔板上,使息肉高于液面,6孔板置入温度为37°C和含有5%CO2空气的潮湿孵育箱中,并进行转速为15rpm的连续转动24h,最后收集组织块进行下一步研究。见图1。
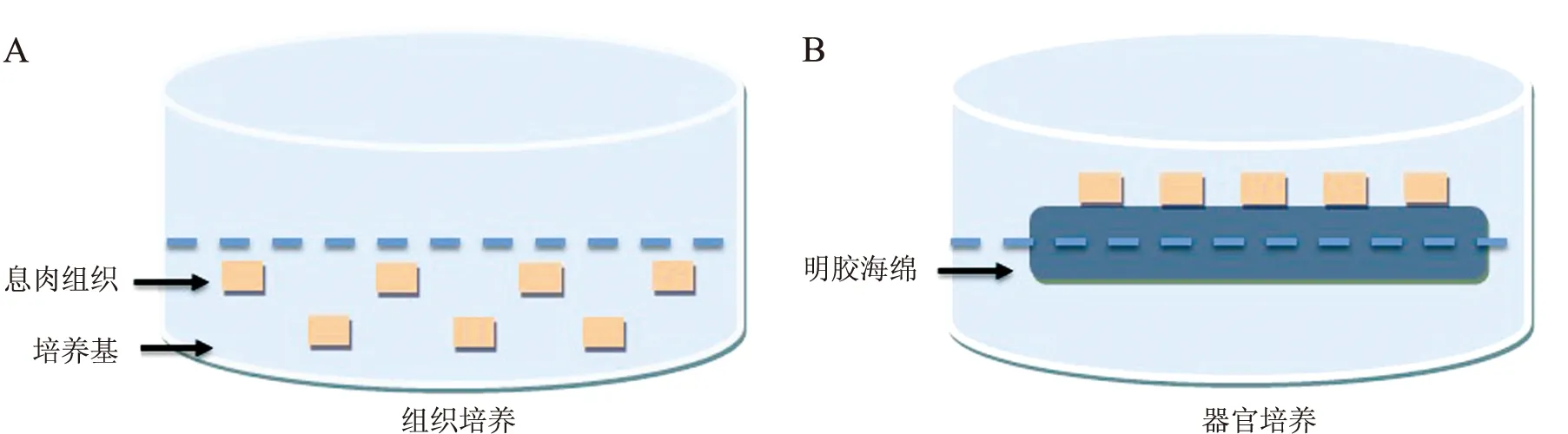
注:A为组织培养,B为器官培养。
1.3 免疫组织化学染色
采用免疫组织化学(immunohistochemistry,IHC)染色(SP法)对CP组织中的Orai1蛋白的表达进行了组织形态学评估。IHC染色可以将免疫反应的特异性和组织化学的可见性相结合,对靶标抗原进行定性、定位,甚至定量检测。所有标本均经4%甲醛固定、脱水和常规石蜡包埋,4μm连续切片。一抗为Orai1单克隆抗体,购自美国Sigma公司,SP免疫组织化学即用型试剂盒购自美国Abcam公司,操作流程严格按照试剂盒说明书进行。结果判定按照已发表文献中所用方法[4],Orai1蛋白定位于细胞膜,以出现棕黄色且染色强度高于背景非特异性着色者为阳性,染色面积评分为:0表示0%,1表示1%~10%,2表示11%~50%,3表示51%~100%;染色强度评分为:无染色(0),弱阳性染色(1+),中等强度阳性染色(2+)和强染色(3+);染色面积和强度的评分乘积所得综合分数(1~9)为最终评分:1~3分为Orai1低表达,4~9分为Orai1高表达。
1.4 酶联免疫吸附试验
为了进一步确定Orai1蛋白及炎症介质白介素(interleukin,IL)-1β和肿瘤坏死因子(tumor necrosis factor,TNF)-α在CP组织中的表达,应用酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)对上述物质进行定量分析。ELISA是一种新型的免疫测定技术,用于定量检测靶标组织中的蛋白含量。Orai1 ELISA试剂盒、IL-1β试剂盒和TNF-α试剂盒均购自美国MyBioSource公司,操作流程严格按照试剂盒说明书进行。
1.5 实时定量反转录聚合酶链反应
CP组织中Orai1 mRNA、IL-1β mRNA和TNF-α mRNA的检测采用实时定量反转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)法。实时定量RT-PCR可以定量分析样品中的靶标物质的mRNA含量。上述3种mRNA的引物均由上海捷兰生物技术有限公司设计。Orai1 mRNA上游引物:5′-CCCTTCGGCCTGATCTTTATC-3′,下游引物:5′-GGAACTGTCGGTCAGTCTTATG-3′;IL-1β mRNA上游引物:5′-ACAGATGAAGTGCTCCTTCCAG-3′,下游引物:5′-CAGCATCTTCCTCAGCTTGTC-3′;TNF-α mRNA上游引物:5′-CTAATCTCTCTCCAGGGACCC-3′,下游引物:5′-TCACTGTTCGGACATCGGGTA-3′;内参β-actin mRNA上游引物:5′-CACTCTTCCAGCCTTCCTTC-3′,下游引物:5′-GTACAGGTCTTTGCGGATGT-3′,操作流程均按照实时定量RT-PCR试剂盒(日本Takara Bio公司)所规定的步骤进行,实验所得数据用ΔCt法来表示。
1.6 统计学方法
采用GraphPad Prism 6统计软件对数据进行分析,研究中所得数据经检验呈非正态分布,而样本量又较小,因此采用非参数检验的方法,如果数据经Kruskal-Wallis法检验有显著差异,则用Mann-Whitney法对数据再进行检验,以P<0.05为差异有统计学意义。
2 结果
2.1 IHC染色的评估
本研究中IHC染色从组织形态学分析,发现Orai1蛋白阳性染色定位于鳞状上皮细胞膜,干预前后CP组织中均呈现Orai1蛋白阳性染色表现,但干预前染色面积和强度更大,见图2;以IHC进行综合评分,干预前CP染色评分均在4~9分,干预后评分均在1~3分,见表1。

表1 Orai1蛋白表达Table 1 Expression of Orai1 protein
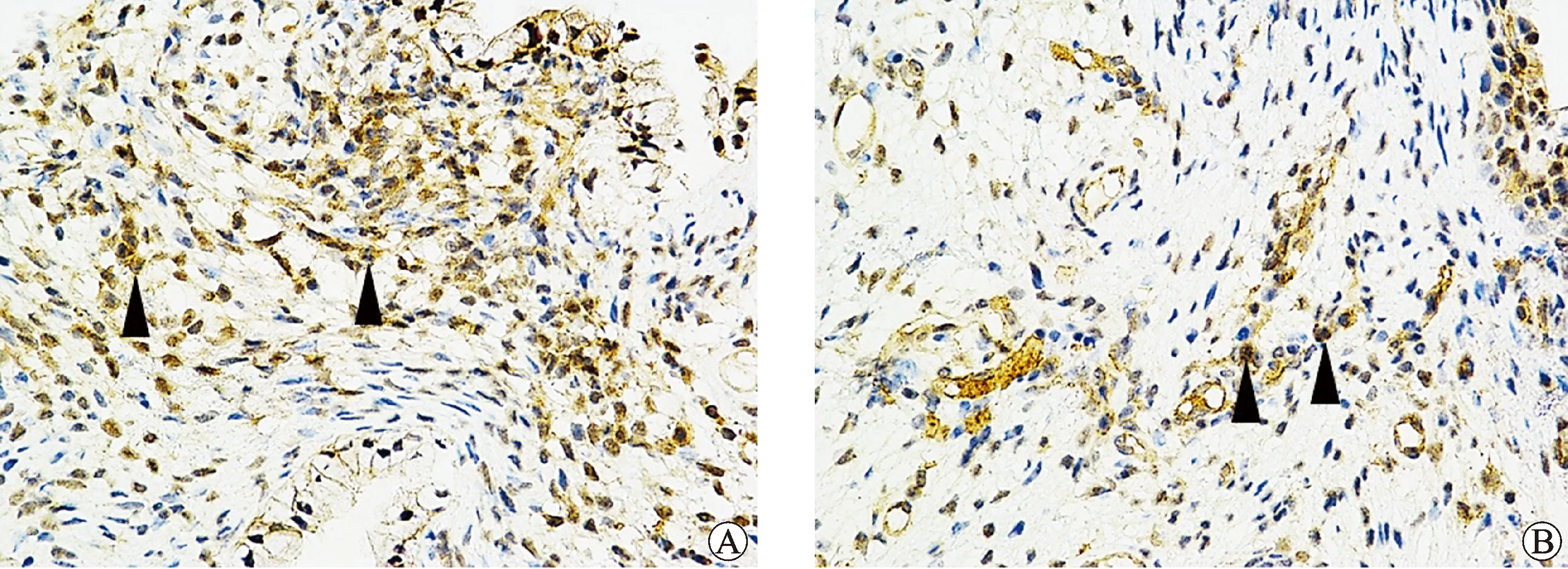
注:A为干预前,B为干预后;箭头表示阳性染色细胞(放大倍数400×)。
2.2 ELISA检测结果
ELISA检测结果显示,与干预前相比,2-APB干预后CP中Orai1蛋白含量显著减少,差异有统计学意义(t=5.76,P<0.05),见图3A;干预后,IL-1β和TNF-α的浓度显著低于干预前,差异均有统计学意义(t值分别为15.28、6.35,均P<0.05),见图4A、图4B。
2.3 实时定量RT-PCR的结果
实时定量RT-PCR的结果显示,与干预前相比,2-APB干预后CP中Orai1 mRNA含量显著减少,差异有统计学意义(t=10.85,P<0.05),见图3B;干预后,IL-1β mRNA、TNF-α mRNA浓度显著低于干预前,差异均有统计学意义(t值分别为7.10、17.74,均P<0.05),见图4C和图4D。

注:A为Orai1 ELISA检测;B为Orai1 mRNA实时定量RT-PCR检测;*P<0.05。
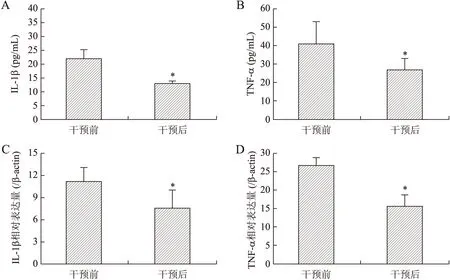
注:A为IL-1β ELISA检测;B为TNF-α ELISA检测;C为IL-1β mRNA实时定量RT-PCR检测;D为TNF-α mRNA实时定量RT-PCR检测;*P<0.05。图4 IL-1β和TNF-α的ELISA和实时定量RT-PCR检测Fig.4 Contents of IL-1β and TNF-α by ELISA and real-time quantitative RT-PCR
3 讨论
3.1 CP的发病机制及临床治疗
CP多发于年龄在50岁左右的经产妇[5],大多患者没有特殊症状,但一部分患者有月经间期、性交后和绝经后出血,极少数患者可能因息肉渐进性增大而诱发临床症状,比如子宫脱垂等[3]。CP的发病机制可能与慢性炎症、激素刺激、局部反应性增生、宫颈分泌性腺体导管阻塞或遗传因素等有关[2]。MacKenzie等于2009年对1 366例CP患者进行了为期4年的研究,发现绝经前期妇女患CP极少发生恶变,另外Younis等2010年研究发现CP患者的息肉常来源于子宫内膜,而且首次活检时病理表现为息肉的CP极少发生恶变,这些学者认为CP患者是否进行息肉的常规切除,并同时进行子宫内膜及子宫颈管取样有待商榷,甚至认为从卫生经济学角度考虑是不可取的,应该将手术切除和取样等操作用于有症状的CP患者。但另外一些学者持相反观点,Goldshmid等[6]认为应该对无症状的CP患者进行前瞻性研究,Long等[7]认为应该对无症状的CP患者进行常规息肉切除,Neri等(1995年)和Esim等[8]甚至认为应该对无症状的CP患者在施行息肉切除的同时进行子宫颈管或子宫内膜取样。但有研究者认为,对宫颈炎患者进行宫颈癌筛查都会引起患者焦虑,如果取样更容易导致患者恐惧[9]。但是对于CP的慢性炎症机制及如何进行炎症方面的治疗鲜有报道。因此我们课题组设计了本研究,旨在探讨CP中炎症反应的可能机制及Orai1的体外干预对CP炎症反应的作用。
3.2 钙离子与Orai1蛋白
很多研究证实,Ca2+信号通路的异常与炎症的发生、发展有关,钙储备调控性Ca2+流入(store-operated calcium entry,SOCE)是非兴奋性细胞摄取Ca2+的主要方式[10]。Orai1分子是SOCE通道的关键组成部分,主要位于免疫系统细胞膜表面,也存在于其他类型细胞膜。SOCE通道是一种细胞质中内质网钙储备调控性Ca2+通道,它的激活可以使细胞外游离Ca2+大量内流,上调胞质内游离Ca2+浓度,从而促进各种细胞功能的进行,比如细胞增殖、分化、脱颗粒及细胞因子的合成和分泌等[10]。该通道由Orai1及其变构体Orai2、Orai3组成,其中Orai1为主要蛋白组分,它的变异和缺失对此通道影响最大[11]。
我们前期研究结果显示正常宫颈组织中有Orai1蛋白的表达,CP组织中该蛋白表达上调,阳性染色主要是鳞状上皮细胞(数据尚未发表),但没有进行干预方面的研究,本研究中采用2-APB进行干预,并对干预前后CP中Orai1蛋白的表达和息肉组织中炎症因子的表达均进行了相关实验。本研究选择2-APB作为干预Orai1蛋白的方法,是因为多项研究证实,2-APB可以通过影响该蛋白的功能,来特异性地控制SOCE通道的活性,有效抑制钙储备调控性Ca2+内流,从而调控靶细胞的功能[12]。
3.3 2-APB对CP的干预作用
本研究IHC染色显示,Orai1蛋白阳性染色定位于鳞状上皮细胞膜,干预前后息肉组织中均有Orai1蛋白的阳性表达,但干预前染色强度更大,染色面积也更广,综合评分表明,干预前CP染色评分均在4~9分,干预后评分均在1~3分,这样的形态学方面研究结果(半定量)说明,2-APB对CP组织中鳞状上皮Orai1蛋白的表达有抑制作用。接着又用ELISA法对CP中Orai1蛋白进行了定量检测,发现2-APB干预后CP中Orai1蛋白含量显著减少,干预前后差异具有统计学意义(P<0.05)。慎重起见,我们对息肉组织中Orai1 mRNA也进行了检测,结果表明,相较于干预前,2-APB干预后CP中Orai1 mRNA含量显著减少,干预前后差异具有统计学意义(P<0.05)。
综上所述,2-APB不仅能从蛋白水平影响Orai1的表达,也能从mRNA水平对该蛋白的转录进行抑制,其机制尚需进一步研究。为了进一步验证CP中炎症反应的情况,我们也将标本中炎症介质IL-1β和TNF-α的含量进行了检测,结果发现干预前这两种炎症介质的浓度显著高于干预后,差异具有统计学意义(P<0.05),同样我们也对标本中IL-1β mRNA和TNF-α mRNA进行了相应的检测,结果发现干预后这两种炎症介质的mRNA浓度显著低于干预前,差异具有统计学意义(P<0.05)。这说明2-APB通过对鳞状上皮中Orai1蛋白表达的抑制,影响了这些细胞对炎症介质IL-1β和TNF-α的合成和释放,最终影响了CP组织中的炎症反应。总之,本研究表明,Orai1的体外干预对CP中的炎症反应有抑制作用。
有研究表明,特异性较高的Orai1蛋白阻滞剂2-APB可以缓解动物模型的鼻黏膜中的变应性炎症[13-14],可以抑制鼻息肉中的炎症反应[15],本研究中也提示2-APB可以减轻CP组织中的炎症反应,因此可以设计类似2-APB的药物对宫颈慢性炎症(比如CP)进行相应干预,使其成为除了手术切除之外的另一种方法。
