曲妥珠单抗联合GX方案化疗对HER-2阳性晚期乳腺癌患者的应用效果
2020-12-22高笑玉刘鹏飞张克非
高笑玉,刘鹏飞,张克非
(河南科技大学第一附属医院 甲状腺乳腺肿瘤外科,河南 洛阳 471000)
乳腺癌为常见的恶性肿瘤,发病率较高,约30%的乳腺癌患者出现人表皮生长因子受体2(human epithelial receptor 2,HER-2)阳性[1]。化学疗法为目前治疗晚期乳腺癌的主要方案,能有效杀灭肿瘤细胞,但同时损伤其他正常组织细胞,降低机体免疫功能。随着分子肿瘤学研究的进展,分子靶向治疗药物被逐渐用于乳腺癌的治疗,可作用于癌细胞某些位点,降低正常细胞损伤的风险。曲妥珠单抗为主要的靶向治疗药物,是一种单克隆抗体,可以HER-2为作用靶点,引发多种细胞内生物效应,杀伤肿瘤细胞[2]。本研究主要探讨曲妥珠单抗联合GX化疗方案对HER-2阳性晚期乳腺癌的应用效果。
1 资料与方法
1.1 一般资料选取2016年2月至2018年2月在河南科技大学第一附属医院治疗的74例HER-2阳性晚期乳腺癌患者,患者均为女性。按照治疗方案将患者分为联合组和化疗组,每组37例。化疗组年龄33~64岁,平均(48.23±7.51)岁;病理组织类型为小叶癌4例,浸润型导管癌31例,黏液腺癌2例;TNM分期为Ⅲ期28例,Ⅳ期9例。联合组年龄34~65岁,平均(48.92±7.15)岁;病理组织类型为小叶癌3例,浸润型导管癌32例,黏液腺癌2例;TNM分期为Ⅲ期27例,Ⅳ期10例。两组患者年龄、病理组织类型、TNM分期等一般资料比较,差异无统计学意义(P>0.05)。本研究经河南科技大学第一附属医院医学伦理委员会审核批准。
1.2 纳入及排除标准(1)纳入标准:①经病理组织学检查确诊;②免疫组织化学测定为HER-2标志物阳性;③预计生存期>3个月;④KPS评分>60分;⑤患者及家属签署知情同意书。(2)排除标准:①处于妊娠期或哺乳期;②合并其他恶性肿瘤;③入组前1个月实施其他相关治疗或放射疗法及化学疗法;④严重肝、肾功能障碍。
1.3 治疗方法化疗组患者接受GX化疗方案,于第1、8天静脉滴注1 000 mg·m-2吉西他滨(山东罗欣药业集团股份有限公司,国药准字H20123340);第1~14天口服卡培他滨(上海罗氏制药有限公司,国药准字H20073023)1 000 mg·m-2。每个周期21 d。联合组患者接受曲妥珠单抗联合GX化疗方案,GX化疗方案同化疗组,曲妥珠单抗(罗氏公司,注册证号S20050008)静脉滴注,首次剂量为4 mg·kg-1,以后剂量为2 mg·kg-1,每周1次。两组均治疗4个周期。
1.4 疗效判定标准完全缓解,即病灶完全消失;部分缓解,即病灶长径总和减少≥30%;疾病进展,即病灶长径总和增大≥20%或新增病灶;疾病稳定,即病灶长径总和减少<30%或增大<20%。
1.5 观察指标(1)疾病缓解率。(2)血清肿瘤标志物变化。分别于治疗前后采集患者空腹静脉血3~5 mL,离心后分离血清,以酶联免疫吸附法检测患者癌相关糖蛋白抗原(cancer antigen 153,CA153)、癌胚抗原(carcinoembryonic antigen,CEA)、细胞间黏附因子-1(intercellular adhesion molecule-1,ICAM-1)水平(所用试剂、试剂盒购自上海钰博生物科技有限公司)。(3)血清T细胞亚群水平。分别于治疗前后采集患者空腹静脉血2~3 mL,离心取上清液,采用碱性磷酸酶法检测血清T细胞亚群(CD3+、CD4+、CD8+)水平(所用试剂、试剂盒购自武汉默沙克生物科技有限公司)。(4)患者生存情况。随访1 a,比较两组生存情况。

2 结果
2.1 疾病缓解率联合组完全缓解者3例,部分缓解者20例,疾病稳定者11例,疾病进展者3例;化疗组完全缓解者1例,部分缓解者13例,疾病稳定者14例,疾病进展者9例。联合组疾病缓解率为62.16%(23/37),高于化疗组的37.84%(14/37),差异有统计学意义(χ2=4.378,P=0.036)。
2.2 血清肿瘤标志物水平治疗后联合组患者血清CA153、ICAM-1和CEA水平低于化疗组,差异有统计学意义(P<0.05)。见表1。
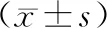
表1 两组患者血清肿瘤标志物水平比较
2.3 血清T细胞亚群水平与化疗组比较,治疗后联合组患者血清CD3+、CD4+水平较高,CD8+水平较低,差异有统计学意义(P<0.05)。见表2。
2.4 生存率随访1 a,联合组失访2例,化疗组失访2例。联合组非肿瘤死亡7例,肿瘤死亡4例;化疗组非肿瘤死亡10例,肿瘤死亡12例。联合组生存率为68.57%(24/35),高于化疗组的37.14%(13/35),差异有统计学意义(χ2=6.937,P=0.008)。
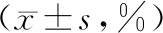
表2 两组患者血清T细胞亚群比较
3 讨论
乳腺癌为常见恶性肿瘤,可破坏乳房结构,同时癌细胞可随淋巴或血液扩散至全身,严重威胁患者生命。研究发现,正常乳腺组织HER-2呈阴性或低表达,而乳腺癌患者HER-2水平异常升高,与病灶大、淋巴结转移等预后不良因素有关[3]。临床治疗晚期乳腺癌以化疗为主,能有效杀灭癌细胞,但单纯应用化疗治疗效果不稳定,对于HER-2阳性患者抑制病情能力较差,易发生转移[4]。曲妥珠单抗为重组脱氧核糖核酸衍生单克隆抗体,以HER-2基因为靶点,能抑制HER-2蛋白表达,减少细胞生长信号传递,降低细胞膜HER-2蛋白水平,抑制肿瘤生长,同时还能通过补体依赖细胞毒性作用和抗体依赖细胞毒性作用,诱导机体杀灭肿瘤细胞[5]。肖聪等[6]研究显示,在CAF化疗治疗晚期乳腺癌的基础上加用曲妥珠单抗总有效率达92.4%,且治疗后1 a进展率明显降低。本研究结果显示,联合组疾病缓解率和生存率均高于化疗组,提示HER-2阳性晚期乳腺癌患者接受曲妥珠单抗联合GX化疗方案治疗能提高疾病缓解率和生存率,与上述研究结果[6]相似。T细胞亚群水平变化可反映免疫功能在晚期乳腺癌病情变化中的状态,指导临床治疗及预后判断[7]。本研究结果还显示,联合组治疗后血清CD3+、CD4+水平较化疗组高,CD8+水平较化疗组低,表明曲妥珠单抗联合GX化疗方案治疗HER-2阳性晚期乳腺癌患者能改善免疫功能。
肿瘤标志物为细胞癌变发生、发展过程中分泌的活性物质,其变化水平与治疗效果有关,对判断协助肿瘤化疗后治疗效果具有重要意义。CEA是一种糖蛋白,为广谱肿瘤标志物;CA153是一种黏液性糖蛋白;ICAM-1为细胞黏附分子,可促进内皮细胞向病灶黏附,参与新生血管生成,检测三者水平可用于疗效的判断[8-10]。本研究结果显示,治疗后联合组患者血清CA153、CEA、ICAM-1水平低于化疗组,表明曲妥珠单抗联合GX化疗方案治疗能降低HER-2阳性晚期乳腺癌患者血清CA153、CEA、ICAM-1水平。
综上,曲妥珠单抗联合GX化疗方案治疗HER-2阳性晚期乳腺癌患者能降低血清CA153、ICAM-1、CEA水平,改善免疫功能,从而提高疾病缓解率、生存率。
