心房颤动射频消融术后高度心房间传导阻滞对预测复发的价值
2020-12-22龚杨徐敏黄鹤
龚杨,徐敏,黄鹤
心房颤动(房颤,AF)是临床上最常见的心律失常之一,严重危害着公共健康,其在老年人群中的发病率和患病率不断上升,并与心血管事件和死亡风险的升高有关。近年来,多个大样本、多中心随机临床试验结果均表明导管消融对于房颤在维持窦性心律、减少房颤负荷、改善症状和运动耐量、提高生活质量等方面均明显优于抗心律失常药物治疗[1,2],然而房颤消融术后10%~40%的复发率仍是术后的主要问题[3],因此,寻找有效的预测房颤复发指标,辨别房颤术后易复发的高危人群有重要临床意义。心房间传导阻滞(IAB)是由左右心房传导延迟引起的,在体表心电图上表现为P波间期≥120 ms。根据P波形态,IAB可分为部分型心房间传导阻滞(p-IAB)和高度心房间传导阻滞(a-IAB)。p-IAB定义为P<120 ms,在下壁导联(Ⅱ、Ⅲ、aVF)中P波无双向波形;a-IAB定义为P≥120 ms,同时下壁导联P波呈双向形态[4]。近年来有研究表明,a-IAB与房颤药物复律后和房颤电复律后房颤的复发有密切关系,同时与Chagas心肌病及冠状动脉(冠脉)疾病等患者的房颤发生存在显著联系,在这些研究中,凡是具有a-IAB的患者,房颤的发生及复发率都显著较高[5-10]。本次研究旨在探讨a-IAB是否能够预测房颤射频消融术后的复发。
1 资料与方法
1.1 研究对象选取2017年至2018年于武汉大学人民医院心血管内科住院的房颤患者。纳入标准:所有患者术前签署手术知情同意书并为首次行房颤射频消融术,年龄18~75岁。排除标准:既往接受过射频消融治疗的心房颤动患者,近3个月内行冠脉介入术或冠脉搭桥术、电解质紊乱、严重心力衰竭、未控制的甲状腺功能异常、病态窦房结综合征、房室传导阻滞、严重的瓣膜病变、先天性心脏病史、凝血功能障碍、肺部疾病、严重肾功能不全的患者。入院时记录患者的基线人口学特征、既往史、用药史。所有患者均于术前在窦性心律时记录标准12导联心电图(25 mm/s,10 mm/mV)。采用半自动数字卡尺对12条导联进行盲测,获得最长的持续时间。IAB可分为部分型和高度型。部分IAB定义为:下壁导联中P波时限≥120 ms,且无双向波形;高度IAB定义为下壁导联P波时限≥120 ms,并存在双向波形。所有房颤患者术前均行超声心动图检查排除心脏异常结构,及经食道超声心电图排除心房血栓。
1.2 手术方法CARTO三维系统指导下重建左房及肺静脉解剖模型,送入消融导管至左心房,依次对左、右侧肺静脉行环形线性消融,消融后双侧肺静脉达到电隔离,对于持续性房颤患者还增加对左房顶部及二尖瓣峡部的消融线,直至消融后反复电刺激房颤不能诱发。对于术后未转成窦性心律者,则行心脏双向同步直流电复律(100~200 J)。
1.3 随访所有患者术后均随访1年,术后前3个月每月随访一次,于术后第3、6、12个月门诊随访,行12导联心电图及24 h动态心电图检查。若患者在随访期间出现心慌、胸闷等不适,则立即就诊。房颤复发的定义为:房颤导管消融术后3个月后仍有持续≥30 s的快速房性心律失常(房颤、房扑、房性心动过速)即为房颤晚期复发;而房颤导管消融术后3个月内出现的房性心律失常则视为早期复发。
1.4 统计学方法采用SPSS 23.0软件对数据进行统计学分析。正态分布的计量资料以(±s)表示,两组间的比较采用独立样本t检验;偏态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis检验;计数资料以构成比表示,组间比较采用χ2检验或Fisher 精确概率法。通过多因素Logistics回归分析来确定房颤复发的危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 房颤患者临床基线资料比较本研究共纳入206例房颤患者,其中阵发性房颤138例(67%),持续性房颤68例(33%),平均年龄(62.6±9.8)岁,男性137例(66.5%),平均P波间期为(110.3±14.2)ms,高度IAB占44例(21.3%)。
本研究随访期间,共62例(30.1%)射频消融术后患者复发房颤,其中阵发性房颤射频消融术后的复发率为23.9%(33/138),持续性房颤射频消融术后的复发率为42.6%(29/68)。复发组与未复发组患者相比,房颤病程更长[(49.3±28.3) vs. (39.5±26.8),P=0.019],P波间期更长[(113.5±14.2) vs. (108.8±14.0),P=0.026],左心房直径更大[(42.0±4.8) vs.(39.0±4.6),P<0.001],a-IAB所占比例更高[24(38.7%)vs. 20(14%),P<0.001]。两组患者在性别、年龄、收缩压、冠心病、高血压、高脂血症、脑梗塞、吸烟史、饮酒史、用药情况、Na、Cr、Tch、TG及LVEF等指标间无明显统计学差异(表1)。
表1 两组患者临床特征比较(±s)
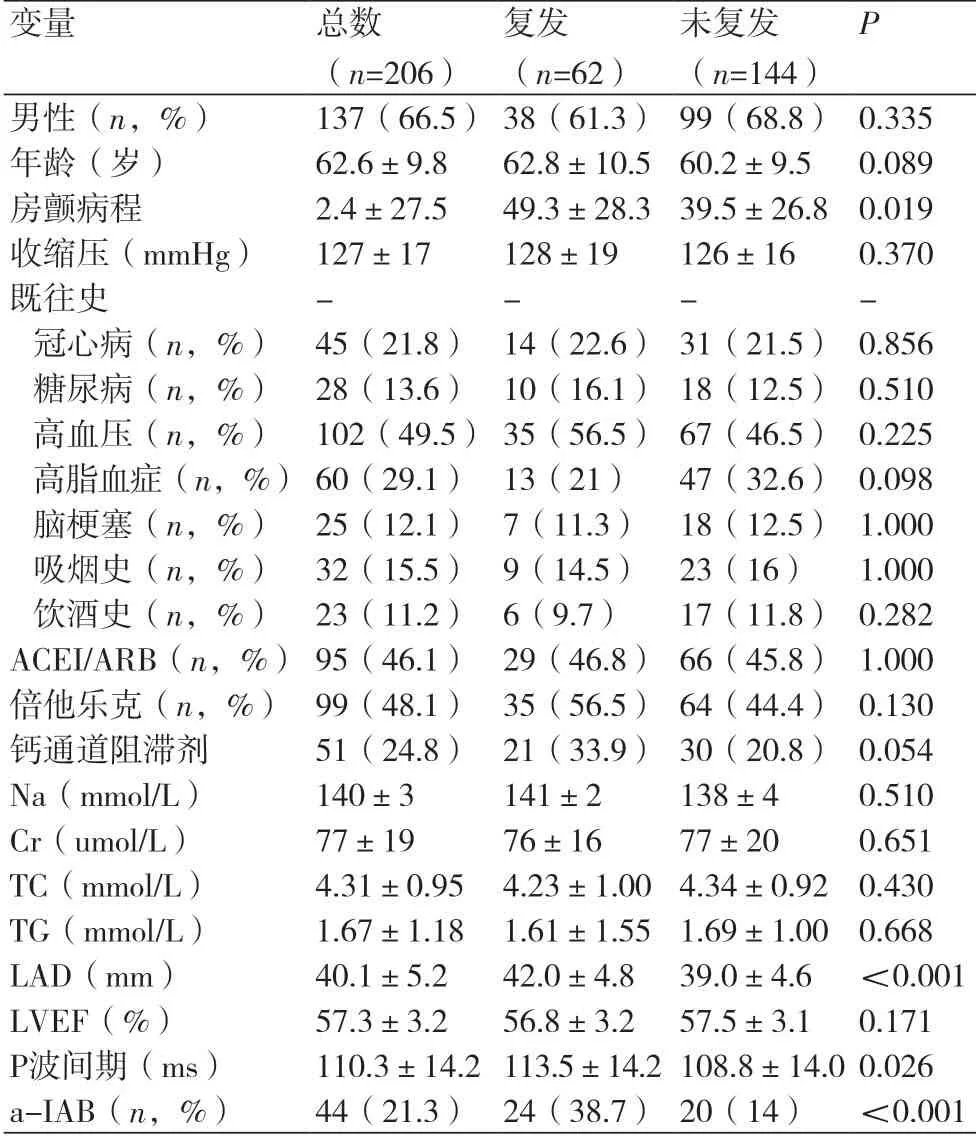
表1 两组患者临床特征比较(±s)
注:ACEI/ARB:血管紧张素转化酶抑制剂/血管紧张素Ⅱ受体阻滞剂;Na:钠;Cr:肌酐;TC:总胆固醇;TG:三酰甘油;LAD:左心房直径;LVEF:左心室射血分数;a-IAB:高度心房间传导阻滞
变量 总数(n=206)复发(n=62)未复发(n=144)P男性(n,%) 137(66.5)38(61.3)99(68.8)0.335年龄(岁) 62.6±9.8 62.8±10.5 60.2±9.5 0.089房颤病程 2.4±27.5 49.3±28.3 39.5±26.8 0.019收缩压(mmHg) 127±17 128±19 126±16 0.370既往史 - - - -冠心病(n,%) 45(21.8) 14(22.6)31(21.5)0.856糖尿病(n,%) 28(13.6) 10(16.1)18(12.5)0.510高血压(n,%) 102(49.5)35(56.5)67(46.5)0.225高脂血症(n,%)60(29.1) 13(21) 47(32.6)0.098脑梗塞(n,%) 25(12.1) 7(11.3) 18(12.5)1.000吸烟史(n,%) 32(15.5) 9(14.5) 23(16) 1.000饮酒史(n,%) 23(11.2) 6(9.7) 17(11.8)0.282 ACEI/ARB(n,%)95(46.1) 29(46.8)66(45.8)1.000倍他乐克(n,%) 99(48.1) 35(56.5)64(44.4)0.130钙通道阻滞剂 51(24.8) 21(33.9)30(20.8)0.054 Na(mmol/L) 140±3 141±2 138±4 0.510 Cr(umol/L) 77±19 76±16 77±20 0.651 TC(mmol/L) 4.31±0.95 4.23±1.00 4.34±0.92 0.430 TG(mmol/L) 1.67±1.18 1.61±1.55 1.69±1.00 0.668 LAD(mm) 40.1±5.2 42.0±4.8 39.0±4.6 <0.001 LVEF(%) 57.3±3.2 56.8±3.2 57.5±3.1 0.171 P波间期(ms) 110.3±14.2113.5±14.2108.8±14.00.026 a-IAB(n,%) 44(21.3) 24(38.7)20(14) <0.001
2.2 射频消融术后房颤复发的危险因素多因素logistic二元回归分析结果:对患者的年龄、房颤病程、左心房直径、P波间期,a-IAB纳入多因素回归分析发现,a-IAB[3.519(1.175~10.537),P=0.025],左心房直径[1.138(1.056~1.2226),P=0.001]为射频消融术后房颤复发的独立危险因素(表2)。
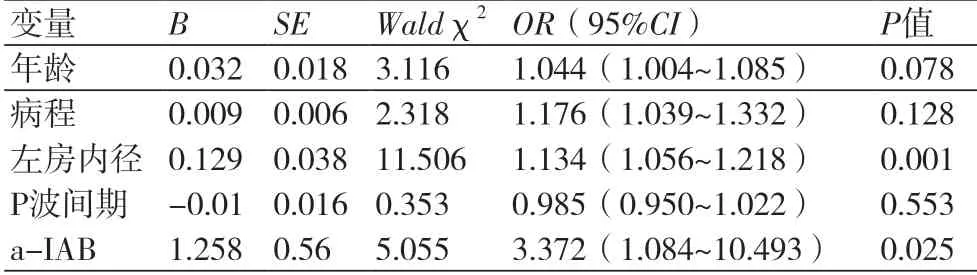
表2 多因素Logistics回归分析
3 讨论
心房颤动是临床上最常见的室上性心律失常,其不规则的心脏节律给人体带来较高的卒中风险,严重影响生活质量,严重者甚至导致患者死亡。近年来,经导管射频消融术已成为治疗房颤的重要手段,尽管该技术展现出较好的治疗前景,但仍存在一部分患者具有较高的复发风险。因此,寻找有效的房颤复发预测指标对于患者术后的预后有着重要意义[11]。本研究中,阵发性房颤的复发率为23.9%,持续性房颤的复发率为42.6%,与之前研究结果一致[3]。我们发现,具有a-IAB患者的房颤复发率显著较高,a-IAB和左心房直径为房颤复发的独立危险因素,能够独立预测房颤术后的复发。
左心房扩大与IAB是两个不同的概念[4],虽然IAB在心电图上主要表现为P波间期的延长,然而,左心房扩大的房颤患者,由于心房间传导距离增加,会导致心房间传导时间延迟,但此种情况下,并未发生心房间传导阻滞,其次a-IAB在心电图上的表现除了P波间期的延长之外,P波还呈现出双向形态,易于与左心房扩大心电图区别。有研究表明,心房间的传导主要发生在巴赫曼束,部分患者可通过卵圆窝完成双房之间的传导,极少数情况下发生在冠状窦水平[12,13]。巴赫曼束是左右心房间的主要传导路径,巴赫曼束的损害可能是IAB产生的病理生理基础,Waldo等对犬的实验也表明,巴赫曼束的破坏能够导致IAB的产生[14]。IAB发生的特殊解剖位置决定了其与房颤间有着密切关系。已有多个研究证实IAB与心房颤动的发生有着重要联系。在Cinier等[6]的研究中,198例急性ST段抬高型心肌梗死(STEMI)患者在随访期间,IAB组患者的心房颤动发生率显著高于对照组,表明IAB与房颤的发生存在明显关联,这与本研究结果一致。Bryce等通过对322例非ST段抬高型心肌梗死(NSTEMI)患者的研究也发现,a-IAB是房颤发生的危险因素,能够独立预测房颤的发生[10]。Bayés等通过对464例心衰患者随访发现,a-IAB能独立预测患者缺血性脑卒中和房颤的发生[9]。Wu等[15]研究结果也表明,a-IAB能够独立预测房颤射频消融术后的复发,除此之外,该研究也发现左心房直径也是房颤复发的独立危险因素,这与本研究结果基本一致,但与本研究不同的是,该研究只纳入了阵发性心房颤动患者。不仅如此,还有研究者认为,a-IAB是心房颤动的前期状态,为房颤发生的一个过渡状态[16]。目前得知,a-IAB的存在可能会导致左右心房之间的活动不同步,从而影响心房间的心电活动,心房间的心电活动异质性会导致左心房的电机械功能受损,房间活动不同步化,最终导致房颤易感性增加,同时,左心房收缩功能的减退也可使血流速度减慢,进一步诱发血栓形成和栓塞[7,9,17]。也有研究者认为,a-IAB是通过影响心房的收缩和舒张活动,间接影响二尖瓣的开放和关闭导致左心房压力升高,引起左心房扩张,而左心房扩张与房颤的复发存在密切关系[16]。
目前认为IAB的产生有多种病因,心房纤维化被认为是IAB产生的重要的机制之一[9,16]。在Cinier等研究中,STEMI患者经过心肌缺血再灌后,IAB的检出率显著下降,表明冠脉粥样硬化和心肌缺血也与IAB的产生也有着密切关系[6];除此之外,心肌退行性变化也是IAB产生的重要原因[16,18],心肌退行性变化,心肌纤维化和冠脉粥样硬化也与人口老龄化有关,表明老年患者更易出现IAB。
本研究的局限性:对于无症状房颤,我们缺乏一定的检出手段可能会对结果产生影响;同时,本研究为单中心研究,样本量不大,未来需要大样本、多中心研究来进一步证实。
综上所述,尽管a-IAB与房颤射频消融术后复发的内在机制尚未被完全阐明,但本研究证明a-IAB是房颤射频消融术后复发的危险因素,能够独立预测房颤的复发。
