枸杞多糖对高糖环境下HRCEC增殖及VEGF表达的影响
2020-12-21杨雪艳彭俊赵永旺唐云骢彭辉灿
杨雪艳 彭俊 赵永旺 唐云骢 彭辉灿


〔摘要〕 目的 观察不同浓度的枸杞多糖(lycium barbarum polysaccharide, LBP)对体外高糖环境下培养的人视网膜血管内皮细胞(human retinal capillary endothelial cells, HRCEC)增殖及血管内皮生长因子(vascular endothelial growth factor, VEGF)表达的影响。方法 获取人眼球摘除术后的HRCEC,予以体外培养,选取最佳状态的3~4代细胞;CCK8法检测在不同浓度LBP体外高糖环境下分别作用12、24、36 h后HRCEC的增殖情况;Western blot法检测各组HRCEC的VEGF表达情况。结果 同一时间组间比较,高糖组HRCEC活性及VEGF的表达量均高于低糖组(P<0.05);不同浓度LBP实验组HRCEC活性及VEGF表达量均明显低于高糖组(P<0.05),80 μg/mL LBP组HRCEC活性及VEGF表达低于20 μg/mL LBP实验组与40 μg/mL LBP实验组(P<0.05);各实验组在干预36 h时, HRCEC活性及VEGF表达低于干预12 h与24 h(P<0.05)。结论 LBP能抑制高糖环境下HRCEC的增殖并下调VEGF的表达,并与LBP浓度和作用时间正相关。
〔关键词〕 枸杞多糖;人视网膜血管内皮细胞;血管内皮生长因子;高糖;新生血管
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.11.002
〔Abstract〕 Objective To observe the effects of different concentrations of Lycium barbarum polysaccharide (LBP) on the proliferation of human retinal capillary endothelial cells (HRCEC) and the expression of vascular endothelial growth factor (VEGF) cultured in a high glucose environment in vitro. Methods The HRCEC was obtained after human eyeball enucleation, and cultured in vitro. The best 3 to 4 generation cells were selected; CCK8 method was used to detect the proliferation of HRCEC after 12 h, 24 h, 36 h under high glucose environment by different concentration of LBP in vitro; Western Blot method was used to detect VEGF expression of HRCEC in each group. Results In comparison between groups at the same time, HRCEC activity and VEGF expression in the high glucose group were higher than those in the low glucose group (P<0.05); HRCEC activity and VEGF expression in the LBP experimental group at different concentrations were significantly lower than those in the high glucose group (P<0.05). HRCEC activity and VEGF expression in 80 μg/m LLBP group were lower than 20 μg/mL LBP experimental group and 40 μg/mL LBP experimental group (P<0.05); HRCEC activity and VEGF expression in each experimental group with intervention for 36 h were lower than 12 h and 24 h (P<0.05). Conclusion LBP can inhibit the proliferation of HRCEC and down-regulate the expression of VEGF in a high glucose environment, and is positively correlated with the concentration of LBP and the duration of action.
〔Keywords〕 LBP; HRCEC; VEGF; high glucose; neovascularization
糖尿病視网膜病变(diabetic retinopathy, DR)发病率逐渐升高,世界范围内的糖尿病患者中,DR患病率约34%[1],DR早期症状隐匿,极易导致失明[2]。DR发生的主要原因是视网膜缺血缺氧,血管内皮细胞增殖,VEGF高表达,最终视网膜新生血管(retinal neovascularization, RNV)形成,DR的主要并发症是视网膜出血与黄斑水肿(diabetic macular edema, DME)。玻璃体腔注射抗VEGF药物虽然是DR并发黄斑水肿的一线治疗方法[3],但抗VEGF药物(雷珠单抗、贝伐单抗、阿柏西普、康柏西普等)价格昂贵、作用时间短[4]。寻求价格低廉、安全有效的抗VEGF药物成为目前DR研究的热点。枸杞多糖(lycium barbarum polysaccharide, LBP)是一种天然水溶性多糖,药理作用广泛。LBP可以降低DM小鼠的视网膜炎症反应、氧化应激反应及血管新生[5],LBP还可以抑制VEGF、Ang及其受体在DM小鼠视网膜中的表达,具有治疗DR的作用。既往虽然较多关于LBP在糖尿病、血管内皮细胞等方面的研究,但尚未发现在人视网膜血管内皮细胞(human retinal capillary endothelial cells, HRCEC)的相关研究,本文基于LBP对小鼠糖尿病VEGF抑制作用的基础上,研究了LBP对高糖环境下HRCEC及VEGF的影响,期望为研发防治DR新药物提供基础研究。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂 胎牛血清(Gibco公司,货号04-001-1ACS);LBP(陜西康盛生物技术有限公司,KS118,纯度35%);兔抗人VEGF 抗体(博奥森公司,货号bs-0279R);β-actin(Mouse)、HRP goat anti-mouse IgG、HRP goat anti-rabbit IgG(美国proteintech公司,货号依次为:66009-1-Ig、SA00001-1、SA00001-2);高糖培养基(SIGMA公司,货号D5796);蛋白预染Marker(Thermo公司);SuperECL Plus超敏发光液(美国Advansta公司,货号K-12045-D50);胰酶消化液、RIPA裂解液(中国上海碧云天生物有限公司,货号C0201、P0013B);显影液、定影液(中国上海佳信公司,BW-61、BW-62);蛋白裂解液(中国上海碧云天公司,货号P0013B);TEMED(中国上海阿拉丁公司,T105497);SDS(中国大连美伦公司,货号MB2479);第Ⅷ因子相关抗原抗体(Abcam公司)。
1.1.2 LBP溶液的配制 LBP母液配置:称取35%含量LBP 10 mg,加入10 mL DMEM高糖培养基稀释,摇匀、溶解,500 r/min离心5 min,双层0.22 μm微孔滤膜过滤细菌及沉淀,并密封分装,4 ℃保存。此时母液配置完成,含量为1 mg/mL。配置实验LBP浓度,移取母液200 μL置于15 mL离心管中,加入DMEM高糖培养基至10 mL,反复摇匀,配置成20 ?滋g/mL LBP,做好标记,置于4 ℃冰箱保存。
1.2 实验方法
1.2.1 HRCEC的培养 在南华大学第二附属医院手术室选取角膜移植手术后余下的眼球,庆大霉素注射液浸泡30 min,分离视网膜神经上皮层,常温下2%胰蛋白酶消化,过滤,加入20%小牛血清培养液停止消化,1 200 r/min离心8 min,去除上清液,在离心管内加入10% Gibico FBS+1%双抗的DMEM培养基吹打混匀,接种于含有10% Gibico FBS+1%双抗的DMEM培养基,再置入37 ℃、5% CO2培养箱培养。待细胞铺满整个培养皿底部约80%时进行传代。
1.2.2 HRCEC鉴定 (1)细胞爬片;(2)固定:PBST洗涕,加入4%PFA(多聚甲醛),4 ℃细胞培养箱30 min固定;(3)按照Western blot实验步骤进行破膜封闭、一抗孵育、二抗孵育;(4)包埋:抽取已二抗孵育好的细胞爬片,PBST缓冲液清洗,滴取1滴Fluoromount-G后盖玻片再盖上;(5)阳性染色镜检示:经过山羊抗小鼠IgG二抗橙红色DyLight594荧光标记。显微镜下观察并采集图像。
1.2.3 实验分组 取对数生长的细胞进行分组:(1)AL组:低糖对照组(低糖+细胞);(2)AG组:高糖对照组(高糖+细胞);(3)A1组:20 μg/mL LBP实验组;(4)A2组:40 μg/mL LBP实验组;(5)A3组:80 μg/mL LBP实验组。其中低糖浓度为1 g/L,高糖浓度为4.5 g/L;实验组为不同浓度LBP+高糖培养基+细胞。
1.2.4 CCK8法行细胞增殖活性的检测 取对数生长期的细胞,消化计数,以5×103个细胞/孔密度接种于96孔板内,每孔100 μL。各组均设5个复孔,培养贴壁,每孔加入10 μL/孔的CCK8,用完全培养基配置CCK8溶液,去除含药培养基每孔加入100 μL含有CCK8的培养基。37 ℃,5% CO2继续孵育4 h后于Bio-Tek酶标仪测定450 nm处吸光度(OD)值,测定各组HRCEC的增殖活性。
增殖抑制率=(高糖对照组OD值-药物干预组OD值)/高糖对照组OD值×100%
1.2.5 Western blot 蛋白检测 (1)PBS洗涤细胞,3 000 r/min离心2 min,加入120 μL RIPA裂解液,超声破碎1.5 min;冰上裂解;4 ℃,12 000 r/min离心15 min;取上清液。按照BCA法,测定550nm之间波长的吸光值,根据标准曲线计算蛋白浓度。(2)样品准备:取80 μL蛋白上清,加入20 μL 5*loading buffer混匀,沸水煮5 min,放入冰盒中速冷备用。(3)电泳:点入marker 2 μL,其它按照分组顺序每孔上样15 μL已变性蛋白。恒定电压75 V,130 min。(4)转膜:分别切胶VEGF(24kD),β-actin(42kD);300 mA恒定电流转膜,VEGF约39 min,β-actin 约60 min。(5)封闭:用1*PBST配制5%脱脂奶粉,室温封闭60 min,4 ℃过夜,次日室温放置30 min。(6)一抗孵育:加入一抗(Rabbit Anti-VEGF antibody (bs-0279R),1∶1 000;Mouse anti-β-actin antibody(66009-1-Ig)1∶5 000,室温孵育90 min;1*PBST洗3次,每次15min。(7)二抗孵育:加入二抗(HRPgoatanti-mouse IgG,SA00001-1,1∶5 000;HRPgoat anti-rabbit IgG,SA00001-2,1∶6 000)温孵育90 min后1*PBST洗3次,每次10 min。(8)显色/曝光:化学发光法(chemiluminescence, ECL)显色曝光,显影冲洗,Image lab软件分析灰度值。
1.3 统计学处理
运用统计学软件SPSS 25.0进行数据分析,全部的计量资料均采用“x±s”表示,选用t检验行两组数据间比较,应用单因素方差分析(ANOVA One-Way)进行多组数据之间比较,P<0.05表示具有统计学差异。
2 结果
2.1 HRCEC的培养及鉴定
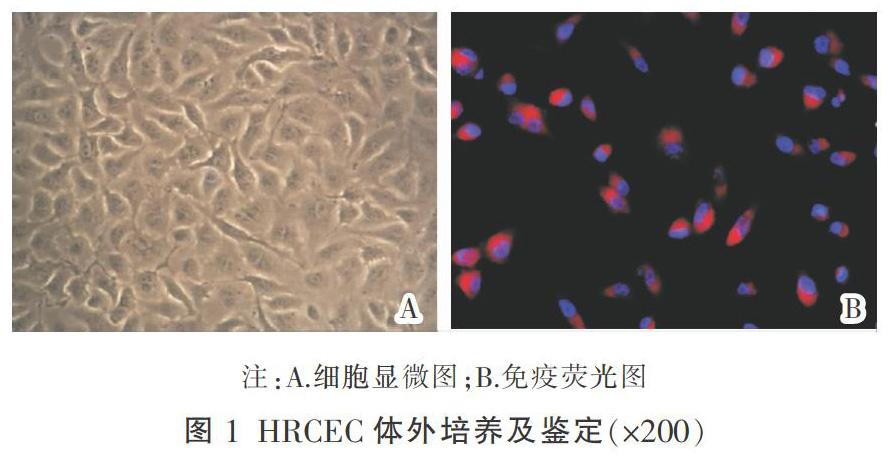
HRCEC新提取时混有白细胞、周细胞等杂质细胞,培养24 h开始贴壁,细胞呈梭形,经过10 d观察到HRCEC形成细胞集落。含有10%Gibico FBS+1%双抗的DMEM培养,丢弃凋亡细胞,留优良的HRCEC。培养半月时观察发现HRCEC铺满培养皿底部,呈铺路石样(图1A)。经山羊抗小鼠IgG二抗橙红色DyLight594对第Ⅷ因子相关抗原抗体荧光标记,HRCEC胞膜与胞浆特异性染色呈橘红色,非特异性染色法对细胞核呈现蓝色(图1B),阳性着色细胞94.6%,对照组未见明显着色,表示在外培养的HRCEC成功存活。
2.2 CCK8法检测LBP对体外HRCEC增殖的影响
不同时间组间比较,HRCEC细胞增殖差异具有统计学意义(P<0.05)。组间两两比较:与低糖对照组相比,高糖对照组、各浓度LBP组的HRCEC数目增多(P<0.05);与高糖对照组相比,各浓度LBP组的HRCEC数目减少(P<0.05);与A1组相比,A2组和A3组HRCEC数目减少(P<0.05);与A2组相比,A3组HRCEC数目减少(P<0.05)。同组不同时间比较差异具体统计学意义(P<0.05),36 h时各浓度LBP组HRCEC数目低于12 h与24 h,差异具体统计学意义(P<0.05)。见表1。
2.3 LBP对体外HRCEC中 VEGF的表达影响
采用免疫印迹法检测细胞中VEGF表达情况,不同时间组间比较差异具有统计学意义(P<0.05)。组间两两比较:与低糖对照组相比,高糖对照组、各浓度LBP组的VEGF表达增多(P<0.05);与高糖对照组相比,各浓度LBP组的VEGF表达减少(P<0.05);与A1组相比,A2组和A3组VEGF表达减少(P<0.05);与A2组相比,A3组VEGF表达减少(P<0.05)。同组不同时间比较,VEGF表达差异具体统计学意义(P<0.05),36 h时各浓度LBP组VEGF表达低于12 h与24 h,差异具體统计学意义(P<0.05)。见表2、图2。
3 讨论
DM属于中医学“消渴症”范畴,DR被称为“消渴内障”[6]。李传课等[7]认为DR是在脉络瘀滞与阴虚燥热的基础上发病,其主要病机为血瘀、燥热、阴伤,发病的关键是脏腑功能失调、阴阳失衡。
西医学认为胰岛β细胞分泌功能障碍可导致DM的发生,其与遗传、自身免疫、遗传等因素相关。高血糖导致眼视网膜血管发生病变,早期DR无自觉症状,很大一部分患者就诊是DR病程已进展到PDR,眼底出现视网膜毛细血管闭塞无灌注、基底膜增厚、细胞增殖和迁移、视网膜纤维化、黄斑水肿、RNV形成、视网膜前出血等,而PDR眼致盲率非常高,其中Ⅰ型DM导致高达86%、Ⅱ型DM达33%[8-9]。
RNV形成是PDR最具特征的病理性改变,在发病过程中VEGF、IGF-1、TNF、PEDF等细胞因子相互作用破坏血-视网膜屏障(blood-retinai barrier,BRB)、引发RNV形成,其中VEGF升高可促进视网膜色素上皮细胞生长、增殖[10],增加血管通透性、促进视网膜出血、渗出、水肿[11],生成蛋白酶及推进血管内皮细胞增殖和移动[12],VEGF在一定程度上可促进缺血性视网膜疾病黄斑水肿的发生[13]。PDR患者视网膜、玻璃体、房水中VEGF浓度增高,导致视网膜血管渗漏及视网膜、虹膜、房角新生血管形成,加速PDR进程,继发新生血管性青光眼等可能,VEGF在PDR发病过程及引发的并发症中起着重要作用。
DR常见西医治疗:视网膜激光光凝、抗VEGF药物、激素、手术,但这些方法均不能纠正DR病理改变[14-15],且存在不同的缺点:激光治疗可能出现黄斑水肿、玻璃体积血、视野缺损、视力下降等并发症[16];激素可造成继发性青光眼、白内障加速形成;手术费用高、硅油乳化、继发青光眼等;而DR属于中医优势病种,银杏软胶囊、双丹明目胶囊、和血明目片等在防治DR方面取得了很好的疗效。
LBP[17]由枸杞成熟果实经过脱脂、水提、反复醇沉获取,由6种单糖组成的蛋白多糖,易溶于稀酸、稀碱溶液或热水,可被丙酮、乙醇等有机溶剂析出,存在多种生物活性。在传统祖国医学中,DR被称为消渴目病,早有记载LBP对消渴目病存在治疗的功效。在《本草通玄》中记载:“枸杞子补肾益精,水旺则骨强,而消渴目昏,腰疼、膝痛无不愈矣”,枸杞既可降低血糖又可补肝明目,成为补肾益精首选。
LBP(200 μg/mL)可明显降低血清中脐静脉血管内皮细胞(HUVECs)生长因子的含量、缩短血管内皮细胞周期,加速其凋亡,从而抑制HUVECs细胞新生血管形成[18];LBP可抑制炎症因子产生,抑制氧化应激反应等,减轻LPS对HUVECs增殖的抑制作用,且LBP浓度为100 μg/mL的中剂量组为最佳治疗浓度[19]。而HRCEC细胞与HUVEC细胞具有同源性,但人视网膜血管属于微血管,因此,此实验选择较低浓度(20、40、80 μg/mL)LBP处理高糖(葡萄糖4.5 g/L)环境下HRCEC,对照组低糖环境(葡萄糖1 g/L)。
本实验模拟HRCEC在高糖环境下的增殖以及VEGF表达作用,观察发现LBP对HRCEC增殖及VEGF表达具有明显的抑制作用,HRCEC在高糖环境下增殖速度较低糖环境下明显加快,且VEGF的表达量显著增加,这与目前DM患者血管内皮细胞增殖、新生血管形成相符合。视网膜VEGF升高促进RNV形成对DR的病程进展起到推进作用,因此,我们实验研究选择VEGF作为目的蛋白,观察并检测了LBP对高糖环境下HRCEC增殖及VEGF表达的影响。CCK8及WB实验显示:LBP对高糖环境下培养的HRCEC的增殖及VEGF的表达具有抑制作用,且80 μg/mL LBP组干预36 h抑制作用最强。因此,LBP可能通过抑制VEGF的表达来抑制HRCEC增殖。
LBP通过降低血糖、胆固醇和甘油三酯,逆转因高糖造成的视网膜渗漏从而保护血-视网膜屏障,抑制ROCK1蛋白表达及P-MLC信号通路来维持细胞紧密连接,降低大鼠DM视网膜血管VEGF表达来降低基底膜增厚、减轻周细胞和血管内皮细胞的水肿、减少对视细胞的损害,降低大鼠DM视网膜氧化损伤[17]。我们推测LBP可能是通过抑制ROCK1蛋白表达及P-MLC信号通路来降低VEGF表达,从而降低基底膜增厚、减轻周细胞和血管内皮细胞水肿,减轻视网膜渗漏、降低DM视网膜氧化损伤,LBP可抑制VEGF、Ang及受体表达,从而抑制糖尿病RNV形成[18]。
此实验表明,LBP具有抑制高糖环境下HRCEC增殖及VEGF表达的作用,但未进一步对LBP抑制VEGF表达的作用机制深入研究,因此,我们将在后续实验中将进一步研究LBP抑制VEGF表达及血管内皮细胞增殖的作用机制。
参考文献
[1] GUNASEKERAN D V, TING D S W, TAN G S W, et al. Artificial intelligence for diabetic retinopathy screening, prediction and management[J]. Current Opinion in Ophthalmology, 2020, 31(5): 357-365.
[2] LEASHER J L, BOURNE R R A, FLAXMAN S R, et al. Global estimates on the number of people blind or visually impaired by diabetic retinopathy: A meta-analysis from 1990 to 2010[J]. Diabetes Care, 2016, 39(9): 1643-1649.
[3] CAI S W, YANG Q H, LI X R, et al. The efficacy and safety of aflibercept and conbercept in diabetic macular edema[J]. Drug Design, Development and Therapy, 2018, 12: 3471-3483.
[4] SIBEL, DOGUIZI, SENGUL, OZDEK. Pigment epithelial tears associated with anti-VEGF therapy:incidence, long-term visual outcome, and relationship with pigment epithelial detachment in age-related macular degeneration[J]. Retina, 2014, 34(6): 1156-1162.
[5] 張慧西,薛 凯,高 伟,等.枸杞多糖对糖尿病小鼠视网膜内血管新生及氧化应激反应、炎症反应的抑制作用[J].海南医学院学报, 2016,22(20):2365-2368.
[6] 彭清华.中医眼科学[M].4版.北京:中国中医药出版社,2016.
[7] 李 波,李传课.李传课治疗糖尿病视网膜病变经验[J].中国中医眼科杂志,2015(4):284-286.
[8] 曾志成,彭 俊,李文杰,等.中药汤剂口服联合玻璃体内注射曲安奈德对非增生性糖尿病视网膜病变黄斑水肿患者血清及玻璃体液IL-6、VEGF表达的影响[J].湖南中医药大学学报,2019,39(1):
68-72.
[9] 彭 俊,潘 坤,刘峥嵘,等.双丹明目胶囊对糖尿病模型大鼠视网膜VEGF-a、VEGF-b表达的影响[J].湖南中医药大学学报,2018, 38(6):635-640.
[10] D?魱AZ-COR?譧NGUEZ M, LIN C M, LIEBNER S, et al. Norrin restores blood-retinal barrier properties after vascular endothelial growth factor-induced permeability[J]. The Journal of Biological Chemistry, 2020, 295(14): 4647-4660.
[11] GABRIELLE P H, NGUYEN V, WOLFF B, et al. Intraocular pressure changes and vascular endothelial growth factor inhibitor use in various retinal diseases: Long-term outcomes in routine clinical practice[J]. Ophthalmology Retina, 2020, 4(9): 861-870.
[12] SIEDLECKI J, FISCHER C, SCHWORM B, et al. Impact of sub-retinal fluid on the long-term incidence of macular atrophy in neovascular age-related macular degeneration under treat & extend anti-vascular endothelial growth factor inhibitors[J]. Scientific Reports, 2020, 10(1): 8036.
[13] RA H, PARK J H, BAEK J U, et al. Relationships among retinal nonperfusion, neovascularization, and vascular endothelial growth factor levels in quiescent proliferative diabetic retinopathy[J]. Journal of Clinical Medicine, 2020, 9(5): 1462.
[14] SINGH S R, SINGH R. Panretinal photocoagulation vs anti-vascular endothelial growth factor for proliferative diabetic retinopathy[J]. JAMA Ophthalmology, 2016, 134(6): 715-716.
[15] SUBASH M, COMYN O, SAMY A, et al. The effect of multispot laser panretinal photocoagulation on retinal sensitivity and driving eligibility in patients with diabetic retinopathy[J]. JAMA Ophthalmology, 2016, 134(6): 666-672.
[16] 王露露,孙艳红,韦企平,等.糖尿病视网膜病变激光治疗的并发症及其防治[J].国际眼科杂志,2019,19(3):405-408.
[17] 王继红.枸杞多糖对糖尿病大鼠血—视网膜屏障的保护作用及ROCK通路表達的机理研究[D].沈阳:辽宁中医药大学,2010.
[18] 尹逊天,王 巍,朱玉峰,等.枸杞多糖对人脐静脉血管内皮细胞的增殖、迁移及血管形成的影响[J].中国老年学杂志,2016,36(8): 1819-1822.
[19] 刘 倩,韦建瑞,张 雷,等.枸杞多糖通过抑制NF-κB信号通路保护脂多糖损伤的人脐静脉血管内皮细胞增殖活性与分泌功能[J].暨南大学学报(自然科学与医学版),2017,38(3):240-246.
