雌性大鼠手术去势骨质疏松症模型建立及评价
2020-12-21陈沙王桂云李荣慧向振吴结枝卓海燕刘平安张国民
陈沙 王桂云 李荣慧 向振 吴结枝 卓海燕 刘平安 张国民

〔摘要〕 目的 从动情周期、骨密度、骨组织形态结构和原代骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMMSCs)生长曲线4个层次判定雌性大鼠手术去势造模是否成功。方法 30只2月龄SPF级雌性大鼠,随机平均分为空白组、假手术组和模型组3组。手术去势造模完成后次日起连续7 d对3组大鼠进行阴道脱落细胞涂片,判断动情周期。造模后第8天取左侧股骨组织做骨密度测定和HE染色,取右侧骨组织分离原代BMMSCs。结果 空白组和假手术组动情周期正常,模型组大鼠动情周期紊乱;骨组织HE染色显示模型组骨小梁稀少且间距加大;与空白组比较,假手术组骨密度和BMMSCs生长速率差异无统计学意义(P>0.05),与假手术组相比,模型组骨密度显著降低,BMMSCs生长速率显著下降,差异具有统计学意义(P<0.01)。结论 造模成功后的雌性大鼠动情周期紊乱,骨密度降低,骨小梁疏松,BMMSCs的生长缓慢,为骨质疏松症动物模型建立判定提供较全面的依据。
〔关键词〕 去势雌性大鼠;骨质疏松症;动物模型;动情周期;骨密度;骨髓间充质干细胞
〔中图分类号〕R-332 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2020.11.003
〔Abstract〕 Objective To determine the success of female rats' surgical castration model from four levels of estrus cycle, bone density, bone tissue morphology and primary bone marrow mesenchymal stem cells (BMMSCs) growth curve. Methods Thirty two-month-old SPF female rats were randomly and equally divided into 3 groups: a blank group, a sham operation group and a model group. The vaginal exfoliated cell smears were performed on the 3 groups of rats for 7 consecutive days after the completion of the surgical castration model to determine the estrus cycle. On the 8th day after modeling, the left femur tissue was taken for bone density determination and HE staining, and the right bone tissue was separated from primary BMMSCs. Results The estrous cycle of the blank group and the sham operation group was normal, and the estrus cycle of the model group was disordered. The HE staining of bone tissue showed that the bone trabecula of the model group was sparse and the spacing increased; Compared with the blank group, the differences in bone density and BMMSCs growth rate of the sham operation group had no statistical significance (P>0.05). Compared with the sham operation group, the bone density of the model group was significantly reduced, and the growth rate of BMMSCs was significantly reduced. The difference was statistically significant (P<0.01). Conclusion After successful modeling, female rats have estrous cycle disorder, decreased bone density, bone trabecula porosity, and slow growth of BMMSCs, which provide a more comprehensive basis for the establishment of osteoporosis animal models.
〔Keywords〕 ovariectomized female rat; osteoporosis; animal model; estrous cycle; bone density; bone marrow mesenchymal stem cells
根據国家统计局调查显示[1],我国65岁以上人口接近1.4亿(约占总人口的10.1%),是世界上老年人口绝对数最多的国家。有专家预测[2],2050年我国用于治疗原发性骨质疏松症性骨折费用将达1 630亿元。随着人口老龄化趋势的日益加重,骨质疏松症将成为我国重要的公共健康问题,因此,开展骨质疏松症研究具有较高的科学价值。目前,骨质疏松症的发病机制尚不明确,在针对骨质疏松症发生机制开展的各种研究方法中,动物模型是目前较为常用的一种研究方法。造模方法中的手术去势是指通过去除雌性大鼠双侧卵巢的方法造成雌激素水平急剧下降、骨量大量丢失,建立骨质疏松症模型,具有建模因素单一、建模成功率高、可重复性好、可信度高和能够很好地体现雌激素水平下降这一重要病理生理现象等优点[3]。本实验采用雌性大鼠作为研究动物[4],通过阴道脱落细胞涂片、股骨密度测定、骨组织形态和原代骨髓间充质干细胞(bone
marrow mesenchymal stem cells, BMMSCs)生长曲线4个层次的客观指标来判定造模是否成功[5]。
1 材料
1.1 动物
SPF级SD雌性大鼠,许可证号:SCXK(湘)2016-0002,体质量190~250 g,6~8周龄,30只,购自湖南斯莱克景达实验动物有限公司,于湖南中医药大学清洁级动物实验中心饲养,实验单位许可证号:SYXK(湘)2013-005。动物分笼饲养。环境温度为(22±4) ℃,湿度为50%±10%,自由进食进水,饲料为标准普通饲料(湖南中医药大学动物实验中心提供),并保持环境安静,定时清扫鼠笼卫生。实验过程中对动物的处置符合实验动物管理和使用委员会的要求,适应性喂养1周后进行试验。
1.2 试剂
低糖DMEM基础培养(美国Gibco公司,批号8657263);FBS胎牛血清(美国Gibco公司,批号42A0071K);双抗(美国Gibco公司,批号1999384);Trypsin-EDTA(美国Gibco公司,批号1868583);PBS(美国Hyclone公司,批号AD1779227);CCK-8试剂盒(上海七海复泰生物科技有限公司,批号20190124);FITC anti-mo/rat CD29抗体(美国eBioscience公司,批号11-0291-80);FITC anti-rat CD90抗体(美国Biolegend公司,批号206105);CD34(美国Abcam公司,批号ab81289);CL488-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)(美国Proteintech公司,批号SA00013-2)等。
1.3 仪器
HR30-IIA2型生物安全柜(中国海尔集团公司);311型CO2培养箱(美国赛默飞世尔科技公司);AE2000型倒置显微镜(中国麦克奥迪实业集团公司);低速离心机(美国莱伯特公司);DCW-3510型恒温水浴锅(中国宁波新芝生物科技股份有限公司);全身双能X线骨密度仪(北京中西远大科技有限公司);MIAS型医学图像分析系统(成都泰盟软件有限公司);Ni-U型研究型正置显微镜(日本株式会社尼康公司);A00-1-1102型流式细胞仪(美国贝克曼库尔特有限公司)等。
2 方法
2.1 动物分组及造模
按照随机数字表法将30只SPF级雌性大鼠分为空白组、假手术组和模型组3 组,每组10只。模型组采用去除雌性大鼠双侧卵巢方法建立绝经后骨质疏松症模型[5-6],现配10%的水合氯醛溶液,浓度为3 mL/kg。假手术组和模型组大鼠腹腔注射水合氯醛溶液麻醉,俯卧位固定于大鼠板上,剃毛消毒后,沿第一胸腰椎两侧外1 cm处纵向切开皮肤肌肉,分离找到卵巢,结扎后完整摘除两侧卵巢,分两层缝合切口,用无菌生理盐水冲洗伤口,络合碘消毒[7]。术后连续3 d在假手术组和造模组大鼠后腿肌肉内侧注射青霉素,每只4万IU/d,6 d后拆线,空白组不做任何处理。
2.2 雌性大鼠阴道脱落细胞涂片
造模后第1天清晨10点,取空白组、假手术组和模型组3组大鼠,用小号无菌棉签进入大鼠阴道内,轻轻旋转棉签后,将阴道分泌物涂抹在已经滴加了少量生理盐水的防脱玻片上(均匀平铺即可),待玻片自然风干后进行HE染色,1次/d,连续7 d。将7 d的玻片收集到一块进行HE染色。
2.3 骨密度测定和骨组织HE染色观察微细结构
造模后第8天,采用颈椎脱臼法处死所有动物。左侧股骨組织用于骨密度测定和骨组织HE染色。每组5只雌性大鼠左后肢用湿纱布包裹,送至湖南中医药大学药学院实验中心送检,用Unigamma X-RAY Plus双能X线骨密度仪检测雌鼠左后肢股骨密度。每组另5只雌性大鼠左后肢去除毛发后固定在4%PFA中,在5%的硝酸中脱钙7 d,进行HE染色[8],检测股骨病理形态学变化。
2.4 BMMSCs的分离
造模后第8天,各组大鼠右侧骨组织均用于提取BMMSCs。全骨髓贴壁法分离BMMSCs及传代培养:清洁消毒操作区域,细胞房紫外消毒灭菌30 min,将大鼠右后肢在装有医用酒精的烧杯中浸泡2 min后剪去毛发及肌肉显露骨组织,剪断骨组织两端骨骺露出骨髓腔,用预先配制好的DMEM完全培养液冲洗骨髓腔,将冲洗液收集在无菌15 mL BD管中,离心去上清,加完全培养基进行重悬后,转移至25 cm2培养瓶中,做好组别和P0代标记。
2.5 BMMSCs的鉴定
细胞培养至P2代后对细胞进行鉴定。各取100 μL细胞悬液,分别加入到含抗体的离心管中,每种抗体分成5份,3种抗体总计15管,混匀,4 ℃避光孵育30 min,同时设置一管不染抗体管,具体标记如下(未染:不加抗体,不做染色;CD34:染CD34抗体;CD29:染CD29-FITC抗体;CD90:染CD90-FITC抗体),PBS洗细胞2次,800 rpm离心5 min;其中CD34管继续加入100 μL CL488-conjugated Affinipure Goat Anti-Rabbit IgG(H+L)二抗(1∶100稀释),继续避光孵育1 h,PBS洗细胞2次,800 rpm离心5 min,350 μL PBS重悬细胞。上机检测,进行细胞形态学观察及表面标记抗原CD90、CD29和CD34的鉴定。
2.6 BMMSCs生长曲线测定
将P2代细胞胰酶消化,加入完全培养液终止消化后800 rpm离心5 min,去上清,重新加入完全培养液,对细胞悬液进行计数。经预实验发现,BMMSCs在浓度为2×104个/mL时,CCK-8试剂盒检测结果较为理想。该细胞生长周期为7 d,所以绘制完整的生长曲线需要7块96孔板。按2×103个/孔,每孔100 μL接种到96孔板当中,依次加入空白组、假手术组、模型组细胞悬液,每组做5个复孔。第1天,在各孔中加入CCK-8溶液10 μL,4 h后在450 nm波长处进行OD值测定,依次7 d,绘制BMMSCs的生长曲线。
2.7 统计学分析
本实验数据采用SPSS 21.0统计软件对数据进行分析。计量资料用“x±s”表示,多组间分析用单因素方差分析,以P<0.05为差异有统计学意义。
3 结果
3.1 动情周期判断
由图1可知,空白组和假手术组的大鼠有稳定的动情周期,模型组则持续性在动情前期和动情间期,动情周期紊乱。动情前期,阴道脱落细胞大部分是有细胞核上皮细胞,偶见少量角化上皮细胞;动情期,可见大部分无核角化细胞;动情后期阶段,白细胞、有核上皮细胞和角化细胞伴行出现;动情间期时,白细胞不断增多,角化细胞持续减少,直到后期以白细胞为主。
3.2 雌性大鼠股骨密度测定
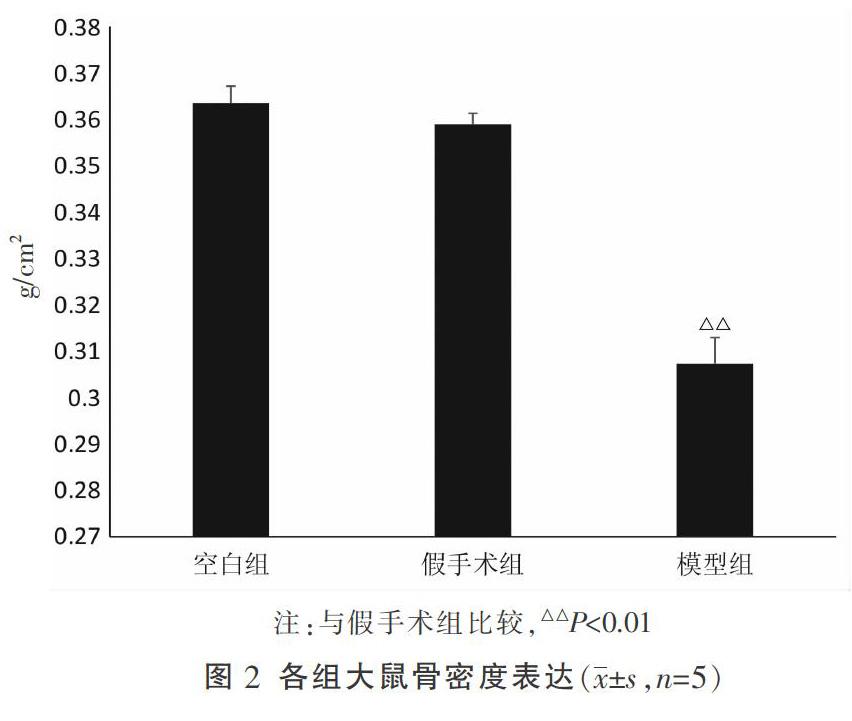
与空白组比较,假手术组股骨密度差异无统计学意义(P>0.05)。与假手术组比较,模型组股骨密度降低,差异有统计学意义(P<0.01)。结果见图2。
3.3 股骨HE染色结果分析
空白组和假手术组骨膜完整,骨小梁致密且宽,骨领中有数量较为丰富的成骨细胞,可见初级骨化中心与骨髓腔形成,许多初级骨髓腔融合成一个不断增大并加长的骨髓腔;模型组骨髓腔较小,细胞种类少,骨小梁稀少且窄,小梁间距加大,骨膜较不完整。如图3所示。
3.4 BMMSCs的鉴定
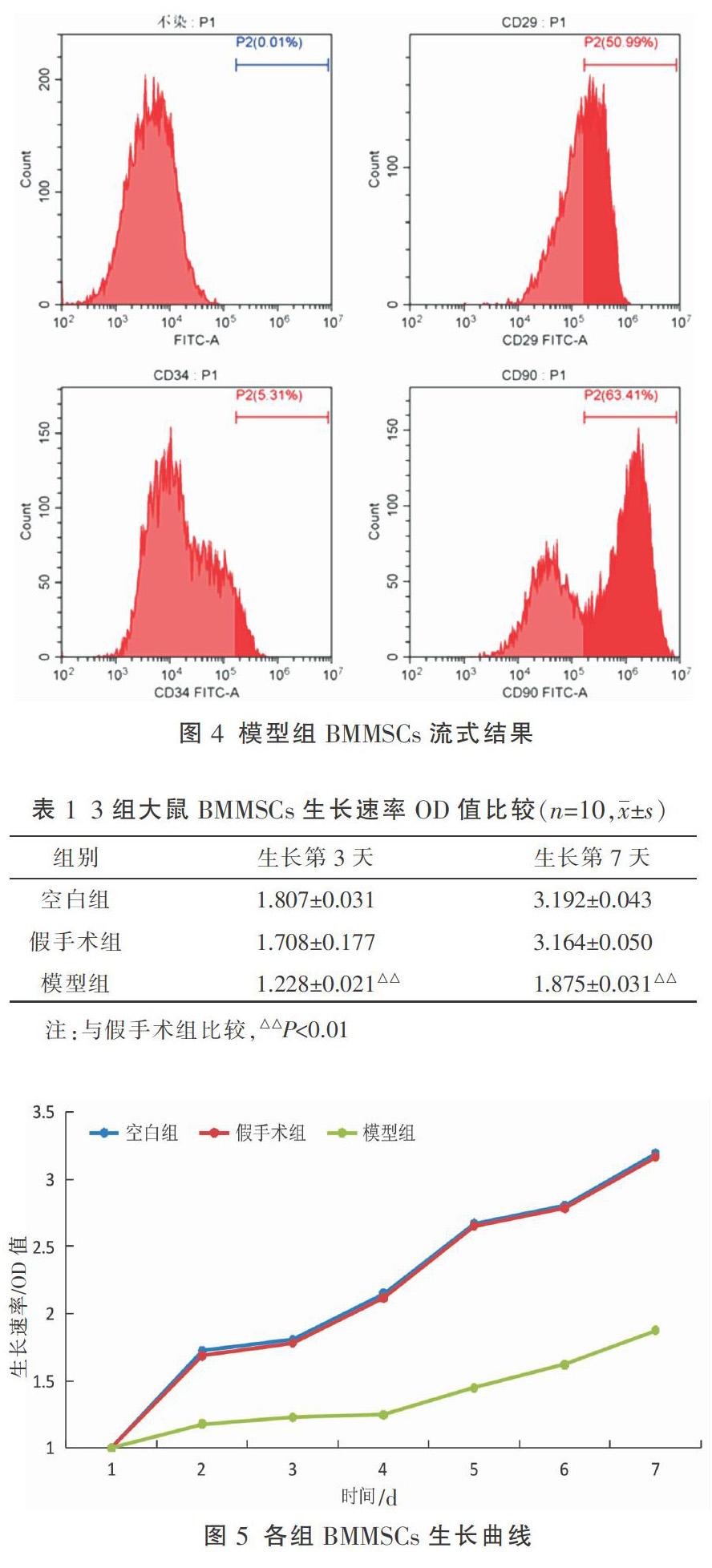
流式细胞仪鉴定后发现,模型组BMMSCs的CD90、CD29阳性表达分别为63.41%和50.99%,而CD34阳性比为5.31%。结果如图4所示。
3.5 BMMSCs生长速率OD值曲线
空白组、假手术组和模型组第3天和第7天生长速率OD值见表1。与空白组比较,假手术组生长速率差异无统计学意义(P>0.05),与假手术组比较,模型组生长速率均显著降低(P<0.01)。
从图5可以看出各组BMMSCs的生长曲线呈“S”形,空白组和假手术组进入对数生长期正常,为第3天,模型组进入对数生长期较慢,为第4天。从第2天起,各组BMMSCs的生长加快。第3天起,与空白组比较,假手术组生长速率差异无统计学意义(P>0.05)。与假手术组比较,模型组生长速率差异降低(P<0.01),细胞进入对数生长期以后,生长趋势一致。第7天细胞生长速率不再增加,趋于平稳。各组生长速率趋势为:空白组=假手术组>模型组。
4 讨论
人类疾病的动物模型是生物医学研究中所建立的,能模拟人类疾病表现的动物实验对象,是现代生物医学研究的一个重要手段[6]。从动物模型中可较为客观地反应疾病特点,对科学研究具有一定帮助。由于骨质疏松症是一种病程较长的疾病,在不同阶段有不同的特点,雌性大鼠作为手术去势造模的方法已较为成熟。随着基础研究的深入,判定去势造模的依据将会越来越接近临床实际,为患者和疾病规律探索作出贡献。
手术去势法造模因素单一,重复性强,具有较高的可信度,但是雌激素水平突然迅速地降低,这与自然病程中雌激素长期、缓慢地下降不一致[3]。阴道脱落细胞具有较易涂片、在体实验和操作相对简便的特点,且细胞类型经染色固定后形态很难发生改变,能动态反应动情周期中各期的细胞类型,但在遇上阴道感染时,也可见大量白细胞,难以与以白细胞为主的动情间期相区分,常易因操作不当导致假阳性[9]。双能骨密度仪测取的骨密度方法具有准确度高、测量时间短的优点[10],是检测为骨质疏松症的“金标准”。王德志等[11]在動物实验研究中观察到,骨密度的降低程度在骨质疏松症的发生、发展过程中不能完全反映骨组织微结构的退变程度,认为评价骨质疏松症严重程度及骨组织力学的改变时,不能单纯凭测量骨密度来决定,在实验研究和临床工作中应该结合其他检测方法来共同评估骨质疏松症。股骨HE染色看到的骨小梁形态变化和骨髓腔加大现象是骨生成的体现,伴随有初级骨髓腔的形成,显示骨发生现象。去卵巢后大鼠骨量的丢失主要发生在以骨小梁为主的松质骨[12-13],由于松质骨在大鼠骨中占大部分,因此,骨小梁的减少会导致骨密度的下降。骨组织HE染色对于股骨端和胫骨端的皮质骨的研究没有松质骨充分,作为去势指标的判定具有一定的局限性。BMMSCs是一种具有多种分化能力的细胞,既能成骨分化,又能成脂分化。去除卵巢后的大鼠BMMSCs功能受到抑制,其原代培养具有一定的时间周期,培养条件相对繁琐。
在大鼠去势造模判定方法中,有一系列评价的客观指标,主要有骨密度测定、骨组织形态计量学和阴道脱落细胞涂片检测等,其中最主要的是骨密度与骨组织病理学变化这两项指标[14],本论文主要采用观察阴道脱落细胞涂片、股骨骨密度的测定、骨组织病理学变化和BMMSCs生长周期变化4种方法证明去势是否成功。结果发现相较于假手术组,模型组雌性大鼠阴道脱落细胞动情周期紊乱;股骨密度显著降低,骨组织HE染色骨小梁间距增宽,骨小梁稀少且窄;模型组BMMSCs生长速率变缓,呈现衰老趋势。相较而言,股骨密度测定和阴道脱落细胞涂片是较为省时、省力且结果较为准确的量化标准。目前,任何骨检测方法均有其各自的局限性和适用情况,本研究力图从手术去势造模角度出发,对大鼠骨质疏松症模型建立进行“宏观到微观、二维到三维、定性到定量”分析,为单一项目实验方案动物去势判定提供了较为全面的依据。
参考文献
[1] 中华人民共和国国家统计局.中国统计年鉴-2015(总第34期)[M].北京:中国统计出版社,2015.
[2] SI L, WINZENBERG T M, JIANG Q, et al. Projection of osteoporosis-related fractures and costs in China: 2010-2050[J]. Osteoporosis International, 2015, 26(7): 1929-1937.
[3] 张春丽,李忠海,周 颖,等.构建骨质疏松动物模型建模方法的改进及评价[J].中国组织工程研究,2016,20(5):754-759.
[4] 张 悦,李运峰.骨质疏松症动物模型研究进展[J].中国骨质疏松杂志,2020,26(1):152-156.
[5] 张雅蓉,唐 舸,刘 杉,等.5种常用大鼠骨质疏松动物模型的特点[J].国际口腔医学杂志,2013,40(5):629-633.
[6] 李延红,党晓谦,龚福太,等.骨质疏松动物模型的研究进展及文献回顾[J].中国组织工程研究,2018,22(12):1956-1961.
[7] 蹇秀林.壮骨止痛胶囊对成骨细胞NF-κB信号通路中NF-κB p65和IκBα蛋白的影响[D].长沙:湖南中医药大学,2019.
[8] 黄姗姗.补肾活血方对免疫性卵巢早衰小鼠PI3K、AKT1及MTOR蛋白表达的影响[D].长沙:湖南中医药大学,2019.
[9] SELL S L, DILLON A M, CUNNINGHAM K A, et al. Estrous cycle influence on individual differences in the response to novelty and cocaine in female rats[J]. Behavioural Brain Research, 2005, 161(1):69-74.
[10] 盛玲玲,李先娜,霍金海,等.骨质疏松症动物模型及评价方法研究进展[J].黑龙江中医药,2018,47(6):111-113.
[11] 王德志,陈世昌,梁正洋,等.Micro CT定量研究去卵巢山羊胫骨平台松质骨微结构特点[J].中国组织工程研究,2014,18(24):3773-3778.
[12] 祁珊珊,杨祎琦,庞田田,等.去卵巢法建立SD大鼠绝经后骨质疏松模型手术探讨[J].中国兽医杂志,2014,50(2):27-29.
[13] 张丽君,张 艳,徐 谦,等.尼尔雌醇对去卵巢大鼠子宫内膜的影响[J].中国比较医学杂志,2006(6):325-326,316.
[14] 祁珊珊,王永吉,庞田田,等.去卵巢大鼠骨、生殖系統组织病理学与形态计量学观察[J].中国骨质疏松杂志,2015,21(7):774-779.
