初发急性胰腺炎后新发糖尿病的危险因素评估
2020-12-21李贤秋唐世孝
刘 慧, 李贤秋, 罗 刚, 唐世孝
西南医科大学附属医院 消化内科, 四川 泸州 646000
急性胰腺炎(acute pancreatitis,AP)是由多种病因引起的胰酶激活、胰腺组织自身消化,以胰腺局部炎症反应为特征的伴或不伴有其他器官功能改变的疾病,是多数国家胃肠道疾病入院的主要原因[1-3]。其常见病因包括胆道疾病、高脂血症、酒精、药物等。近年来,继发于急性胰腺炎(AP)的胰腺内分泌功能不全或糖尿病被陆续报道[4-5],即由于胰腺外分泌实质的丧失或破坏而引起的糖尿病[6-8],世界卫生组织将其定义为AP后糖尿病(post-acute pancreatitis diabetes mellitus,PPDM-A)[6]。目前PPDM-A诊断尚未达成共识,常被误诊为2型糖尿病[9]。相关研究[4,7-10]报道西方人群PPDM-A患者占糖尿病患者的5%~10%。国内对于PPDM-A发病率缺乏大样本流行病学研究。本研究旨在探究PPDM-A的相关危险因素,帮助临床医师识别有PPDM-A高危风险的AP患者,为制订预防或延缓PPDM-A的发生发展的临床策略提供参考。
1 资料与方法
1.1 研究对象 回顾性收集西南医科大学附属医院2013年6月-2020年1月收治的首发AP患者的病例资料。纳入标准:(1)符合AP诊断标准[1];(2)符合糖尿病诊断标准[11];(3)首发AP后新诊断为糖尿病患者间隔>3个月。排除标准:(1)既往有糖尿病病史;(2)既往有胰腺炎病史;(3)年龄<18岁;(4)有慢性胰腺炎或肿瘤,慢性疾病,免疫缺陷疾病等;(5)首诊胰腺炎后3个月内出现的应激性血糖升高;(6)随访资料或临床资料不全。最终纳入PPDM-A患者共95例,采用Rand函数以2∶1比例随机抽取同一时间段的首发AP后非PPDM-A患者190例作为对照组。所有入组患者的随访时间以首次发生AP后3个月为最短间隔,随访时间至2020年6月截止,通过门诊复诊、电话随访的方式,根据患者是否出现糖尿病临床症状,空腹血糖、糖化血红蛋白或口服葡萄糖耐量试验(OGTT)结果来诊断PPDM-A。
1.2 相关定义 AP:具有以下3项中的2项可诊断为AP,①腹痛;②血清淀粉酶和/或脂肪酶大于正常值上限的3倍;③腹部影像的特征性表现。根据疾病严重程度分为轻症急性胰腺炎(mild acute pancreatitis,MAP)、中度重症急性胰腺炎(moderate severe acute pancreatitis,MSAP)、重症急性胰腺炎(severe acute pancreatitis,SAP)。主要病因为:(1)胆源性;(2)高脂血症;(3)酒精性;(4)其他。
PPDM-A:既往无糖尿病基础,在首发AP至少3个月后诊断为糖尿病,即符合以下4项中的1项:(1)典型糖尿病症状并随机血糖≥11.1 mmol/L;(2)空腹血糖≥7.0 mmol/L;(3)OGTT后2 h PG>11.1mmol/L;(4)糖化血红蛋白≥6.5%。
CTSI评分:参照文献所述评分标准[12],根据CT影像,由胰腺形态(0~4分)、胰腺坏死面积(0~4分)及胰腺外并发症(0~2分)三部分组成,分别计算各部分分数,CTSI评分由三者相加所得。
1.3 观察指标 患者基线资料包括:年龄、性别、吸烟史、饮酒史、糖尿病家族史、高血压、脂肪肝、高尿酸血症、BMI;临床资料包括:病因学、血常规、生化;并发症:全身性炎症反应综合征(systemic inflammatory response syndrome,SIRS)、急性胰周液体聚集(acute peripancreatic fluid accumulation,APFC)、急性胰周坏死物聚集(acute necrotic collection,ANC)。
1.4 伦理学审查 本研究方案经西南医科大学附属医院伦理委员审批,批号:KY2020127。
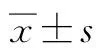
2 结果
2.1 两组基线资料的比较 两组患者BMI、体质量、饮酒史、高尿酸血症、脂肪肝比例差异均有统计学意义(P值均<0.05);两组间年龄和男性、吸烟史、糖尿病家族史、高血压的比例差异均无统计学意义(P值均>0.05)(表1)。
2.2 两组临床资料的比较 两组不同病因(胆源性、高脂血症性、酒精性AP)比较差异有统计学意义(P<0.05)。PPDM-A组TG、血糖(Glu)、WBC、CRP水平和入院Glu>11.1 mmol/L比例均高于非PPDM-A组患者(P值均<0.05);两组间Ca+、血淀粉酶、血脂肪酶水平均无明显差异(P值均>0.05)。PPDM-A组患者ANC、APFC发生率、AP多次发生比例、CTSI评分>4比例均高于非PPDM-A组(P值均<0.05),两组间发生SIRS的比例和疾病严重程度差异均无统计学意义(P值均>0.05)(表2)。
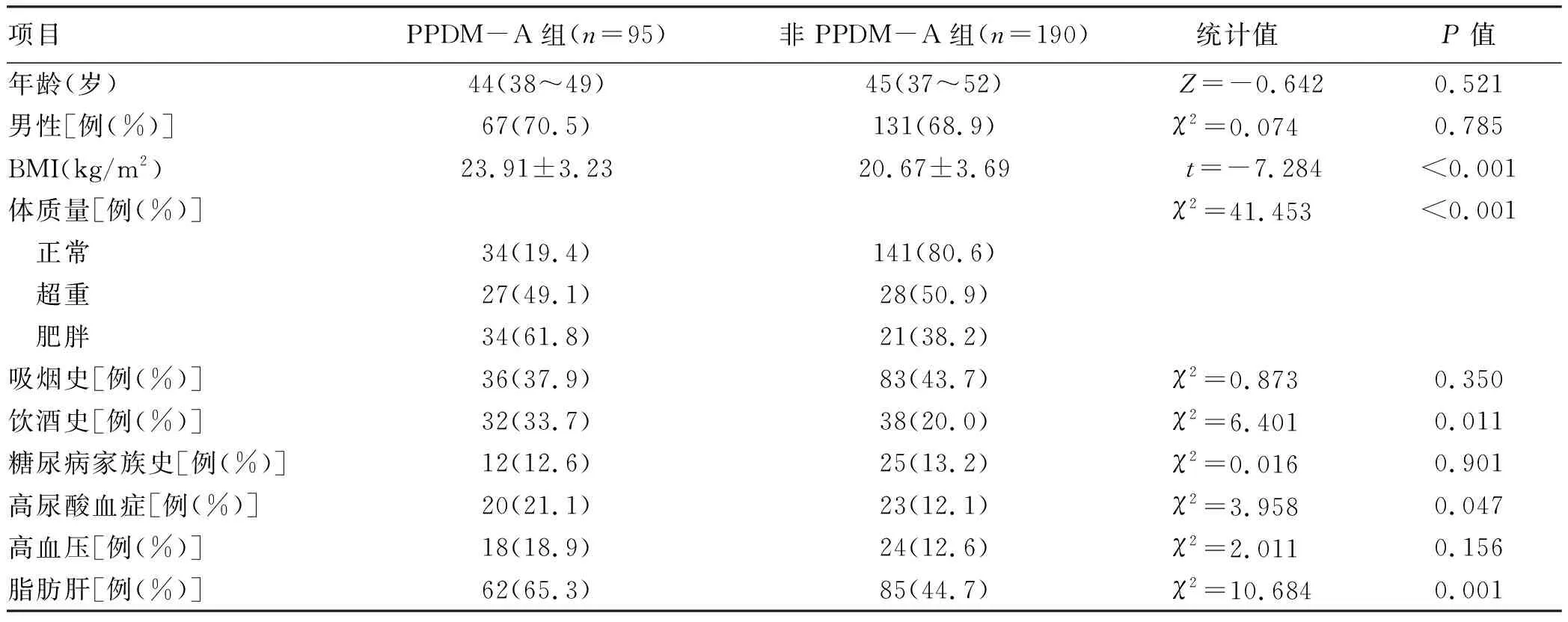
表1 两组患者基线资料比较

表2 两组患者临床资料比较
2.3 PPDM-A相关危险的多因素分析 将基线资料和临床资料比较中有意义的指标纳入多因素分析,相关变量的赋值见(表3)。与胆源性AP患者相比,酒精性AP发生PPDM-A的结局是其5.868倍(95%CI: 1.607~21.418,P=0.007),高脂血症性AP发生PPDM-A的结局是其3.312倍(95%CI: 1.593~6.887,P=0.001);超重及肥胖患者发生PPDM-A的结局分别是正常体质量患者的3.694倍(95%CI: 1.575~8.667,P=0.003)、5.964倍(95%CI:2.516~14.139,P<0.001)。AP多次发生、入院Glu>11.1 mmol/L、CTSI评分>4、WBC是导致患者出现PPDM-A的独立危险因素(表4)。对PPDM-A相关危险因素进行森林图绘制见图1。
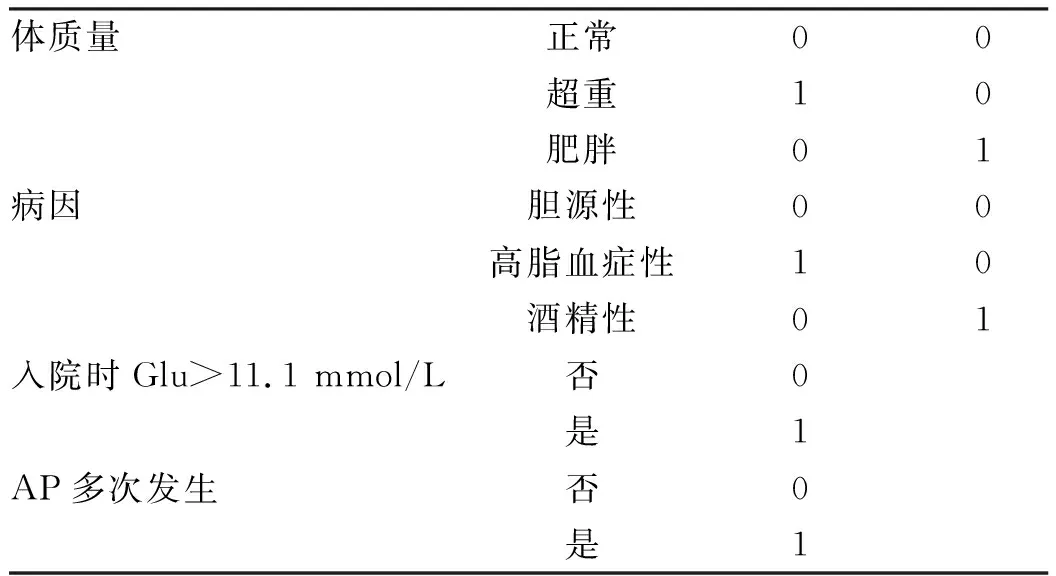
表3 相关变量赋值表
3 讨论
国际最新数据[13]表明,全世界患糖尿病的人数已达4.51亿人,是导致人类死亡的第四大原因,其发病隐匿,并发症多,死亡率和致残率高,是个人与社会的巨大负担。胰源性糖尿病(3c型糖尿病)与胰腺外分泌部的良性和恶性疾病有关,包括急慢性胰腺炎、胰腺肿瘤、胰腺创伤或手术胰腺发育不全等[14],是继发性糖尿病的一种形式[15]。AP是世界范围内最常见的外分泌胰腺疾病,我国尚无全国性AP总体发病率报道,而在美国等地区发病率高达58.20/10万人年[16]。PPDM-A是外分泌胰腺糖尿病的最大贡献者[17]。
近期的相关研究[18-19]表明,近40%的正常患者在首次AP发作后出现糖尿病前期或糖尿病,PPDM-A的患病率高于成人发病的T1DM,且较T2DM更容易出现血糖控制不良[20]。 AP后新诊断糖尿病的发生风险比一般人群高2倍以上[21]。最近一项回顾性研究[22]发现在初发AP后高达23%的患者新发糖尿病,甚至发病超过5年的108例PPDM-A患者中仍有27例需要持续使用胰岛素治疗。多项研究[19-20,23-24]指出,酒精性AP、AP多次发生、男性和年龄≥65岁均与AP后糖尿病有关,而AP严重程度、Charlson共病指数和PPDM-A无关。非坏死性胰腺炎患者或MAP患者也有发生PPDM-A的高风险[19]。此外,有研究[25]提出戒烟和减少腹部脂肪可降低PPDM-A的发生风险。在本研究中同样发现,与对照组相比,AP多次发生、酒精性AP、高脂血症性AP、入院Glu>11.1 mmol/L、BMI达到超重或肥胖均是发生PPDM-A的独立危险因素。这些简捷的参考指标将有助于识别可能发生PPDM-A的患者,从一开始就采取相应的措施,如减重,戒酒,使用降脂降糖药物等,可以降低AP患者发生PPDM-A的风险。
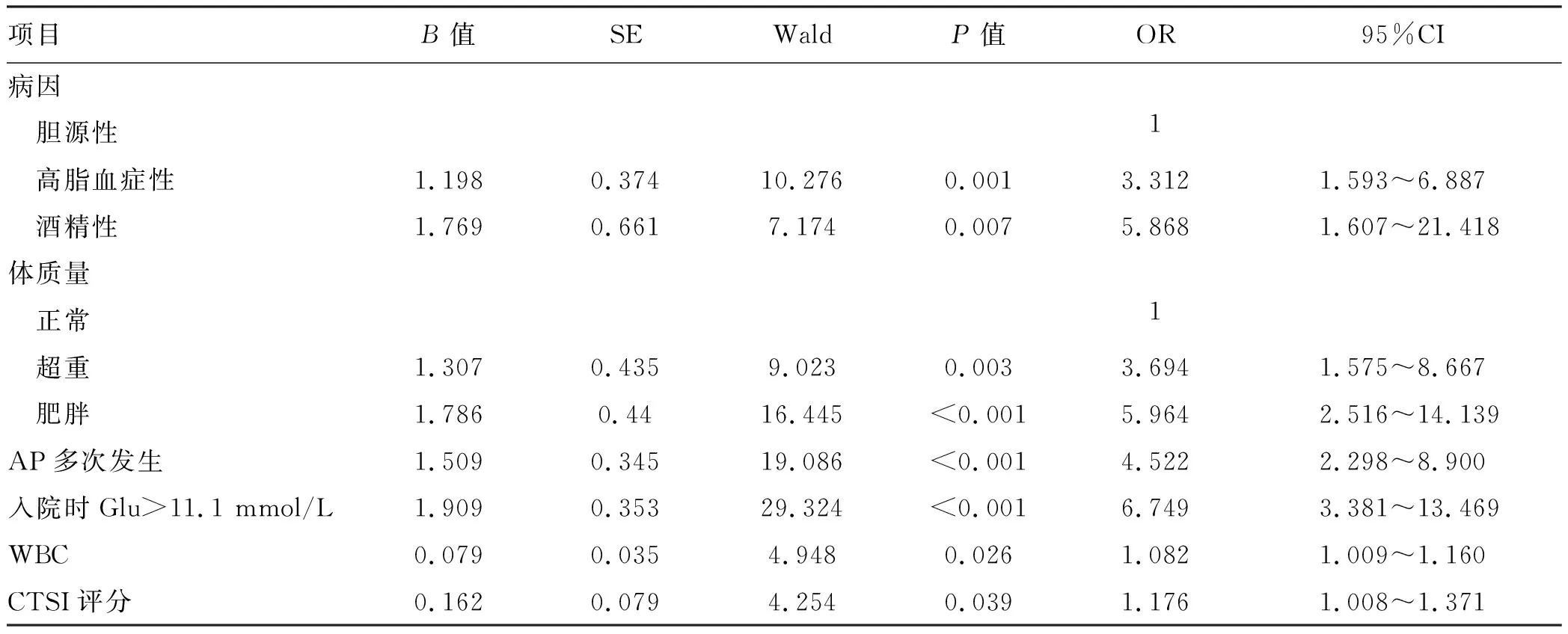
表4 PPDM-A多因素回归分析
在外分泌胰腺糖尿病中,由于胰腺炎症后的B淋巴细胞数量减少或功能障碍导致胰岛素产生减少[26-27];同时胰腺多肽可上调肝脏中胰岛素受体的表达,其丢失可导致肝脏胰岛素抵抗[28]。目前PPDM-A的发病机制尚不明确,全身或胰腺局部持续的低度炎症[29-31],胰腺-肠-脑轴功能障碍[32-34],脂肪组织脂解[35-37]和胰岛素抵抗都与之相关[38-39]。总之,代谢异常是胰腺炎的最重要和常见后遗症,胰腺炎对代谢紊乱发展的影响越来越多,包括应激性血糖升高、持续的糖耐量受损、外分泌胰腺功能不全和骨代谢改变等[40-42]。而在胰腺疾病后发展的糖尿病(3c型糖尿病)与血糖控制不良在临床中往往被忽视,以及很少被正确认识为PPDM-A。
综上所述,建议对无论严重程度如何的AP患者进行长期随访,对已知的AP高风险群体进行更密切的监测和选择性筛查,从而通过减轻相关危险因素达到预防或延缓糖尿病发病的策略。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:罗刚负责课题设计,拟定写作思路;刘慧、李贤秋参与收集数据,资料分析,撰写论文;唐世孝负责指导撰写文章并最终定稿。
