人工智能在多种肝脏和胰腺疾病诊断中的作用
2020-12-21刘先丽
龚 航, 黄 忠, 刘先丽
1 自贡市第一人民医院 消化内科, 四川 自贡 643000; 2 自贡市中医医院 超声科, 四川 自贡 643000
自2010年以来,人工智能(artificial intelligence, AI)已经在医学领域取得了实质性的进展。AI也越来越多的应用于肝、胰疾病和食管静脉曲张的诊断研究。相较于影像学及临床医生,影像组学、临床血液检验借助计算机的帮助,可以挖掘出大量人眼所难以识别的特征,以提高疾病诊断准确率。本文就AI在肝、胰疾病及食管静脉曲张的血液学数据及影像组学诊断中的研究进展作一综述。
1 AI概念
AI通常是指模仿人类认知功能(如学习和解决问题)的计算机程序。AI的概念范畴包括机器学习(machine learning, ML)和深度学习(deep learning, DL)[1]。ML涉及计算机科学和统计学领域,主要指电脑机器执行模型的重复迭代,以逐步提高完成特定任务的效率。ML方法大致分为有监督学习和无监督学习。当机器对组的数量及其重要性没有先验知识时,就会出现根据共性来识别组中数据的无监督学习,而事先给定包含成对输入-输出的训练数据时,就会产生对未知数据有分类能力的监督学习[1]。DL是ML中的一个新领域,通过建立以及模拟人脑分析学习的神经网络,从而模仿人脑的机制来解释数据(如图象、声音、文本)。DL是一类模式分析方法的统称,主要包括卷积神经网络(convolutional neural network, CNN)、深度置信网络、循环神经网络等在内的多种深度神经网络,部分网络已经应用到肝、胰疾病及食管静脉曲张的多模态影像智能诊断领域中,并取得了突破性进展[2]。
2 AI与胰腺疾病
临床上,考虑肿瘤改变的胰腺局灶性病变患者中近四分之一需要行超声内镜(EUS)检查,但胰腺肿瘤和炎症通常有相似的EUS图像,即使是有经验的内窥镜医师也会出现误诊或漏诊[3]。EUS引导下细针穿刺吸取活检术(endoscopic ultrasonography-guided fine needle aspiration, EUS-FNA)的检测和诊断主要基于EUS图像的感兴趣区域,从而导致其穿刺病理结果有非常高的假阴性率。EUS是由像素组成的二维数字图像,而像素是数字图像的基本有限元元素,像素的排列反映了EUS图像的组织结构。众所周知,病理状态(如炎症和肿瘤)常改变病灶组织结构,而数字图像分析作为计算机辅助诊断技术的一种,可根据EUS图像中像素的排列情况计算相关的数学和统计参数,达到有效鉴别胰腺炎症和肿瘤的作用[4]。
Das等[5]根据不同胰腺病理类型将EUS图像分为正常胰腺组、慢性胰腺炎组、胰腺癌组,利用数字图像分析建立人工神经网络(artificial neural network, ANN)模型,其识别胰腺癌的灵敏度/特异度/受试者工作特征曲线下面积(AUC)分别达到93.0%/92.0%/0.93,同时该模型对正常胰腺和慢性胰腺炎的辨识度也极高(灵敏度、特异度及准确度均高达100%)。Zhu等[6]分别对262例胰腺癌和126例慢性胰腺炎患者的EUS图像进行分析,从105个候选特征中选出16个,利用支持向量机(support vector machine, SVM)模型发现其识别胰腺癌的敏感度/特异度/准确度分别达到91.6%/95.0%/94.2%,结果表明SVM模型在胰腺癌诊断中表现出较高的效能。Ozkan等[7]应用基于年龄分类的多层感知器(multilayered perceptron, MLP)模型,对332张EUS图像(202例胰腺癌患者、130例非胰腺癌患者)进行分析,该模型诊断胰腺癌的灵敏度/特异度/准确度分别达到83.3%/93.3%/87.5%,结果表明基于年龄分类的MLP模型对胰腺癌的诊断价值优于无年龄分类。Sǎftoiu等[8]利用MLP模型将实时EUS弹性成像中色调直方图数据计算为弹性成像帧数,以达到区分良恶性的效果,其将慢性胰腺炎和胰腺癌患者区分的灵敏度/特异度/准确度分别达到87.6%/82.9%/84.3%,提示MLP模型基于EUS或实时EUS弹性成像均在胰腺癌的诊断中有一定效能。另有学者[9]对167例经病理诊断为慢性胰腺炎或胰腺癌的患者展开研究,发现在谐波造影增强EUS基础上建立的ANN模型鉴别胰腺癌的灵敏度/特异度/准确度高达94.64%/94.44%/94.6%,分别比单一谐波造影增强EUS的灵敏度、特异度提高了7.14%、1.72%。另有研究[10]基于血清肿瘤标志物(CA19-9、CA125、CEA)建立ANN模型,其诊断胰腺癌的AUC高达0.91,提示ANN模型结合血清肿瘤标志物在预测胰腺癌方面有较好的临床价值。
此外,也有基于CT、MRI方面的AI研究。Liu等[11]探讨了基于CNN深度学习的增强CT图像模型对胰腺癌鉴别诊断的价值,AI模型自动处理一张CT图像仅需0.2 s,鉴别胰腺癌AUC高达0.96,提示基于CNN的AI模型是一种有效、客观、高精度的胰腺癌诊断方法。Li等[12]建立的基于PET/CT图像的胰腺癌计算机辅助诊断技术,SVM-随机森林(random forest, RF)联合传统模型双阈值-主成分分析(dual threshold principal component analysis, DT-PCA)鉴别胰腺癌的灵敏度/特异度/准确度高达95.2%/97.5%/96.5%,结果提示SVM-RF模型成功地融合了SVM和RF的优势,并能联合DT-PCA、Relief、Lasso等传统模型达到不俗的预测效果,其中SVM-RF联合DT-PCA模型在各项评估中表现最佳。Gao等[13]基于T1加权对比增强MRI结合CNN深度学习模型预测外部验证组中胰腺癌的AUC达0.90,表明基于CNN深度学习的MRI增强图像对胰腺癌的预测价值有一定的应用前景(表1)。
3 AI与肝脏疾病
3.1 肝纤维化 肝纤维化是许多肝脏疾病尤其是慢性肝病的一个共同病理基础。慢性肝纤维化程度的评估是判断病情、早期干预治疗和随访疗效的关键环节。目前肝活检一直作为肝纤维化诊断的金标准[14]。然而,肝活检本身存在着给患者带来风险伤害、取样误差、医疗资源的浪费以及缺乏动态监测等问题,限制了其在临床上的应用。近年来,肝纤维化的影像学诊断技术(如瞬时弹性成像、磁共振弹性成像)成为研究热点,相较于血清标志物具有准确度高、无创性、无辐射等优点,但仍然不能替代肝活检。随着信息化时代的到来,AI也越来越多的应用于肝纤维化的诊断研究,AI结合影像学和血液学检查有望作为诊断肝纤维化的非侵入性技术。
对于肝纤维化的诊断,其中不乏临床血液学方面的AI研究。Piscaglia等[15]使用ANN模型结合临床血液学数据对肝活检证实的慢性丙型肝炎(CHC)肝移植受者(训练组:414例,验证组:96例)展开研究,其诊断进展期肝纤维化(≥F3)的灵敏度/特异度/AUC分别达到100%/79.5%/0.93,较单一的临床数据logit模型灵敏度、AUC分别提高了13%、0.09(P<0.05)。Hashem等[16]分别运用粒子群分类器(particle swarm optimization, PSO)、交替决策树(alternating decision tree, ADT)、多元线性回归(multi-linear regression, MReg)、遗传分类器(genetic algorithm, GA)结合血液学指标(年龄、AST、Alb及ALT)对39 567例经肝脏病理证实的CHC肝纤维化患者展开研究,结果证实4种AI分类器诊断进展期肝纤维化的灵敏度/特异度/准确度分别达到70.4%/65.6%/66.4%、7.0%/99.0%/84.4%、69.0%/69.1%/69.1%、68.9%/69.7%/69.6%,表明AI分类器可以作为预测HCV进展期肝纤维化的替代方法。Wang等[17]运用ANN模型结合血液标志物对经肝脏病理证实的慢性乙型肝炎(CHB)肝纤维化患者(训练组:226例,测试组:116例)进行分析,模型诊断显著肝纤维化(≥F2)的灵敏度/特异度/AUC分别达到83.3%/85.0%/0.92,使需要肝活检的患者减少47.4%。Wei等[18]运用梯度提升(gradient boosting, GB)模型结合临床数据对CHB肝纤维化患者进行分析,发现GB模型诊断进展期肝纤维化、肝硬化的灵敏度/特异度/AUC分别达到84.0%/85.0%/0.92、78.0%/85.0%/0.87,GB模型对CHB肝纤维化的诊断效能显著优于FIB-4。Raoufy等[19]发现ANN模型结合临床数据诊断CHB肝硬化的灵敏度/特异度/准确度分别达到87.5%/92.0%/91.4%,表明仅基于常规的临床实验室数据,ANN模型诊断CHB肝硬化的效能可能优于GB模型。
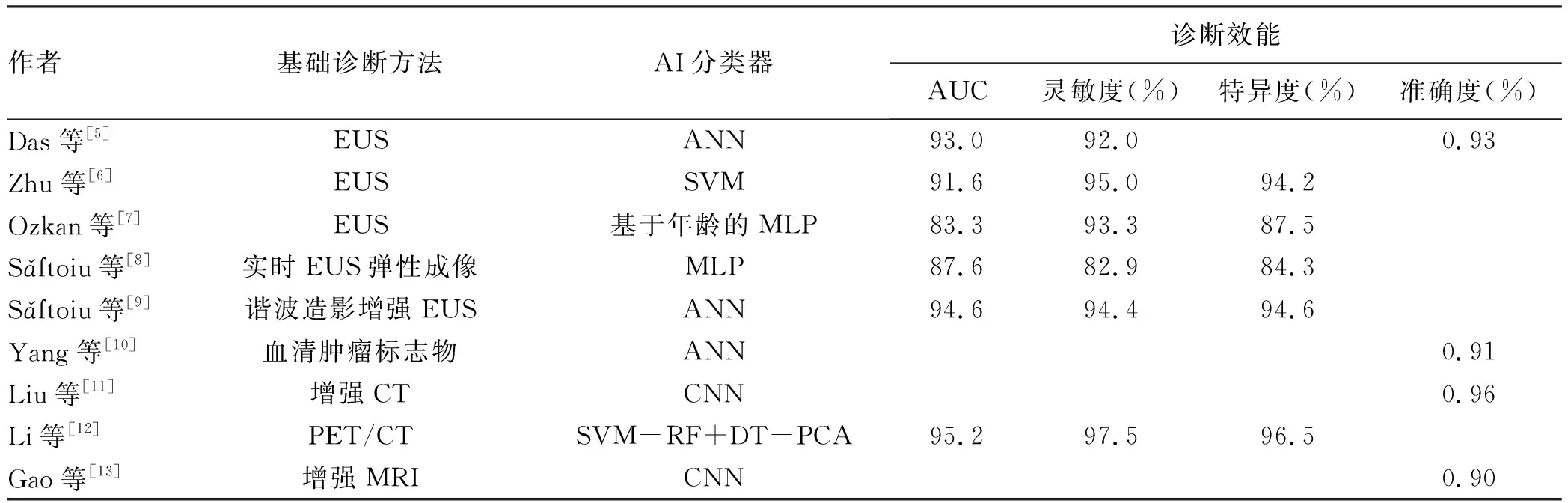
表1 AI在胰腺癌诊断中的应用
此外,也有基于影像组学方面的AI研究。Chen等[20]分别运用SVM、朴素贝叶斯(Naïve Bayes, NB)、RF及k最近邻分类器(k-nearest neighbor, KNN)结合实时组织弹性成像对513例CHB肝纤维化患者(经肝脏病理证实)的研究表明,4种AI分类器诊断轻度肝纤维化(≥F1)的灵敏度/特异度/准确度分别达到93.0%/46.3%/81.5%、79.7%/82.5%/80.4%、89.4%/65.0%/82.9%、89.3%/61.2%/82.1%,结果证实4种AI分类器明显优于传统的肝纤维化指数方法,其中RF分类器诊断准确度最高,提示复杂的AI方法可以成为评估肝纤维化分级的有力工具,并显示出较好的临床应用前景。Wang等[21]在剪切波弹性成像(Shear wave elastography, SWE)的基础上建立CNN模型,采用了新的命名为深度学习的放射组学弹性成像(deep learning radiomics of elastography, DLRE),其诊断CHB显著肝纤维化、进展期肝纤维化、肝硬化的灵敏度/特异度/AUC分别达到69.1%/90.9%/0.85、90.4%/98.3%/0.98、96.9%/88.0%/0.97,DLRE诊断准确性显著优于SWE、APRI及FIB-4。Yasaka等[22]采用钆塞酸二钠增强MRI检查结合CNN深度学习模型对肝纤维化患者开展研究,其预测显著肝纤维化、进展期肝纤维化、肝硬化的灵敏度/特异度/AUC分别达到84.0%/65.0%/0.85、78.0%/74.0%/0.84、76.0%/76.0%/0.84,提示CNN模型在肝纤维化分期中表现出较高的诊断效能。Yasaka等[23]也探讨了基于CNN深度学习的增强CT图像模型评估肝纤维化分期的价值,其预测显著肝纤维化、进展期肝纤维化、肝硬化的灵敏度/特异度/AUC分别达到76.0%/68.0%/0.73、75.0%/65.0%/0.76、75.0%/57.0%/0.74,表明基于CT图像的CNN深度学习模型对肝纤维化分期的价值尚不能令人满意。同样,基于FibroScan和TNFα的基础上建立决策树(decision trees, DT)模型对酒精性肝病(alcoholic liver disease, ALD)肝硬化也有一定的诊断效能[24]。
非酒精性脂肪性肝病(NAFLD)现已取代慢性乙型肝炎,成为我国第一大慢性肝病。日前,国际专家组已在顶级期刊Gastroenterology和JournalofHepatology发表声明,提出以“代谢相关脂肪性肝病(metabolic associated fatty liver disease, MAFLD)”取代现有命名(NAFLD)[25-26]。大量证据显示,MAFLD的诊断应该基于代谢功能障碍的存在,而不是以“排除性”的方式,并且MAFLD可以与其他肝病共存(如病毒性肝炎、酒精性肝病等)。其次,关于酒精摄入量的安全阈值仍然存在争议,原命名中“非酒精性”混淆术语应该被替换。另外,代谢相关脂肪性肝病应被认为与其他慢性肝病相似,而不应简单分为NASH和非NASH两类,纤维化才是不良结局的主要决定因素。基于这些原因,更新疾病命名有助于进一步描述和细化疾病分型,从而优化临床实践,提高临床诊治效率[27]。研究表明,将AI技术应用于MAFLD的研究将有助于疾病的精确分类和预后判断,为临床决策提供参考。Sowa等[28]运用RF、KNN模型结合临床血液学参数诊断NAFLD显著肝纤维化的灵敏度/特异度/准确度分别达到60.0%/77.0%/79.0%、30.8%/91.3%/79.0%,但SVM、DT模型在血液学参数的基础上无法准确预测MAFLD肝纤维化(表2)。此外,AI还可应用于MAFLD和ALD之间、MAFLD和健康对照组之间、MAFLD和MASH之间的鉴别诊断[28-30]。
3.2 食管静脉曲张(esophageal varices, EV) EV是肝硬化的一种潜在致死性临床表现。肝硬化患者发生EV的终生患病率为60%~80%,而急性EV出血导致的病死率为15%~55%[31]。目前所有肝硬化患者均推荐胃镜筛查,然而接受筛查的患者中代偿性肝硬化(无EV或轻度EV)占较大比例,这类患者无需静脉曲张治疗,却有暴露于镇静药物、操作相关并发症的风险(药物清除率下降、凝血障碍等原因)。近年来血小板计数与脾脏直径比值、Baveno VI标准(涉及肝脏瞬时弹性成像)对EV的预测有一定的临床价值,由于部分医疗机构影像报告中不包含脾脏直径,以及肝脏瞬时弹性成像尚未广泛普及,因此限制了在临床上的应用。
目前AI在预测EV方面具有重要价值,Hong等[32]运用MLP模型结合临床数据(PLT、脾脏宽度和门静脉直径)对197例CHB肝硬化展开研究,其预测EV的灵敏度/特异度/准确度分别达到93.8%/71.7%/87.8%,表明MLP模型可用于预测CHB肝硬化患者EV的发生。Dong等[33]运用RF模型对238例接受胃镜筛查的肝硬化患者,通过分析与EV相关的临床数据,并采用了新的命名为EVendo的评分法,其识别EV、需治疗的静脉曲张(varices needing treatment, VNT)的灵敏度/特异度/AUC分别达到92.3%/65.9%/0.82、100.0%/49.3%/0.75,可使30.5%的患者免于胃镜检查(仅2.8%的VNT患者有错误分类风险),因此根据该新评分系统可以帮助低风险的VNT患者避免不必要的胃镜检查。目前关于人工智能在食管静脉曲张诊断的研究较少,未来还需要进一步深入研究。
4 结语
综上所述,在肝脏疾病方面,AI可以预测患者肝纤维化风险,使部分低风险患者避免肝活检;可以帮助低风险的VNT患者避免不必要的胃镜检查。在胰腺疾病方面,AI相较于传统的EUS、EUS-FNA可提高对胰腺癌的诊断准确性。此外,AI对于疾病严重程度的回归分析及患者预后情况评估的生存分析等方面均有涉及。但AI技术仍有需要改进的地方,目前缺乏用于医学影像数据分析的ML高质量数据集,大多数用于开发ML算法的依据来源于临床前研究,尚未广泛用于临床实践,并且各研究所采用的算法层出不穷,尚无研究证明何种算法最适合于此类研究。尽管AI技术可以做出准确预测,但AI不可能完全取代医务工作者,医务工作者最终将结合AI和患者主观意愿、实际情况、伦理等做出合适决策。
作者贡献声明:龚航负责课题设计,资料分析,撰写论文;黄忠参与临床资料收集,修改论文;刘先丽负责拟定写作思路,指导撰写文章并最后定稿。
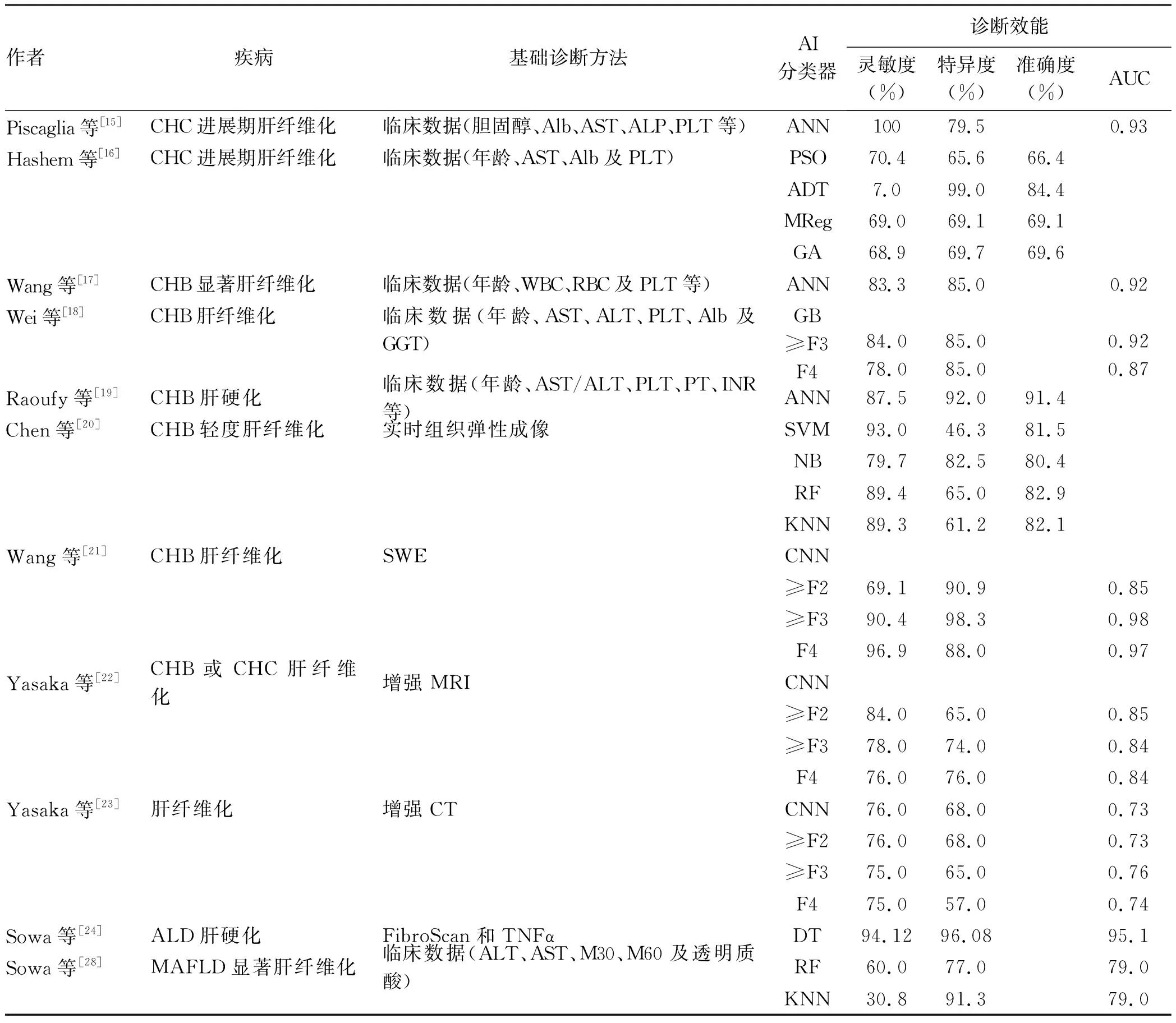
表2 AI在肝纤维化诊断中的应用
