血清α-1抗胰蛋白酶测定的临床意义
2020-12-19陈少莲马晓桂
陈少莲,张 涛,马晓桂,何 强
(广东药科大学附属第一医院,广东 广州 510000)
α1-抗胰蛋白酶(AAT)是血液循环系统中最丰富的丝氨酸蛋白酶抑制剂,是非特异性急性时相蛋白的一种。AAT的主要作用是维持肺或肝脏组织中蛋白酶/抗蛋白酶的平衡,但它也具有重要的抗炎和免疫调节功能。本文将重点关注AAT血清浓度检测作为肝脏疾病生物标志物的用途。
1 AAT基本概念与应用
α1-抗胰蛋白酶(A1AT、A1A或AAT)是属于血清蛋白serpin(丝氨酸蛋白酶抑制剂)超家族中的一种蛋白质,它是由SERPINA1基因编码的。作为一种蛋白酶抑制剂,它也被称为α1-蛋白酶抑制剂(A1PI)或α1-抗蛋白酶(A1AP),因为它可抑制各种蛋白酶(不只是胰蛋白酶)[1]。在早期的生物医学文献中,有的称之为血清胰蛋白酶抑制剂(Serum Trypsin Inhibitor,STI,过时的术语),因其作为胰蛋白酶抑制剂是早期研究的一个显著特点。
AAT主要在肝脏中由肝细胞合成和分泌,但巨噬细胞、单核细胞、嗜中性粒细胞以及肠和支气管上皮细胞也可合成和分泌[2]。
AAT在内质网(ER)中通过糖基化进行翻译后修饰。在内质网(ER)中,多肽链上70、107和271处的三个天冬酰胺残基处添加N-糖苷键连接的寡糖[3],寡糖前体在ER和高尔基体中被修饰。研究表明,不同疾病情况下,AAT的糖基化会有变化,说明AAT糖基化的变化与各种疾病状态下(如炎症、恶性肿瘤等)AAT功能和浓度的改变相关联。
AAT在医学上被认为是最重要的一种蛋白酶抑制剂(serpins)。大多数serpins通过共价结合使酶失活,需要非常高的水平才能发挥其功能。在急性期反应中,AAT浓度需要进一步升高,即弹性蛋白酶分解结缔组织纤维弹性蛋白造成的损伤。作为一种肝脏酶抑制剂,AAT可起到保护组织免中性粒细胞弹性蛋白酶等炎性细胞酶的侵害作用。AAT在血清中的正常参考范围为0.9~2.3 g/L(在美国,参考范围单位通常采用mg/dl或微摩尔),但在急性炎性反应时,AAT浓度会升高很多倍[4]。
AAT的主要功能是作为抗蛋白酶,在蛋白酶与抗蛋白酶平衡中起重要作用,保护肺中的结缔组织免于包括嗜中性粒细胞弹性蛋白酶在内的丝氨酸蛋白酶的降解[5]。AAT的这种作用在AAT缺乏症(AATD)的遗传病中最为明显,患者在年轻时患肺气肿性肺病的风险很高[6]。当血液中AAT含量不足或AAT功能缺陷(如α-1抗胰蛋白酶缺乏症,AATD)时,中性粒细胞弹性蛋白酶会过度自由分解弹性蛋白,降低肺组织弹性,导致呼吸系统并发症,如成人慢性阻塞性肺病。人体正常情况下,AAT自肝脏产生后,会被分泌入血液循环系统;而有缺陷的AAT无法进入血液循环,在肝脏中积聚,从而导致成人或儿童肝硬化。和所有丝氨酸蛋白酶抑制剂相同,AAT具有β-片、α螺旋的特征性二级结构。这些区域的突变可导致非功能性蛋白质聚合(合)并在肝脏中积聚(婴儿肝硬化)。
AAT有多种遗传异构体,其电泳特性和血浆中的浓度因此有所差异。其中一些与循环中AAT明显缺乏有关,最重要的是Z基因突变[7]。人类中最常见的AAT形式是M表型,具有正常水平的血浆蛋白浓度,无罹患肺病或肝病增加的风险。已知存在多种AAT同种型,这些同种型因聚糖基团的不同而异[8]。这在等电聚焦电泳图谱上很容易看到。见图1。它用于疑似先天性α1-抗胰蛋白酶缺乏症(AATD)患者表型的鉴定[9]。已知有9种M型AAT,M0-M8型,它们因聚糖组的不同而异。与肺和肝疾病相关的最常见的AAT突变体是Z(Glu342Lys)和S(Glu264Val)等位基因突变。Z等位基因突变会引起最严重的血浆AAT缺乏, Z突变体(Z-AAT)发生在> 95%的AAT缺乏的个体中。 AATD是慢性阻塞性肺病发展中唯一经证实的遗传风险因素,AATD同时又吸烟的个体患肺病的风险增加[10]。

图1 α-1抗胰蛋白酶不同表型等电聚焦电泳图谱
α-1-抗胰蛋白酶作为蛋白酶抑制剂,既是内源性又是外源性。用于临床治疗药物的α1-抗胰蛋白酶作为外源性蛋白酶抑制剂,是从人类血液中提纯出来的,以非专利名称Alpha1-蛋白酶抑制剂(人类)和各种商品名(包括Aralast NP、Glassia、Prolastin、Prolastin-C和Zemaira)出售。基因重组AAT也可用于某些疾病的临床治疗。
2 血清中α1-抗胰蛋白酶浓度测定的临床应用
目前,α1-抗胰蛋白酶(AAT)血清浓度测定主要采用免疫比浊等化学技术检测。过去,主要采用电子免疫扩散和放射免疫扩散技术。全自动设备配套免疫比浊法或免疫散射比浊法因其自动化程度高,普及范围广,质量控制统一,而广泛应用于广大实验室。此方法原理如下:人血清、血浆中的待测物会与特异性抗体结合,体形成不溶的免疫复合物,这些复合物在一定波长处有最大的吸光度峰值,吸光度强度与样本中待测物浓度成正比,与已知的标准浓度光强度对比就可得出样本浓度,此方法即为免疫比浊法,是生化试剂常见的特定蛋白类检测法。
AAT作为抗蛋白酶的作用及其在肺和肝脏疾病中的作用已得到广泛研究,该领域有大量文献发表。最近几年的研究都集中在AAT的抗炎和免疫调节特性及其可能的新治疗价值上。
3 α1-抗胰蛋白酶与炎性反应
AAT水平通常在心肌梗死、手术、细菌感染、病毒感染和胰腺炎,以及许多其他病症中反应性升高[11]。在炎性反应发作期间,AAT不但会因细胞因子的调节而产生增加,而且其支链聚糖的百分比也有显著变化(糖基化变化)。见图2。
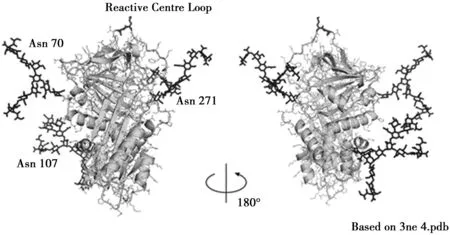
图2 糖基化α-1抗胰蛋白酶的分子模型
炎性反应是对有害刺激复杂的生物反应,例如感染、受损细胞、物理创伤或恶性肿瘤也是属于炎性反应范畴。每个炎性反应过程伴随着炎性反应部位的许多变化和许多全身性生理和生化变化。来自炎性反应部位的大量细胞因子全身移动并刺激肝细胞,触发急性期反应,并改变血液循环中的急性期蛋白质的合成和糖基化。在炎性反应期间,急性期蛋白质的浓度增加(阳性急性期蛋白质)或减少(阴性急性期蛋白质)至少25%[12]。AAT是血浆多种急性时相反应蛋白之一,也显示出独特的抗炎特性。研究表明,血浆AAT水平在感染或炎性反应后数小时内升高,血液循环中增高的AAT来源主要是由肝细胞产生的;但是,其他细胞,如上皮细胞、单核细胞、巨噬细胞和中性粒细胞,肠上皮细胞、人类胰岛的α和δ细胞以及癌细胞被证实也能产生少量的AAT。
尽管AAT的经典功能是作为蛋白酶抑制剂,但现在有大量证据表明,AAT在免疫系统中起主要作用,参与全身炎性反应,具有抗中性粒细胞、巨噬细胞、单核细胞、肥大细胞和淋巴细胞的抗炎活性。AAT在炎性反应中的作用是多方面的,还参与调节了响应IL-8的中性粒细胞趋化性和免疫复合物的信号传导与细胞凋亡,并在其他细胞中具有有效的抗细胞凋亡特性[13]。 AAT通过结合IL-8调节中性粒细胞趋化性,随后通过CXCR1受体途径抑制信号传导。在一些研究中可以看到糖基化在AAT免疫调节作用中的重要性;有研究表明,使用与天然AAT糖基化有差异的雾化转基因AAT对中性粒细胞弹性蛋白酶(NE)活性和炎性反应的作用有限,而两项通过气溶胶递送糖基化天然AAT的研究表明,IL-8和TNF-α水平降低,NE活性降低。然而,通过雾化递送非糖基化的重组AAT的研究表明,这种非糖基化形式的AAT有效抑制了NE[14]。因此,AAT的聚糖似乎对AAT发挥其免疫调节功能比对AAT发挥其抗弹性蛋白酶的功能更重要。
AAT还可以调节细胞因子和趋化因子的活性,但是反过来,AAT本身受炎性细胞因子的调节。以往的研究表明,肝细胞、人支气管上皮细胞、单核细胞和巨噬细胞中AAT的产生可被IL-6、IFN-β2,脂多糖(LPS)、IL-1β、NE和TNF-α上调[15]。不仅AAT的产生增加受这些细胞因子控制,同时它们还控制蛋白质糖基化的程度。单核细胞通过释放IL-1α/β、TNF-α、TGF-β和IL-6改变AAT和抗胰凝乳蛋白酶的糖基化。IL-6在诱导AAT产生中的作用已在多种炎症条件下被证实,并且被证实能显著改变AAT的糖基化。后一点已经在严重烧伤、肝细胞瘤细胞系,和银屑病关节炎等几种其他炎性病症中得到证实。能增加或减少AAT的支链寡糖数量的其他细胞因子包括IFN-γ、IL-1、白血病抑制因子(LIF)、TNF-α和TGF-β。这种现象突出了AAT作为急性期蛋白的重要性,该蛋白不仅在炎性反应期间显著升高,而且在急性炎症期间其糖基化的变化也在AAT的反应中起作用。根据这一理论,一项研究通过对IL-6的类似物制瘤素M的响应,比较了肝癌细胞来源的AAT与来自肺源性上皮细胞的AAT,结果表明两种细胞类型中AAT产生都上调,两者的糖基化模式不同。后一结果可能表明源自不同系统/器官的AAT的功能特性的差异[16]。这对于AAT在炎性病症和恶性疾病中作为有用的生物标志物可能具有的作用尤其重要。特别感兴趣的是AAT核心岩藻糖基化的变化和sLe x表位的增加。
4 α1-抗胰蛋白酶作为恶性肿瘤的生物标志物
研究发现,AAT在多种恶性肿瘤中其结构和功能都被关注,尤其是消化道肿瘤。肝细胞癌是第一个发现与AAT相关的肿瘤,并被认为是一种很有价值的肝癌标记物。因为AAT是由肝细胞合成的,所以最初在肝细胞癌和肝细胞瘤中进行了实验。实验发现肝癌细胞和其他类型腺癌细胞产生的AAT具有更高的分子量,表明AAT具有更多数量的碳水化合物基团。在肝细胞癌中,AAT中sLex表位数量增加,AAT上的核心岩藻糖基化比甲胎蛋白水平更具特异性(甲胎蛋白是肝癌当前标准的生物标志物)[17]。AAT外臂岩藻糖基化的变化似乎也发生在炎性反应中,并可预测肝硬化肝病向肝细胞癌的发展,尤其是感染乙型肝炎病毒的患者[18]。
有学者报道报道肝癌患者血清 AAT显著高于其他肝病患者,文章指出AAT对原发性肝癌诊断的阳性率为 88.9% (30/36),若以高值阳性标准衡量,则阳性率为78.8%(26/33)。国内屠振兴、吴孟超院士等研究报道,AAT辅助诊断原发性肝癌,这其中 AFP低浓度阳性及阴性患者的血清AAT阳性率分别为 72.33%。当 AFP > 400 ng/ml的参考值作为肝癌诊断标准阳性率仅为48.08多(50/104), 而AFP与AAT联合检测互补来诊断早期肝癌,阳性率则提高到80.77%(84/104),因此可见,AAT可作为一种肝癌标记物使用,尤其对AFP低浓度阳性或阴性病例有临床应用价值[19]。
有研究表明,消化系统肿瘤组血清AAT平均含量明显高于对照组。很多消化系统肿瘤患者血清中AAT非特异性增高现象的具体机制尚不明确。ChioLF报道, 消化系统固体癌组织中的溶酶体酶特殊活性比同器官非癌组织高,证明癌的侵袭与溶酶体酶含量有关,溶酶体活性增加可刺激AAT的产生[20]。目前推断,癌变细胞无限复制增殖并引发细胞的炎症,可刺激蛋白酶类释放使酶活性升高,因此导致AAT代偿性增高。另外,化疗治疗过程可使癌细胞和正常细胞都大量破坏,机体急性反应增强,亦可增加AAT含量。
5 AAT在遗传性α1-抗胰蛋白酶缺乏症中的应用
遗传性α1-抗胰蛋白酶缺乏症(AATD)是一种常染色体隐性遗传病,其特征是血清A AT水平下降。AAT缺乏症由A AT基因突变引起,发病欧美国家为主,但国内也发现误诊病例。
AAT缺乏导致AAT血清水平低于11μmol/L公认的保护阈值水平。诊断为AATD的患者的临床表现包括早发性肺气肿、肝脏疾病、脂膜炎和抗中性粒细胞胞浆抗体相关血管炎(如韦格纳肉芽肿症)。因为Z等位基因突变将导致血浆AAT浓度严重降低,发生于95%的AATD患者中,而S等位基因突变导致血浆AAT浓度轻微降低。另一类SERPINA1变异包括罕见的“空(null)”突变,这种突变导致AAT合成完全缺失,虽然与肝病无关,但这种突变确实会导致肺气肿的风险增高与AATD表型相关的一个共同特征是AAT血清水平低于公认的保护阈值水平(11 μmol/L)。
AATD的主要临床症状之一就是肺部疾病。AAT是肺组织中中性粒细胞弹性蛋白酶(NE)的主要抑制物,虽然其他蛋白酶如α2-巨球蛋白及分泌性白蛋白酶等也有抑制作用,但90%以上的抗NE作用是由AAT完成的。正常人下呼吸道中AAT与NE互相拮抗,AAT活性远大于NE活性因此肺组织不会遭到破坏。但是在抗胰蛋白酶缺乏症患者血清中,浓度水平低于11 μmol/L 时,它透过肺泡上皮、血管内皮而出现在肺泡表面的量显著降低,无法对抗NE的破坏从而引起肺气肿等症状。AAT的缺乏引起肺组织弹性蛋白的降解会导致肺弹性降低,这种是慢性、不可抑制的降解,最终产生一系列呼吸系统综合征,例如成人慢性阻塞性肺病(COPD)及典型的肺气肿等临床症状。这类患者肺部疾病发病年龄多为20~40岁的青壮年人群,首发症状通常轻微活动后气促,健身运动受限和气喘;其他症状包括反复的呼吸道感染,疲倦、站立时脉搏加快,视力问题以及体重下降等。严重的AAT缺乏症,会发展为重度肺疾病及肺气肿,以及慢阻肺(COPD),哮喘、慢性支气管炎等其他。如果AAT缺乏症的个体有吸烟习惯,肺气肿更会提前发生 。AAT缺乏症的个体发生肺气肿的严重程度有较大差异,这可能与基因表达的遗传差异性有关[21]。
AATD另一主要临床症状是肝脏方面疾病。AATD患者中,有10%在新生儿期发生肝炎或胆汁淤滞症,并偶而发展至肝硬化。AATD中年患者中,有一部分会发生肝炎和肝硬化(约占15%),而且进一步发展为肝衰竭。正常生理状态下,蛋白酶/抗蛋白酶始终维持平衡状态,AATD水平降低后细胞外基质蛋白与胶原被破坏,肺实质细胞成分损伤,最终在炎性因素诱导下出现肺气肿;健康人拥有单一且正常的AAT蛋白结构,AATD患者患病后基因突变导致AAT蛋白结构错误折叠与和分泌障碍,因此无法进入血液循环,丧失正常生理功能。无功能的AAT间产生聚合反应,并在肝脏内积聚,不能拮抗内源肝细胞的损伤,引发肝纤维化或肝硬化,严重者甚至发展为肝衰竭(15%)。见图3。
AAT水平低下还可能与其他临床疾病相关,如自身免疫性肝炎、继发性膜增生性肾小球肾炎、胆结石、原发性硬化性胆管炎、盆腔器官脱垂、脂膜炎等。该病不仅侵害皮肤,而且深入到内脏(肺、肝、肾、心血管和大肠),导致严重症状,如COPD、气管炎、哮喘、肝硬化、肝癌、肾动脉肌肉纤维发育不良及肾贫血。见图4。
美国胸科学会/欧洲呼吸病学会在《抗胰蛋白酶缺乏症诊断和治疗指南 2003》中建议,有以下临床症状时都应进行AATD的排查诊断:早发性肺气肿(45岁或以下)、无明确原因的肺气肿(无吸烟史、无职业性粉尘接触史)、局限性透明肺、不明原因肝病、坏死性脂膜炎、慢性阻塞性肺炎、家族性肺气肿、支气管炎、肝病或脂膜炎、无明显病原的支气管炎等[22]。
遗传性的α1-抗胰蛋白酶缺乏症,可通过检测血清中AAT的水平高低提供诊断依据。目前临床实验室大多采用全自动免疫比浊法进行AAT血清浓度检测。确认AATD的表型或基因型,表现型可通过血清等电聚焦电泳法,基因型可通过PCR编码外显子的个别片段,再用标志的特异寡核苷酸探针或梯度凝胶分析来评估,也可用等位基因特异放大技术来确定。

图3 健康人与AATD患者AAT蛋白结构差异分析
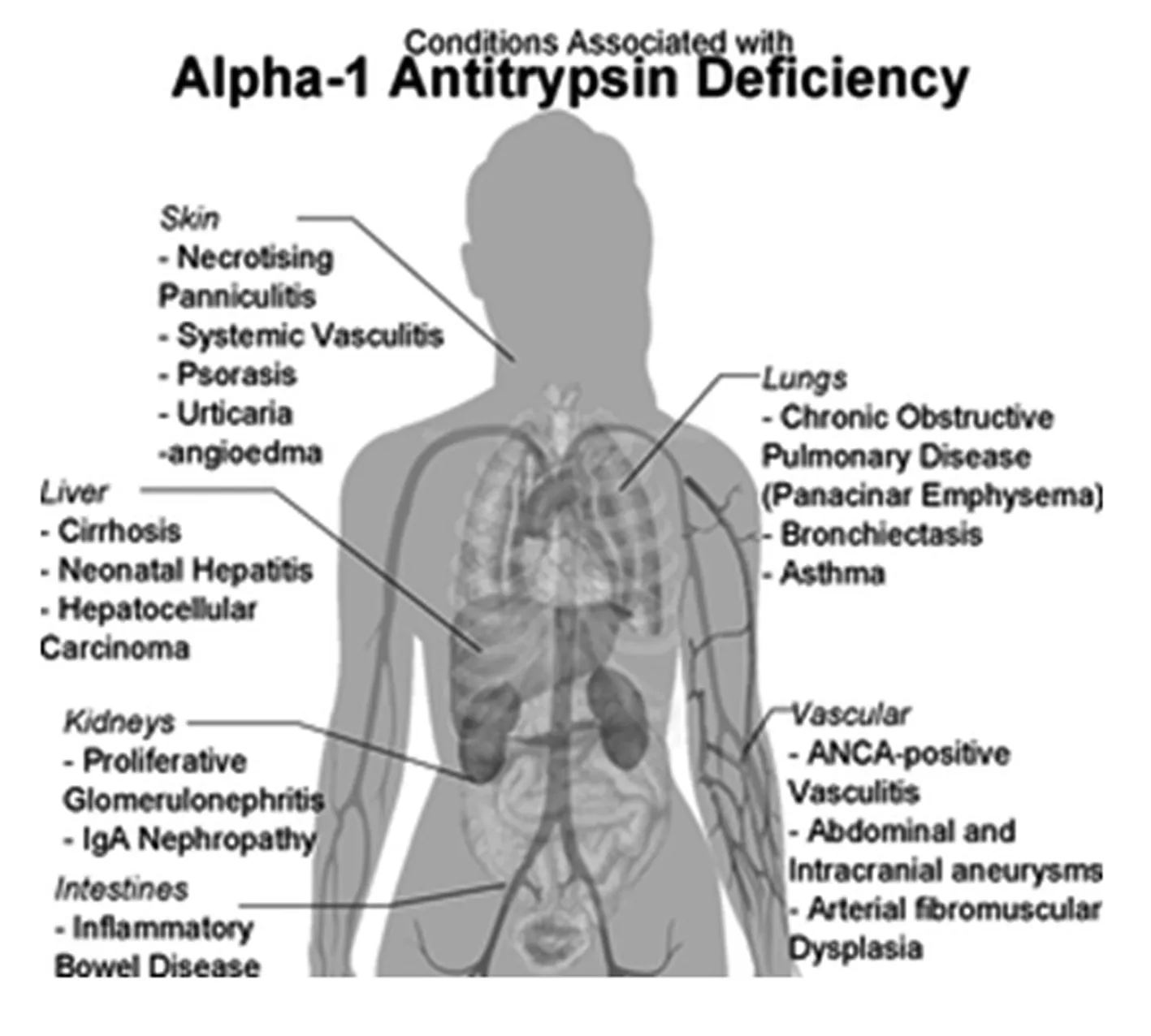
图4 AATD患者易发病类型及发病部位统计
在美国至少有2000万人携带AATD相关的等位基因,至少有10万携带AATD相关的纯合子基因,但只有不足10%的AATD患者能被明确诊断,而且拖延多年后才确诊,因此美国的肝功能检查套餐会发现AAT这个指标。相比较美国,中国AATD的认知率及确诊率更低,且有误诊延误病例。对慢性阻塞性肺部疾病(COPD)、哮喘等慢性肺部疾患者,当大剂量的药物治疗效果不明显时,需确认是否AATD,另外推荐家族成员进行AAT相关的检测。当然,环境或饮食习惯等外部因素也会增加AATD患者发生慢性肝损伤的风险,如中国人爱好聚餐吃较热的食物等用餐习惯易感肝炎,合并肝炎病毒感染、大量饮酒者易转为慢性肝病等。对体检筛查发现的抗胰蛋白酶缺乏的情况,但无症状表现者建议尽早接种肝炎疫苗,提前预防并降低感染后发展成慢性肝病的风险。因为缺少检测项目,目前国内医务人员对于该病的认知率更低,建议医务工作者在科学使用项目的基础上,对一些可疑病例进行筛查,包括药物治疗效果欠佳的早期肺气肿患者、不明原因的肝硬化、新生儿胆汁淤积以及一些已知患肝病的家族成员等[23]。通过检测血浆AAT水平,测定表型和基因型来确诊该疾病。
目前AATD的治疗包括输注纯化的人血浆AAT(每周每公斤体重60 mg),欧洲和北美部分地区现用此法治疗AATD患者,AAT强化治疗已获FDA批准。在许多研究中已经评估了静脉AAT增强疗法对AATD患者的临床疗效,越来越多的证据表明AAT增强疗法的有益性,主要是降低了肺密度损失和减缓FEV1的损失; 然而,这种疗法的成本效益仍然存在争议。
6 结论
本文主要描述了AAT的功能以及血清AAT浓度测定作为炎症性疾病和恶性肿瘤的生物标志物的潜力,及其在AATD筛查诊断中的应用价值。AAT可用作一系列炎性病症,如急性和慢性疾病,以及恶性病症的生物标志物。AAT的作用主要在于免疫系统调节作用,这是未来研究的一个有趣领域。未来的研究可能涉及开发生物标记物、AAT的新治疗用途,以及了解所有丝氨酸蛋白酶抑制剂(serpins)和所有急性期蛋白的更广泛作用。
