手性磷酸催化的不对称转移氢化反应及磷酸硼烷的应用
2020-12-17那斐李红亮
那斐 李红亮

摘 要: 不对称转移氢化反应作为还原反应中的重要组成部分被广泛应用于各类化合物、药物的研究与工业生产中。转移氢化反应最显著的特点是通过有机含氢化合物作为氢供体,避免了危险系数较高的氢气的使用。当前,在不对称转移氢化反应中应用最广泛的有机催化剂当属手性磷酸催化剂。综述了手性磷酸催化在不对称转移氢化反应中的最新进展,同时系统阐述了近几年硼烷作为氢供体形成的磷酸硼烷催化体系及其参与的不对称转移氢化反应。
关 键 词:不对称转移氢化反应;手性磷酸催化剂;硼烷;磷酸硼烷
中图分类号:O621.25+1 文献标识码: A 文章编号: 1671-0460(2020)11-2621-04
Chiral Phosphoric Acid Catalyzed Asymmetric Transfer
Hydrogenation and Application of Boro-Phosphate
NA Fei, LI hong-liang
(School of Pharmaceutical Science and Technology, Tianjin University, Tianjin 300072, China)
Abstract: Asymmetric transfer hydrogenation, as one primary section of reduction reaction, has been widely used and developed both in laboratory and industry. The main characteristic of asymmetric transfer hydrogenation is to utilize organic compounds as hydrogen source instead of hazardous H2 gas. Chiral phosphoric acids are most extensively used organic catalyst in asymmetric transfer hydrogenation. In this paper, recent development of asymmetric transfer hydrogenation with chiral phosphoric acids was described, and a new system of boro-phosphate with borane as hydrogen source was introduced as well as related asymmetric transfer hydrogenation reactions.
Key words: Asymmetric transfer hydrogenation; Chiral phosphoric acid; Borane; Boro-phosphate
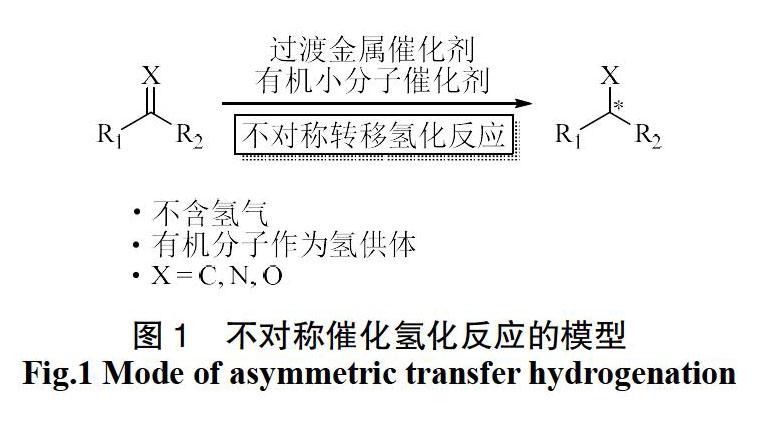
不對称转移氢化反应是还原类反应中的重要分支之一。2001年,日本教授Noyori正是因为其在不对称氢化领域的贡献,获得了诺贝尔化学奖。随后,众多学者的不断探索推动了不对称转移氢化反应的高速发展,诸多高产率高选择性的不对称转化正被不断报道。转移氢化反应的最显著特征是通过价廉易得的有机含氢化合物作为还原过程中的氢供体替代常见的危险性较高的氢气。除此之外,该类反应的环保价值及催化剂的低敏感性等特点促使其成为科学家研究的热点方向之一(图1)。
最早的转移氢化反应可追溯到百年以前,1903年KNOEVENAGEL教授通过钯黑实现了1,4-二氢对苯二甲酸二甲酯的歧化反应,生成了相应的对苯二甲酸二甲酯和顺式六氢对苯二甲酸[1]。而首次的不对称转移氢化反应报道于20世纪80年代,随着过渡金属催化剂的高速发展,多种金属被应用于不对称转移氢化反应之中[2]。
相比于金属催化剂,有机小分子催化剂由于其广泛的应用性、低毒性、绿色环保等特性在过去数十年开始走进科学家的视野,并且越来越多的科研人员开始投身于有机催化剂催化的不对称合成中去。1989年,BATRA教授首次通过氨基酸催化剂实现了无金属的不对称转移氢化反应,但是ee值(对映体过量)仅为62%[3]。随着过去20年中有机小分子催化剂的高速发展,越来越多种类的有机催化剂参与的高效转化相继被报道。在不对称转移氢化反应中,包括手性磷酸催化剂、手性胺催化剂以及硫脲类催化剂在内的诸多催化剂都展示出了出色的催化作用,而其中表现最突出的便是手性磷酸催化剂[4-6]。
1 手性磷酸催化剂在不对称催化氢化中的应用
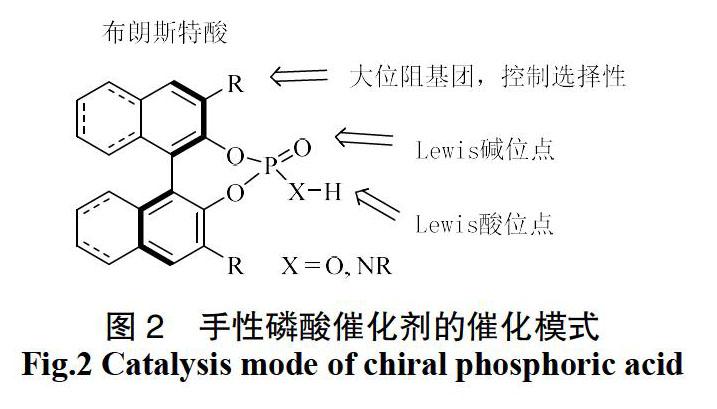
手性磷酸催化剂突出的应用价值已在各类反应类型中被证实。在温和条件下,该类催化剂就能实现多类反应中目标化合物的高产率及高选择性的转化,如亲核加成反应[7]、Diels-Alder反应[8]等。从图2的结构上看,手性磷酸催化剂主要骨架包括联二萘酚(BINOL)和八氢联二萘酚(H8-BINOL)等。由于质子的存在,磷酸催化剂归属于布朗斯特酸。在参与反应时,可以提供质子与电子云密度较高的基团相结合,同时磷氧羰基可以作为Lewis碱性位点,与底物中的质子相结合。在不同的反应机理中不同的结合位点可以单独发挥作用即单活化模式,也可以两个结合位点同时参与活化,即双活化模式或者双功能活化模式。催化剂中3、3位上不同的芳香族取代基团可以在结合位点周围营造出独特的空间结构。通过空间位阻的限制以及部分反应中存在的π-π相互作用,实现反应的高选择性的转化。
目前手性磷酸催化剂已被用于众多不饱和化合物的氢化还原中。首先,最值得关注的是针对碳氮双键的还原(图3)。2005年,Rueping教授最先提出手性磷酸催化的亚胺还原。通过Hantzsch酯作为氢供体以及20%(mol)的催化剂实现了相关手性胺的合成,ee值高达84%[9]。在2007年,Antilla教授通过不同骨架的磷酸催化剂实现了类似的转化,以高达99%的ee值实现了手性α-氨基酯的合成[10]。
除了亚胺外,另一类底物的氢化反应同样值得关注。手性磷酸催化剂同样可以高效催化含氮芳杂环(图4)。RUEPING教授于2006年及2007年分别报道了以Hantzsch酯为氢供体手性磷酸催化的喹啉和吡啶的不对称氢化还原反应,得到了相应的含有手性碳的四氢喹啉和四氢吡啶[11-12]。芳香环的稳定结构使得针对该类化合物的还原难度更高,而四氢吡啶和四氢喹啉类化合物常见于天然活性成分及药物的骨架部分,由此可以认为此方法为该类化合物的不对成合成提供了极具价值的新途径。
相比于磷酸催化剂在还原碳氮双键中的广泛应用,其在碳碳双键还原中的应用被报道的不多,目前局限于催化活泼烯烃的氢化还原反应,如烯胺和不饱和羰基化合物。烯胺可以在反应过程中很好地转化为亚胺进而参与反应[13]。而不饱和羰基化合物的氢化还原也仅有相对较活泼的不饱和醛和不饱和环酮可被手性磷酸催化还原[14-15]。2015年,孙建伟课题组报道了一类末端烯烃的还原(图5)。通过手性磷酸催化剂实现了手性二芳基甲烷的合成,并且获得较高的产率和选择性[16]。作者通过简单的模型推测了该反应的过渡态。计算发现芳环上的羟基是必需的,并且在过渡态转化为烯酮类中间体,与磷酸催化剂相结合,实现手性中心的生成。同时根据DFT(B3LYP-D3)计算E构型中间体(0 kcal·mol-1)相较于Z构型中间体(+2.1 kcal·mol-1)更加稳定。
从以上几类经典的反应可以看出,最常用的有机氢供体是Hantzsch酯,即1,4-二氢吡啶类化合物。根据RUEPING教授报道提出的可能性机理[7],如图6所示,Hantzsch酯的氮氢可以很好地和酰基氧相互作用,同时磷酸的氢可以结合不饱和化合物上的氮,随后Hantzsch酯4位的氢可以发生迁移转化为吡啶类结构,同时得到相应的手性化合物。底物以及催化剂的空间位阻都对反应选择性有巨大的影响。
除了常见的Hantzsch酯作为氢供体外,还有日本的AKIYAMA教授报道的苯并噻唑啉结构。2009年,该课题组首次通过此氢供体实现了酮亚胺的高效氢化转化[17-18]。其机理与上述机理类似,同样通过磷酸的两个位点发挥作用。
2 BINOL衍生的磷酸硼烷在不对称转移氢化反应中的应用
硼烷首次应用于磷酸催化的不对称氢化反应是在2011年(图7)。ANTILLA教授的课题组首次通过硼烷实现了酮的不对称还原,得到了相应的手性仲醇[19]。该方法以儿茶酚硼烷作为氢供体,通过N,N-二甲基吡啶(DMAP)作为添加剂,实现了手性醇的高效转化。值得注意的是,该反应的机理与上述其他氢供体参与的反应有所不同。ANTILLA课题组提出了磷酸硼烷的概念并推测磷酸首先与儿茶酚硼烷相互作用,放出一分子氢气,并形成了磷酸硼烷的前催化剂。其中,硼可以作为Lewis酸的位点,与底物的酮羰基产生很好的相互作用,而磷氧羰基依然可以作为Lewis碱的位点与体系中另一份子的硼烷的硼原子相结合,同时硼烷的氢加成至羰基碳上,实行酮向醇的转化。根据作者硼谱推测,DMAP可以通过对磷酸硼烷的影响,并通过结合的空间位阻更好地提升反应的选择性。
自报道以来,磷酸硼烷开始受到化学家們的关注。除了首次实现的酮的不对称转移氢化还原外,2013年ENDERS教授课题组通过手性磷酸和儿茶酚硼烷形成的磷酸硼烷体系实现了亚胺的还 原[20-21]。与上述的两种氢供体参与的不对称还原亚胺相比,磷酸硼烷的催化同样可以得到非常好的产率和选择性。
在2019年,宋秋玲教授和他的团队首次实现了2-取代吲哚的直接不对称氢化反应[22],如图8所示。吲哚类化合物相比于吡啶和喹啉类化合物的电子云密度和稳定性更高,因此针对吲哚的氢化还原反应更难实现。宋秋玲教授团队通过引入水分子实现了该转化的高产率和高选择性。该团队还通过DFT计算以及一系列机理研究发现,水分子的加入促使磷酸硼烷与水相互作用形成磷酸硼酸,促使吲哚转化位亚胺离子中间体,随后再通过磷酸硼烷还原该中间体得到含有手性碳的氢化吲哚。同样地,氢化吲哚也是生物活性分子以及药物结构中的基本骨架之一。宋秋玲教授团队通过获得的氢化吲哚为原料,实现了多种活性分子的合成,选择性依然保持在较高水准。
3 总结与展望
本文概述了手性磷酸催化剂在不对称转移氢化反应中的广泛应用,介绍了手性磷酸催化剂的催化机理以及不对称转移氢化反应的特征。目前,该类转化中应用最广泛的氢供体依然是Hantzsch酯,无论是碳氮双键还是碳碳双键都能展现很好的还原能力。苯并噻唑啉可以高效实现其中的部分转化,但是应用仍然不广泛。新型催化体系磷酸硼烷的提出,很好地实现了Hantzsch酯无法实现的羰基的还原和吲哚的还原,完善了手性磷酸催化剂在不对称转移氢化反应中的应用广度。但是磷酸硼烷的体系和反应机理还有待进一步研究,以解决目前不对称氢化中的更高难度的问题,如链状不饱和酮的选择性碳碳双键还原等。当然,磷酸硼烷的价值不止于此,其优化与纯化也是下一步需要尝试的工作,探索其除转移氢化领域外的更丰富的应用价值。
参考文献:
[1] KNOEVENAGEL E,BERGDOLT B.Ueber das verhalten des δ2.5 dihydrotere -phtalsa?uredimethylesters bei ho?heren temperaturen und in gegenwart von palladiummohr [J]. Chem. Ber.,1903, 36:2857-2860.
[2]WANG D, ASTRUC D. The golden age of transfer hydrogenation [J]. Chem. Rev. ,2015, 115:6621-6686.
[3]DALKO P I, MOISAN L. In the golden age of organocatalysis [J].Angew. Chem., Int. Ed.,2004, 43:5138-5175
[4] ROSSI S, BENAGLIA M,MASSOLO E, et al. Organocatalytic strategies for enantioselective metal-free reductions[J]. Catal. Sci. Technol., 2014, 4:2708-2723.
[5]PHILLIPS A M F, POMBEIRO A J L. Recent advances in organocatalytic enantioselective transfer hydrogenation[J]. Org. Biomol. Chem. , 2017, 15:2307-2340.
[6]ZHENG C, YOU S L. Transfer hydrogenation with hantzsch esters and related organic hydride donors[J]. Chem. Soc. Rev.,2012, 41: 2498-2581.
[7]PARMAR D, SUGIONO E, RAJA S, et al. Complete field guide to asymmetric binol-phosphate derived br?nsted acid and metal catalysis: history and classification by mode of activation; br?nsted acidity, hydrogen bonding, ion pairing, and metal phosphates [J]. Chem. Rev. ,2014, 114:9047-9153.
[8]陳彦蕊,白羽佳.手性联二萘酚骨架衍生的磷酸及其金属复合物在Diels-Alder反应中的应用[J].当代化工,2020,49(2):414-417.
[9]RUEPING M, SUGIONO E, AZAP C, et al. Enantioselective br?nsted acid catalyzed transfer hydrogenation: organocatalytic reduction of imines[J]. Org. Lett. ,2005, 7:3781-3783.
[10]LI G, LIANG Y, ANTILLA J C. A vaulted biaryl phosphoric acid- catalyzed reduction of α-imino esters: the highly enantioselective preparation of α-amino esters[J]. J. Am. Chem. Soc.,2007, 129: 5830-5831.
[11]RUEPING M, ANTONCHICK A P, THEISSMANN T. A highly enantioselective br?nsted acid catalyzed cascade reaction: organocatalytic transfer hydrogenation of quinolines and their application in the synthesis of alkaloids [J]. Angew. Chem., Int. Ed.,2006, 45: 3683-3686.
[12]RUEPING M, ANTONCHICK A P. Organocatalytic enantioselective reduction of pyridines[J]. Angew. Chem., Int. Ed.,2007, 46: 4562-4565.
[13]LI G, ANTILLA J C.Highly enantioselective hydrogenation of enamides catalyzed by chiral phosphoric acids[J]. Org. Lett.,2009, 11: 1075-1078.
[14]MAYER S, LIST B. Asymmetric counteranion‐directed catalysis [J]. Angew. Chem., Int. Ed. ,2006, 45:4193-4195.
[15]MARTIN N J A, LIST B.Highly enantioselective transfer hydrogenation of α,β-unsaturated ketones[J]. J. Am. Chem. Soc., 2006, 128: 13368-13369.
[16]WANG Z, AI F, WANG Z, et al. Organocatalytic asymmetric synthesis of 1,1-diarylethanes by transfer hydrogenation [J]. J. Am. Chem. Soc., 2015, 137:383-389.
[17]SAKAMOTO T, MORI K, AKIYAMA T. Chiral phosphoric acid catalyzed enantioselective transfer deuteration of ketimines by use of benzothiazoline as a deuterium donor: synthesis of optically active deuterated amines[J]. Org. Lett., 2012, 14:3312-3315.
[18]ZHU C, AKIYAMA T.Benzothiazoline: highly efficient reducing agent for the enantioselective organocatalytic transfer hydrogenation of ketimines[J]. Org. Lett. ,2009, 11:4180-4183.
[19]ZHANG Z, JAIN P, ANTILLA J C. Asymmetric reduction of ketones by phosphoric acid derived catalysts[J]. Angew. Chem. Int. Ed.,2011, 50:10961-10964.
[20]ENDERS D, REMBIAK A, SEPPELT M. Asymmetric
organocatalytic reduction of ketimines with catecholborane employing a n-triflyl phosphoramide br?nsted acid as catalyst [J]. Tetrahedron Lett., 2013, 54:470-473.
[21]ENDERS D, REMBIAK A, STOECKEL B A. Chemo- and enantioselective br?nsted acid-catalyzed reduction of α-imino esters with catecholborane[J]. Adv. Synth. Catal.,2013, 355:1937-1942.
[22]YANG K, LOU Y, WANG C, et al.Chiral Br?nsted Acid from Chiral Phosphoric Acid Boron Complex and Water: Asymmetric Reduction of Indole[J]. Angew. Chem. ,2020, 132:2-8.
