甲苯液相氧化合成苯甲醛的研究
2020-12-16刘建武严生虎
刘建武,严生虎,张 跃
(1.常州大学制药与生命科学学院,江苏 常州 213164; 2.石油和化工行业连续流技术工程实验室,江苏 常州 213164)
苯甲醛是一种重要的精细化工产品,广泛应用于医药、染料、香料、农药和材料等工业领域中[1]。
苯甲醛的生产方法主要包括甲苯氯化水解法、苯甲醇催化氧化法和甲苯直接氧化法,其中甲苯直接氧化法包括气相法和液相法。目前,国内苯甲醛生产厂家主要采用甲苯氯化水解法,该方法由甲苯经光氯化法得到混合氯苄,经减压精馏收集苄基氯和苄叉二氯,经Sommelet反应、酸/碱性水解得到苯甲醛。该方法存在工艺周期长、酸碱消耗量大、三废排放量多、能耗高等缺点[2-3],并且苯甲醛含有微量的氯化物,大大限制了其在高端行业中的广泛应用。关于苯甲醇氧化制备醛酮的研究已有大量报道,主要集中在氧化剂选择,包括铬试剂[4-5]、锰试剂[6]、碘试剂[7-8]及过渡金属氧化物[9-10]等。这些氧化剂虽然氧化活性很强、反应速度快,但氧化过程难控制,而且多使用重金属,易造成环境污染,且氧化工艺均为间歇操作,物料返混严重,传热效果差,工艺条件难以控制,容易发生深度氧化。甲苯气相氧化法反应速度快,生产效率高,但一直存在反应温度高、副产物复杂、选择性差且不易分离、产成本较高等缺陷,高选择性和高活性的催化剂开发是制约该方法工业化应用的瓶颈[11-14]。甲苯液相氧化法氧化剂来源广泛、工艺条件温和、操作简单、环境友好,由于苯甲醛不稳定,极易过度氧化成苯甲酸,甲苯转化率和苯甲醛选择性难以同时提高[15]。目前苯甲醛工业化生产仍采用间歇釜批次操作,物料返混严重,传质传热效果差,氧化剂利用率低,难以实现对氧化过程的精确控制,容易因局部过热发生“飞温”现象,且双氧水分解速率较快,容易引发安全事故[16]。
作者在上述研究基础上,以甲苯为底物,醋酸为溶剂,乙酸钴为催化剂,溴化钠为助催化剂,在双氧水液相氧化催化作用下生成苯甲醛。考察催化剂种类、助催化剂、双氧水浓度、氧化剂用量、催化剂用量、反应时间和温度对氧化反应的影响,筛选适用于直接氧化法制备苯甲醛的高选择性和高活性的催化氧化体系,为实现甲苯连续氧化合成苯甲醛的工业化应用提供基础。
1 实验
1.1 试剂和仪器
醋酸钴,分析纯,阿拉丁化学试剂有限公司;环烷酸钴,分析纯,北京百灵威科技有限公司;钼酸钠,分析纯,江苏强盛功能化学股份有限公司;硫酸氧钒,分析纯,上海达瑞精细化学品有限公司;醋酸锰、溴化钠,分析纯,上海凌峰化学试剂有限公司;过氧化氢,工业级,中盐常州化工有限公司;醋酸,化学纯,上海申博化工有限公司。
气相色谱仪,GC7890B型,安捷伦科技有限公司;超高精度便携式计量泵,HYM-PO-B2-NS-08型,日本FUJI-Techno Industries公司;delta隔膜计量泵,德国Prominent公司;质量流量控制器,Mini CORI-Flow型,荷兰Bronkhorst公司;加热冷却控制系统,LENYA型,无锡冠亚恒温冷却科技公司;低温恒温槽,DC-3030型,上海横平仪器仪表厂;管道及阀门,PFA(1/8 inch),美国Swagelok公司;常规玻璃仪器。
1.2 实验过程
如图1流程图所示,依次加入甲苯、冰醋酸、催化剂[n(乙酸钴)/n(甲苯)=1/50]和助催化剂[n(溴化钠)/n(甲苯)=1/30],加热搅拌,待温度升到设定值后,一次性加入定量过氧化氢,随即密封搅拌升温反应,待反应结束后,迅速将烧瓶放入冰水中淬灭反应,后用少量二氯甲烷萃取有机相3次,然后合并有机相,进行GC分析,采用面积归一化法做定量分析,平行实验3次,得到实验数据求平均值。累积同条件下反应物料进行减压精馏,所得馏分做定性分析。

图1 甲苯氧化工艺流程图Fig.1 Flow chart of oxidation of toluene
1.3 分析方法
采用气相色谱进行定量分析,色谱数据采用面积归一化法计算分析结果,分析仪器为Agilent 7890B气相色谱仪;色谱柱HP-5(30 m×320 μm×0.25 μm);载气:氮气流量25 mL/min;氢气流量30 mL/min;空气流量400 mL/min;柱前压力34.5 kPa;柱温65 ℃;升温速率30 ℃/min;进样口温度260 ℃;终止温度250 ℃;检测器温度300 ℃;进样量0.4 μL。
2 结果与讨论
2.1 不同催化剂种类对氧化反应的影响
在n(甲苯)∶n(过氧化氢)=1∶3,n(溴化钠)∶n(甲苯)=1∶30,w(过氧化氢)为25%,θ=105 ℃,t=20 min条件下,考察过渡金属催化剂对甲苯液相氧化反应的影响,实验结果见图2。

图2 不同催化剂对反应的影响Fig.2 The influence of different catalysts on reaction
由图2看出,乙酸钴对甲苯液相氧化反应催化效果最佳,甲苯转化率达到39.8%,苯甲醛选择性达到71.4%。钴、钼、钒和锰均为过渡周期中的变价金属,催化活性主要取决于其自身的氧化还原电位差的大小。液相甲苯氧化属于自由基反应,在反应过程中会不断发生氧化还原电子的交换,钴离子的氧化还原电位较高,也就决定了其催化活性的优势,它在反应中的存在形式会在Co2+与Co3+之间不断交替,2种形态分别充当还原剂和氧化剂与过氧化氢发生自由基反应,促使反应正向进行。
2.2 助催化剂对氧化反应的影响
在n(甲苯)∶n(过氧化氢)=1∶3,n(乙酸钴)∶n(甲苯)=1∶50,w(过氧化氢)为25%,θ=105 ℃,t=20 min条件下,考察助催化剂对甲苯液相氧化反应的影响,实验结果见图3。

图3 助催化剂对反应的影响Fig.3 The influence of co-catalysts on reaction
由图3可知,助催化剂可以缩短甲苯液相氧化反应的诱导期从而提升反应效率。在链引发阶段,Co2+和Br-先被过氧乙酸氧化成Co3+和Br2,然后与底物之间发生电子转移使甲苯转化成苄基自由基。溴化钠作为引发剂参与反应时催化效果较为显著,甲苯转化率达到39.9%,苯甲醛选择性达到73.5%,这在一定程度上验证了催化机理的正确性。与偶氮二异丁腈和过氧化苯甲酰这类引发剂相比,溴化钠在溶剂醋酸中会与乙酸钴发生复分解反应,产生反应式溶解效应,使得溴离子在反应体系中分布更为均匀,可借助有机溶剂与甲苯充分接触;尤其是溴化钠助催化剂在后处理过程经二氯甲烷多次萃取,溴离子大部分会留在水相中,通过调控反应条件可以提高甲苯转化率和苯甲醛选择性,不影响苯甲醛产品质量。
2.3 w(过氧化氢)对氧化反应的影响
在n(甲苯)∶n(过氧化氢)=1∶3,n(乙酸钴)∶n(甲苯)=1∶50,n(溴化钠)∶n(甲苯)=1∶30,θ=105 ℃,t=20 min条件下,考察不同浓度过氧化氢对甲苯液相氧化反应的影响,实验结果见图4。
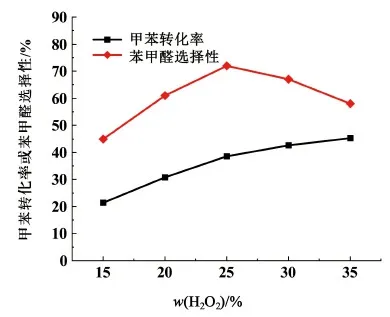
图4 w(过氧化氢)对反应的影响Fig.4 The influence of concentration of hydrogen peroxide on reaction
由图4可知,随着w(过氧化氢)的提高,甲苯转化率逐步增加,苯甲醛选择性则呈现先增大后减小的趋势。w(过氧化氢)为25%时,甲苯转化率达40.1%,苯甲醛选择性达71.6%。随着w(过氧化氢)的增加,反应体系内氧化活性组分分布随之增加,使其更易于与Br-和Co2+接触并氧化成为Br2和Co3+,实现对甲苯的诱导反应,而甲苯被活化成为苄基自由基是甲苯转化的关键,过氧化氢溶液中水对液相甲苯氧化反应是不友好的,会导致反应过程传质不畅,催化剂和氧化剂的利用率被会降低。所以w(过氧化氢)越高,越有利于反应,甲苯转化率会随之提高,同时也增加了深度氧化的可能,苯甲醛的选择性不升反降。综合考虑25%浓度的过氧化氢较为合适。
2.4 氧化剂用量对反应的影响
在n(乙酸钴)∶n(甲苯)=1∶50,n(溴化钠)∶n(甲苯)=1∶30,w(过氧化氢)为25%,θ=105 ℃,t=20 min条件下,考察过氧化氢的量对甲苯液相氧化反应的影响,实验结果见图5。

图5 氧化剂用量对反应的影响Fig.5 The influence of dosage of oxidant on reaction
由图5可知,随着过n(氧化氢)对n(甲苯)的提高,甲苯转化率逐步增加,苯甲醛选择性则呈现先增大后减小的趋势。n(甲苯)与n(过氧化氢)为1∶3时,甲苯转化率为40.1%,苯甲醛选择性达70.2%。过氧化氢在链引发阶段会间接促进甲苯的活化,使其变为苄基自由基,而苄基自由基的生成数量决定了甲苯的转化程度。过氧化氢投加量越多,就会有越多的苄基自由基生成,甲苯转化率也就越大。氧化剂用量较小时,大部分氧化活性基团都参与到链引发阶段以及链增长阶段的中前期,用量高时,就会提高过度氧化的几率,影响苯甲醛的选择性。
2.5 催化剂用量对氧化反应的影响
在n(甲苯)∶n(过氧化氢)=1∶3,n(溴化钠)∶n(甲苯)=1∶30,w(过氧化氢)为25%,θ=105 ℃,t=20 min条件下,考察乙酸钴的量对甲苯液相氧化反应的影响,实验结果见图6。

图6 催化剂用量对反应的影响Fig.6 The influence of dosage of catalyst on reaction
由图6可知,在甲苯液相催化氧化反应中,催化剂起着举足轻重的作用,在促进链引发阶段进行的同时,还可以在链增长阶段调节产物的分布。随着n(乙酸钴)对n(甲苯)的提高,甲苯转化率逐步增加,苯甲醛选择性则呈现先增大后减小的趋势。n(乙酸钴)/n(甲苯)为1/50时,甲苯转化率为36.6%,苯甲醛选择性达70.2%。乙酸钴可以缩短链引发阶段,提高苄基自由基产生的数量,同时在链引发阶段也会通过钴离子的氧化还原能力促进整体反应进行,另外,乙酸钴用量多时,更多钴离子会参与到链增长阶段,促进氧化反应的连串化,苯甲醛分子得不到有效积累,促使苯甲醛选择性降低。
2.6 反应时间对氧化反应的影响
在n(甲苯)∶n(过氧化氢)=1∶3,n(乙酸钴)∶n(甲苯)=1∶50,n(溴化钠)∶n(甲苯)=1∶30,w(过氧化氢)为25%,θ=105 ℃条件下,考察反应时间对甲苯液相氧化反应的影响,实验结果见图7。

图7 反应时间对反应的影响Fig.7 The influence of reaction time on reaction
由图7可知,苯甲醛作为连续反应的中间产物,反应时间需要严格控制,反应较长时间后,苯甲醛大部分过度氧化为苯甲酸。随着反应时间的增加,甲苯转化率呈上升趋势,而苯甲醛选择性先上升后下降,在反应时间为20 min时,甲苯转化率达到41.8%,苯甲醛选择性达到峰值71.8%。甲苯在空气中就可以被很缓慢的氧化,虽然甲苯与苯甲醇之间存在可逆反应,甲苯氧化难以逆向进行,使得苯甲醛在积累到一定量之后会被过度氧化成苯甲酸,导致苯甲醛选择性先增加后减小。
2.7 温度对氧化反应的影响
甲苯液相氧化反应属于强放热反应,反应热约为567.4 kJ/mol,甲苯分子的活化依赖于较高的温度[17-19]。在高温下,甲苯容易被过度氧化,这对生成苯甲醛是不利的。因此,甲苯液相氧化反应对温度的选择必须综合考虑反应热力学和甲苯氧化历程,见图8和图9。
甲苯液相氧化是自由基反应,反应过程非常复杂[20]。反应机理如图9所示,在链引发阶段,双氧水和醋酸先形成过氧乙酸,Co2+先被过氧乙酸氧化成Co3+,随即分别与底物之间发生电子转移使甲苯转化成苄基自由基。链引发阶段,苄基自由基在氧化剂、Co2+和Co3+交替作用下不断发生电子和离子的转移,从而生成醇、醛、酸等产物。氧化剂、催化剂以及外部施加的工艺条件共同影响链引发阶段,决定了甲苯的转化程度;在链增长阶段,氧化剂和催化金属离子起主要作用。
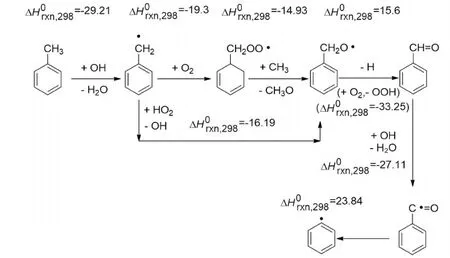
图8 甲苯氧化热力学Fig.8 Thermodynamics of oxidation of toluene
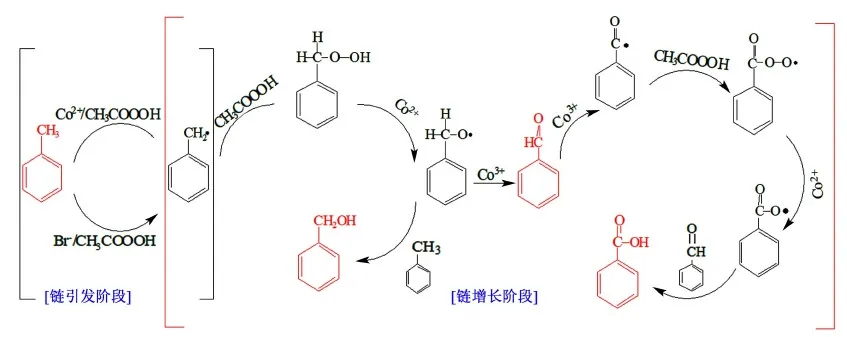
图9 甲苯催化氧化反应机理Fig.9 Mechanism of toluene oxidation reaction
在n(甲苯)∶n(过氧化氢)=1∶3,n(乙酸钴)∶n(甲苯)=1∶50,n(溴化钠)∶n(甲苯)=1∶30,w(过氧化氢)为25%,t=20 min条件下,考察温度对甲苯液相氧化反应的影响,实验结果见图10。

图10 温度对反应的影响Fig.10 The influence of temperature on reaction
由图10可知,随着反应温度的提高,甲苯转化率不断增加,苯甲醛选择性先增大后减小,反应温度为105 ℃时,甲苯转化率达到40.8%,苯甲醛选择性为71.4%。温度对甲苯氧化过程影响明显,随着温度的升高,甲苯更易于被活化从而更有利于苄基自由基的产生和积累,缩短链引发阶段的时间,此时产物中苯甲醛生成速率大于其他产物生成速率。随着温度的继续提高,体系中Co2+会被氧化成Co3+,进而与苄甲氧基自由基反应,使得反应向生成苯甲酸的方向进行,苯甲酸和苯甲酸苄酯的生成速率大于苯甲醛的生成速率,使得苯甲醛选择性先增大后减小。
3 结论
1)甲苯液相氧化工艺,乙酸钴与溴化钠催化协同效应在双氧水和醋酸形成的过氧乙酸体系下,对自由基反应中氧化产物的分布和调控起到关键作用。
2)工艺条件:n(甲苯)∶n(过氧化氢)=1∶3,n(乙酸钴)∶n(甲苯)=1∶50,n(溴化钠)∶n(甲苯)=1∶30,w(过氧化氢)为25%,θ=105 ℃,t=20 min时,甲苯转化率达49.2%,苯甲醛选择性达70.4%。
