机械辅助通气对急诊介入治疗的急性心肌梗死合并心源性休克患者血流动力学及死亡率的影响
2020-12-16陈妍高洁杨浩郭晓玲丛洪良杨清张文娟
陈妍,高洁,杨浩,郭晓玲,丛洪良,杨清,张文娟
尽管随着更加快速的和广泛的再血管化治疗的应用,急性心肌梗死(AMI)合并心源性休克(CS)的发生率已经有所下降,CS仍然是AMI住院死亡的最主要的原因[1]。经皮冠状动脉(冠脉)介入治疗(PCI)明显改善AMI患者的预后,减低缺血并发症的发生,特别是在高危患者中,但其优势是建立在能使患者尽快接受急诊PCI之上的[2],给机械辅助通气(IMV)的应用带来挑战。因为需要IMV的患者有更差的左室功能、不稳定的血流动力学、更高的Killip分级[3]。单纯的主动脉内球囊反搏术(IABP)支持对于氧合的改善不明显,而其他的机械辅助装置如左室辅助装置Impella、ECMO由于受到治疗经验、合并症以及经济费用的影响还没有得到广泛应用。目前机械通气在AMI患者急诊PCI中的应用尚未广泛开展,AMI合并CS接受PCI的比例相对较低,合并CS的AMI患者急诊PCI仍是介入心脏病领域的棘手问题,关于AMI发生CS最佳的处理策略仍然是未知的[4]。
对于AMI患者早期的介入治疗已经显示明显获益,但是IMV是否增加AMI合并CS出现急性肺水肿患者的生存获益目前存在一定的争议,研究侵入性持续性正压通气(PEEP)对于血流动力学的影响更有意义。我们探讨早期应用IMV维持中等水平PEEP对于AMI合并CS接受急诊PCI治疗患者死亡率及血流动力学的影响。
1 对象与方法
1.1 研究对象本研究为单中心调查研究,入选2015年1月至2016年12月期间就诊于天津市胸科医院的急性ST段抬高型心肌梗死(STEMI)患者。入选标准:①患者年龄大于18岁。②符合急性STEMI的诊断标准[5]:持续性胸痛症状超过30 min;肌钙蛋白和/或CKMB超过参考值上限99百分位置;心电图出现的至少两个相邻导联ST段抬高≥0.2 mV胸前导联或者≥0.1 mV肢体导联。符合急诊介入治疗指征,接受急诊PCI。③心源性休克诊断标准[3]:①无低血容量情况下收缩压(SBP)<90 mmHg(1 mmHg=0.133kPa),或者需要血管活性药物维持收缩压达到≥90 mmHg;②伴有组织低灌注表现 :如尿量≤20 ml/h;中枢神经系统功能改变;③周围血管收缩表现:四肢末梢皮肤湿冷、发绀;同时排除其他原因如因疼痛、迷走反射、心律失常、药物或出血等所致的低血压。④急性肺水肿定义:出现严重的呼吸困难、两肺布满湿罗音、胸片可见肺间质或者肺泡浸润。
1.2 研究方法所有患者入院后即刻床旁查18导联心电图;静脉采血查心肌酶,肌钙蛋白、N-末端脑钠肽前体(NT-ProBNP),血常规,肾功能,电解质,凝血常规,床旁查胸片、超声心动图等。对于发生CS出现急性肺水肿的患者根据应用辅助通气的类型分为侵入性机械辅助通气组(IMV组)和非侵入性辅助通气组(NIV组)。符合急诊介入指征的STEMI患者经绿色通道至导管室行急诊冠脉造影检查和介入治疗。梗死相关动脉血流采用TIMI分级,冠脉狭窄程度根据美国AHA制定的标准,前降支、回旋支、右冠或大的主要分支管腔狭窄>75%,左主干管腔狭窄>50%为有意义的狭窄。冠脉造影明确血管病变后,根据病变特点急诊完成PCI。每一例患者的治疗策略均由2名有经验的医生制定。
1.2.1 AMI合并CS出现急性肺水肿的治疗建立静脉通路,输注利尿剂、血管活性药物等积极纠正休克和抗心衰治疗,监测血气分析,血氧饱和度低于90%使用辅助通气。围术期应用IABP支持。术后即刻局麻下行右侧颈内静脉穿刺,置入Swan-Ganz气囊漂浮导管行血流动力学连续监测,记录术后即刻、3 h、6 h、12 h、24 h、48 h中心静脉压(CVP)、肺动脉压(PAP)、肺毛细血管楔压(PCWP)指标,监测心率、收缩压、舒张压、平均动脉压(MAP)。
1.2.2 IMV使用标准[6]①出现意识障碍,不能维持充分氧供;②急性肺水肿合并呼吸衰竭:动脉血气分析PO2<60 mmHg、呼吸频率>40 次/min,血氧饱和度持续低于90%;③出现顽固性低氧血症,经利尿剂、血管活性药物等治疗及普通面罩和鼻导管吸氧方式不能缓解,或无创呼吸机使用不能迅速纠正的低氧血症。
1.2.3 IMV治疗由麻醉科医生给予患者基础麻醉,床旁气管插管,连接呼吸机辅助呼吸,采用中等水平(4~10 cm H2O)的PEEP模式。由呼吸科医生根据血氧饱和度、血气分析(氧分压、二氧化碳分压、PH值)调整呼吸参数,维持血氧饱和度>90%。
1.2.4 NIV定义[7]以无创呼吸机通过面罩完成持续正压通气,呼气末正压维持在4~10 cm H2O,根据患者症状调整参数,使血氧饱和度>95%。
1.3 统计学方法所有数据均应用SPSS 18.0软件进行统计学分析。统计学分析由职业统计学人员完成。计量资料用均数±标准差表示,组间比较采用t检验或方差分析;计数资料用频数和百分比表示,资料间比较采用χ2检验或Fisher精确检验,疾病风险因素的选择采用多因素Logistic回归分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1 入选患者的一般资料情况2015年1月至2016年12月,入选STEMI接受急诊PCI的1113例患者中,发生CS 91例(8.2%),因合并急性肺水肿一般药物治疗不能迅速纠正的低氧血症而接受辅助通气75例,占83.5%(75/91)。CS合并肺水肿IMV组48例,占64.0%(48/75),NIV组27例,占36.0%(27/75);接受IMV死亡16例,占33.3%(16/48);接受NIV死亡11例,占40.7%(11/27),IMV和NIV死亡率比较,差异无统计学意义(χ2=0.41,P=0.521)。
IMV组和NIV组患者的一般资料和基线特征比较:两组在肌酸激酶同工酶(CK-MB)水平、NT-proBNP值、FMC时间与NIV组比较,差异没有统计学意义(P>0.05);IMV组的pH值、氧分压明显低于NIV组(P<0.05),乳酸水平高于NIV组(P<0.05);IMV组的TIMI血流0-1级的比例明显高于NIV(P<0.05);IMV组的IABP使用时间、辅助通气时间短于NIV组(P<0.05,表1)。
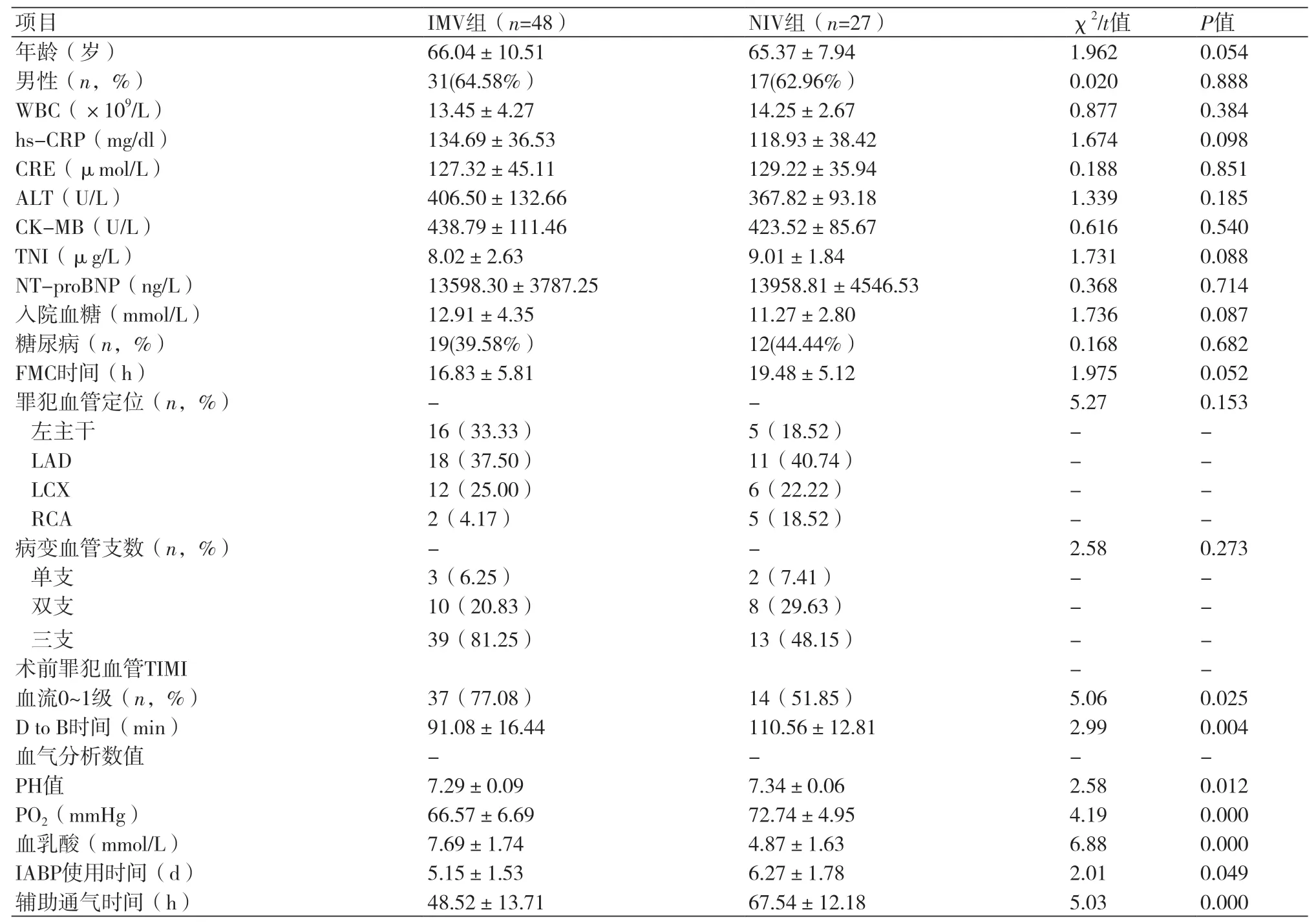
表1 两组患者一般资料比较
2.2 两组患者血流动力学指标比较IMV组患者PCI后即刻CVP值平均28.77 cm H2O,PAP 40.54 mmHg,PCWP 32.71 mmHg,术后3 h开始逐渐下降,而MAP术后即刻平均52.29 mmHg,术后3 h开始逐渐升高。两组术后即刻CVP、PAP、PCWP、MAP值比较差异没有统计学意义(P>0.05);IMV组CVP术后3 h、6 h、12 h、24 h、 48 h均低于NIV患者(P<0.05);IMV组PAP术后3 h、6 h、12 h、24 h均低于NIV患者(P<0.05);IMV组PCWP术后3 h、6 h、12 h、24 h均低于NIV患者(P<0.05);IMV组MAP术后3 h、6 h、12 h均高于NIV患者(P<0.05)(图1)。
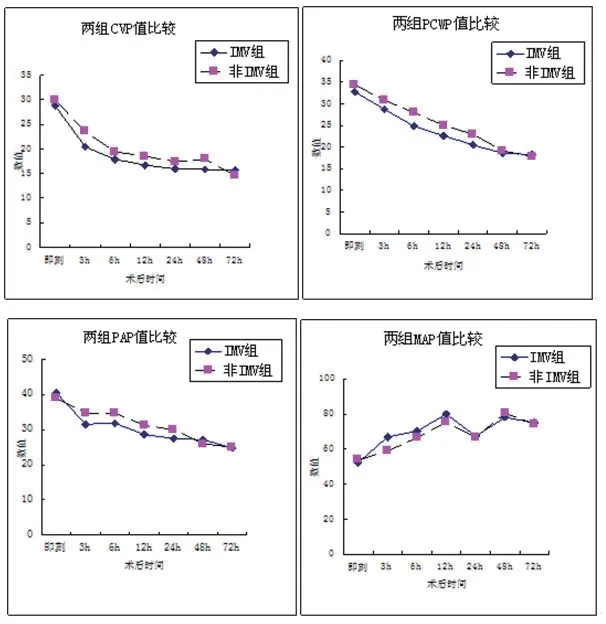
图1 IMV组和NIV组PCI术后血流动力学指标的变化
2.3 AMI合并CS出现急性肺水肿院内死亡的相关危险因素分析采取多因素二元Logistic回归分析,以1表示有,0表示无,经年龄、性别、合并疾病等危险因素校正,FMC时间过长、肝功能衰竭、肾功能衰竭、术后TIMI血流<3级为AMI发生CS死亡的独立风险因素(P<0.05),而使用IMV未增加患者死亡风险(P=0.629,95%CI:0.117~34.837)。

表2 AMI合并心源性休克院内死亡相关危险因素分析
3 讨论
CS是AMI患者灾难性的并发症,发生率平均约8%(范围5%~15%),其中1/3发生在就诊当时。我们的研究显示,AMI后CS的发生率为8.2%,与国外报道相近[8]。接受IMV患者TIMI血流0~1级的比例明显增高、氧分压减低明显、酸中毒严重,这些与泵衰竭相关,提示患者预后不佳,死亡风险增加。
AMI合并CS的病理生理特征是由于冠状动脉血管容量的不足导致心肌组织的缺氧,心输出量的减少。在血流动力学方面,肺毛细血管楔压增高通常>15 mmHg,同时导致左室充盈压增高,因此CS患者常合并严重的肺水肿[9]。我们的研究发现,83.5%的CS患者合并严重的肺水肿,这种情况下行急诊介入治疗非常困难,需呼吸机支持以迅速纠正低氧。呼吸机已经广泛应用于临床危重症患者中,但是应用于AMI较少,特别是急诊PCI中。2012年ESC急慢性心衰指南指出低氧相关于增加的短期死亡风险,为纠正低氧,可考虑应用机械性辅助通气。目前NIV应用于CS合并急性肺水肿的患者已经得到普遍认同,其可以促进血流动力学的稳定,增加生存获益[10],但关于IMV对于血流动力学的影响以及最佳的应用时机目前研究不多,并且存在争议。一些研究认为PEEP增加胸腔内压力,减少静脉血液回流、增加右室后负荷、减少左室充盈、降低心输出量和器官灌注,影响血流动力学的稳定性[11]。因此推论IMV对于AMI患者心输出量和系统灌注产生有害影响,对于CS患者避免使用IMV[12]。实际上,这些是基于急性呼吸窘迫综合征(ARDS)的患者研究,这个结论是否适用于AMI合并CS患者尚无定论。另外一些研究显示,正压通气对于左室功能没有影响。相反,PEEP可以减少左室氧耗量,改善右室功能,促进氧转运到缺血的心肌组织[13]。我们关注了IMV对于AMI合并CS术后血流动力学的影响。我们的研究显示,IMV组术后3 h CVP、PAP、PCWP水平明显下降,MAP值上升,且术后6~24 h CVP、PAP、PCWP逐渐降低,与NIV组比较差异有统计学意义;而MAP值术后3~12 h较NIV组明显增高,提示使用IMV可促进肺水肿的早期消退和血流动力学的临床获益,证实早期应用IMV予中等水平的PEEP可促进血流动力学的稳定。PEEP通过减低胸腔内压力而减低左室后负荷,同时减少静脉回心血量减低左室前负荷因此缓解心脏的充血;减低呼吸肌做功和代谢水平;逆转由于缺氧导致的肺血管收缩;增加心肌对于氧的利用度。这些血流动力学的改变对于左室功能不全的患者带来有利影响,因为左室功能不全的患者对于后负荷的改变是非常敏感的。而脓毒血症的ARDS患者左室功能是正常的,左室功能依靠于前负荷的影响,PEEP导致的心输出量降低主要是静脉回心血量减少从而导致前负荷的减少[14,15]。 因此,CS患者IMV对于血流动力学不仅可产生有利影响,还可以增加临床终点事件的获益。
另外,虽然随着再血管化的治疗、最新的药物以及机械辅助装置的使用等医学治疗水平不断提高,AMI合并CS的死亡率仍是非常高的,在40%~60%[9]。有研究认为机械通气相关于增加的死亡风险,Kouraki报道AMI接受机械通气的死亡率为50%左右[16],Antonio等报道使用机械通气的AMI患者住院死亡率为40%,考虑与入选CS人数偏少以及接受急诊PCI比例偏低有关,接受介入治疗的比例仅有68%[17]。本研究入选的患者全部为合并CS,且全部接受急诊介入治疗,死亡率为33.33%。我们的研究显示FMC时间过长、肝功能衰竭、肾功能衰竭、术后TIMI血流<3级为AMI发生CS死亡的独立风险因素,而使用IMV未增加患者死亡风险,提示使用IMV在CS患者中急诊PCI的获益。
许多研究已经证实急诊PCI率的增加和院内病死率的降低独立相关,从而证实积极的血运重建可以明显改善AMI合并CS患者的预后[18]。但是,由于受到患者的临床状态、过高的介入手术风险、介入技术、设备条件等因素限制,心源性休克常常得不到最积极有效的治疗[4]。术前心肺不稳定的状态明显延迟再灌注治疗的时间,而以心肌再灌注为基础的积极治疗策略应成为AMI合并CS刻不容缓的治疗措施。 急性心衰(AHF)住院的第1 h是包括死亡等并发症发生的高危时段,也是干预治疗的黄金时间。缩短AHF治疗时间增加患者的获益。特别是AMI这种可逆性因素存在时,快速识别并积极治疗AHF的促发因素是防止AHF加剧恶化的关键。缩短D to B时间对于提高高风险的AMI患者的生存率至关重要[19]。我们的研究发现,使用IMV组的D to B时间明显短于NIV组,辅助性通气治疗可以促进气体交换、补充肺泡单元、使来自于肺泡和间质的水份转移到循环中,抵消流体静力学力量导致的肺水肿、维持气道通畅,快速纠正急性低氧性呼吸衰竭,改善呼吸困难和呼吸窘迫[20,21]。 提示IMV促进患者临床症状的稳定,增加患者的依从性,使患者尽早接受PCI。
总之, AMI患者的预后很大程度依赖尽早实现缺血心肌的有效再灌注,急诊PCI是挽救濒死心肌和生命最没有争议的手段。但由于合并心衰、肺水肿,常需机械辅助通气。AMI合并CS患者术中使用IABP联合呼吸机增加手术的安全性、可靠性和手术成功率,减少AMI合并CS的死亡率,提高患者的生存率,缩短住院周期。相对于如左室辅助装置Impella、ECMO这些昂贵的机械辅助装置,住院费用明显降低,且外周血管并发症明显减少,节省围术期相关医疗费用,具有非常好的社会效益与经济效益。
局限性:这是一篇回顾性研究,样本例数较少,对于这些患者我们也缺乏长期随访。接受急诊介入治疗的患者,我们仅应用IABP作为机械辅助支持,因此不了解更高级的机械辅助支持治疗如ECMO、左室辅助装置(LVADs)对于这些重症患者的影响。但是,我们的研究主要是提示对于AMI合并CS出现急性肺水肿或呼吸循环衰竭,顽固性低氧血症,使用血管活性药物、利尿剂等症状改善不明显的高危患者,早期行急诊介入治疗,置入IABP的同时,在基础麻醉状态下予以气管插管,呼吸机辅助呼吸,采用中等水平的PEEP模式,可以提高患者的生存率。
