替格瑞洛和氯吡格雷对非氯吡格雷抵抗者行PCI术后炎性介质及内皮细胞功能的影响
2020-12-16游正林杨启才任凌李正义
游正林,杨启才,任凌,李正义
2012年,由欧洲心脏病学会颁布的《急性ST段抬高型心肌梗死患者管理指南》[1]推荐替格瑞洛是与氯吡格雷并列使用的用于急性ST段抬高型心肌梗死(STEMI)患者经皮冠状动脉介入术(PCI)术后抗血小板治疗药物,而且对血小板的抑制作用较氯吡格雷更显著。2016年3月,由美国心脏学会/美国心脏病学会根据PLATO[2](血小板抑制和患者转归)最新研究结果建议对于急性冠脉综合征(ACS)患者植入支架后以及未接受血运重建的非ST段抬高型ACS患者双联抗血小板治疗首选替格瑞洛[3]。而中国最新更新的指南同样建议STEMI患者优选替格瑞洛[4]。替格瑞洛是一类全新结构的可逆性二磷酸腺苷P2Y12受体拮抗剂[5],与氯吡格雷不同,替格瑞洛本身具有生物学活性,因此起效快,早期血小板抑制作用更显著[6,7]。虽然PLATO国际多中心临床研究证实替格瑞洛较氯吡格雷抗血小板抑制效果显著,且不增加血栓事件复发风险和出血风险[8],但受试人群为STEMI入院患者。目前有研究发现替格瑞洛抗血小板优势虽然显著,但易出现呼吸困难、心律失常等不良反应,且治疗成本高[9]。临床中,很多患者会更换氯吡格雷。本研究中,我们剔除氯吡格雷抵抗患者,着重探讨替格瑞洛和氯吡格雷对于非氯吡格雷抵抗ACS患者择期行PCI术后血清炎性介质及内皮细胞功能的影响,为临床个体化治疗提供一定的理论依据。
1 对象与方法
1.1 对象及分组选取2017年5月至2018年12月于宜宾市第一人民医院心内科行择期PCI且无氯吡格雷抵抗的ACS患者110例,男性67例,女性43例,年龄28~78岁(59.74±12.86)岁。纳入标准:①入院后明确诊断为ACS,符合世界卫生组织关于ACS的诊断标准[10];②首次发作ACS,且入院前未接受过其他相关治疗;③经血栓弹力图(TEG)检测二磷酸腺苷(ADP)诱导的血小板抑制率≥30%,即非氯吡格雷抵抗者;④冠状动脉造影(CAG)检查后符合择期行PCI的指征,并成功完成PCI术者;⑤入院后根据Killip心功能分级Ⅱ~Ⅳ级;⑥自愿配合治疗方案及实验室检查项目,且由患者或患者家属签署知情同意书。排除标准:①抗栓抗凝禁忌证或有过敏史者;②严重肝肾功能衰竭、恶性肿瘤、血液系统疾病、心肌梗死机械性并发症、瓣膜病、心肌病、严重肝肾功能衰竭者。本项研究已获得宜宾市第一人民医院伦理委员会的论证和批准。按照随机数字表法,根据PCI术后用药方式,将110例ACS患者分为氯吡格雷组(n=38例)、替格瑞洛组(n=35例)和序贯治疗组(n=37例)。
1.2 治疗方案所以患者择期行PCI术。术前口服负荷剂量硫酸氢氯吡格雷片(杭州赛诺菲制药有限公司;生产批号:J20130083)300 mg+阿司匹林肠溶片(拜耳医药保健有限公司;生产批号:J20130078)300 mg。另外给予肝素和替罗非班(杭州中美华东制药有限公司,生产批号:H20060265),进行CAG,明确梗死相关动脉以管腔狭窄≥75%作为支架置入标准,选择6F指引导管置入药物涂层支架。
氯吡格雷组:PCI术后继续口服氯吡格雷75 mg/d,1/d,维持治疗6个月。替格瑞洛组:PCI术后第1 d口服替格瑞洛(阿斯利康制药有限公司,国药准字J20130020)180 mg负荷剂量后,第2 d起以90 mg/d,2/d,维持治疗6个月。序贯组:PCI术后第1 d口服替格瑞洛180 mg负荷剂量后,第2 d起以90 mg/d,2/d,维持治疗3个月,停药次日口服负荷剂量(300 mg)氯吡格雷,然后口服75 mg氯吡格雷,1/d,持续治疗3个月。另外患者根据个人情况服用他汀类、硝酸酯类、钙离子通道阻滞剂(CCB)、血管紧张素转化酶抑制剂(ACEI)等。
1.3 观察指标
1.3.1 血液样本采集分别于PCI术前、PCI术后2 h、PCI术后3个月、PCI术后6个月采集血液样本,分别置于促凝管和抗凝管中,静置30 min,3500 r/min离心20 min(离心半径13.5 cm),取上清,保存至-80℃备用。
1.3.2 血栓弹力图(TEG)采用TEG分析仪及配套试剂(Haemoscope公司)进行操作,预先制备ADP和AA检测液,在含有高岭土激动剂的试管中加入全血1 ml,充分混匀后,取340 μl加入含有20 μl CaCl2的试杯中,检测曲线的最大振幅MAthrombin。另取两只空试杯,分别加入ADP-P2和ADP-P3检测液,充分混匀后检测MAfibrin和MAADP。MAfibrin表示缺少凝血酶和血小板激活状态下纤维蛋白形成最大的血凝块强度。MAADP表示未被抑制的ADP受体介导的血小板水平。计算血小板抑制率(ADP抑制率)。计算公式为:ADP抑制率= [1-(MAADP-MAfibrin)]/(MAthrombin-MAfibrin)×100%。
1.3.3 各项炎性因子采用双抗体夹心酶联免疫吸附测定(ELISA)试剂盒和Multiskan MK3全自动酶标仪(美国Thermo公司)检测血清中超敏C反应蛋白(hs-CRP)、可溶性CD40配体(soluble CD40 ligand,sCD40L)、P选择素。操作步骤遵守试剂盒说明书。人sCD40L ELISA试剂盒购自德国PromoCell公司;人hs-CRP试剂盒和P选择素试剂盒购自北京Solarbio公司。
1.3.4 内皮细胞功能相关因子检测采用双抗体夹心酶联免疫吸附测定(E L I S A)试剂盒和Multiskan MK3全自动酶标仪(美国Thermo公司)检测血清中可溶性细胞间粘附分子-1(sICAM-1)、内皮细胞特异性分子1(ESM-1)、内皮素-1(ET-1)。采用Griess比色法检测血清一氧化氮(NO)含量。操作步骤遵守试剂盒说明书。人sICAM-1 ELISA试剂盒、人ESM-1 ELISA试剂盒、人ET-1 ELISA试剂盒购自北京方程生物;NO检测分析试剂盒购自美国BioVision公司。
1.4 随访对所有患者随访6个月,观察主要心血管不良事件(MACE)、出血事件药物不良反应发生情况。①MACE:全因死亡、心源性猝死、靶血管再次血运重建、急性心肌梗死。②出血事件:根据心肌梗死溶栓治疗临床试验(TIMI)定义的出血标准,颅内出血或临床可见出现血红蛋白(HGB)下降>5 g/dl则为主要出血;临床可见出血伴HGB下降3~5 g/dl则为次要出血,HGB下降量<30 g/L或牙龈出血、皮下淤青等则为轻微出血。③药物不良反应:呼吸困难、心律失常、消化道不适等。由三位副主任医师以上专家确认。
1.5 统计学处理应用统计学软件SPSS 17.0处理数据。计量资料采用均数±标准差(±s)表示,不同时间点组间均数的比较采用重复测量的方差分析,同时间点组间均数的比较采用单因素方差分析和LSD-t检验,计数资料采用例数(构成比)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 三组患者基础临床资料比较三组患者在首次就诊时的年龄、性别构成、体质指数(BMI)、Killip心功能分级、发病至PCI时间、收缩压、舒张压、心率等一般资料基本一致,无统计学差异(P>0.05),具有可比性。(表1)
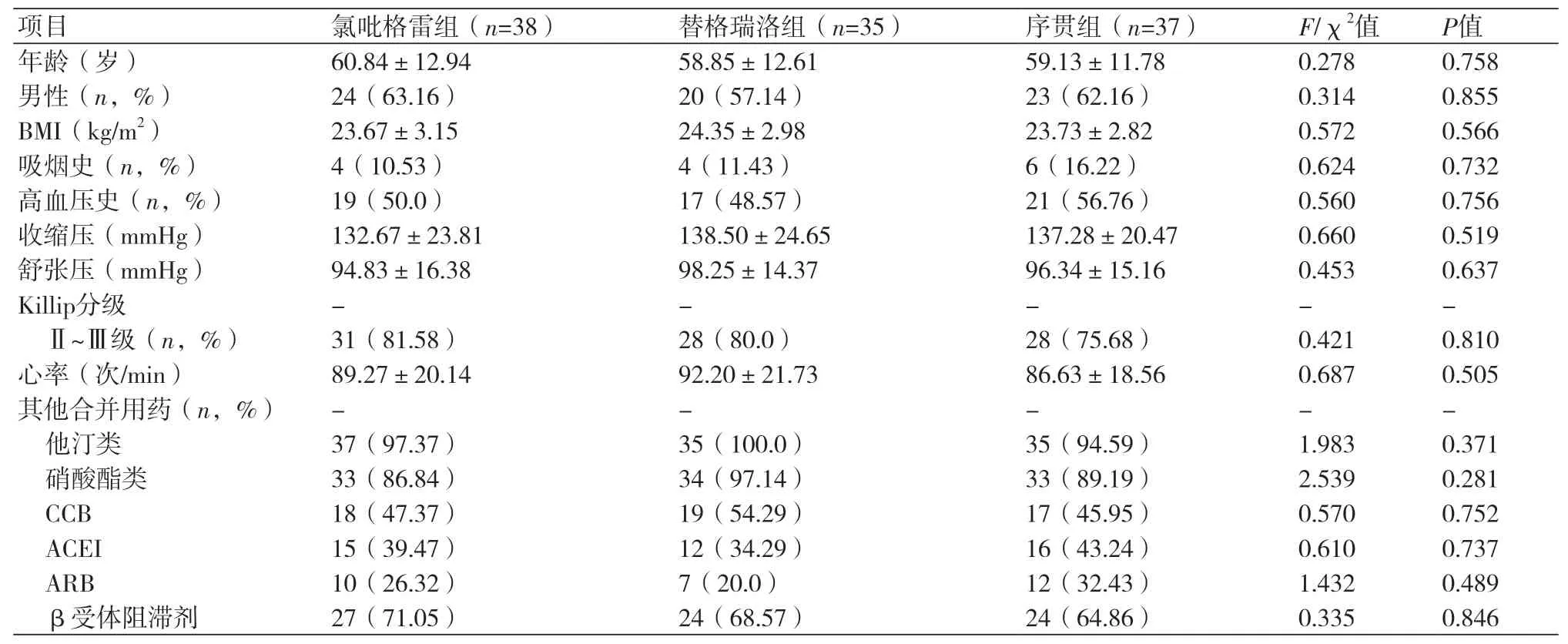
表1 两组患者一般临床资料比较
2.2 三组患者ADP抑制率变化PCI术前和术后2 h三组患者ADP抑制率比较无统计学差异(P>0.05)。PCI术后3个月,替格瑞洛组和序贯组患者ADP抑制率明显高于氯吡格雷组,差异有统计学意义(P<0.05)。PCI术后6个月,替格瑞洛组患者ADP抑制率仍然高于氯吡格雷组,差异有统计学意义(P<0.05);但序贯组患者ADP抑制率虽仍高于氯吡格雷组,但却低于替格瑞洛组,差异有统计学意义(P<0.05)(表2)。
2.3 三组患者血清各项炎性因子变化PCI术前和术后2 h三组患者血清hs-CRP、sCD40L、P选择素水平比较无统计学差异(P>0.05)。PCI术后3个月,替格瑞洛组和序贯组患者血清hs-CRP、sCD40L、P选择素水平明显低于氯吡格雷组,差异有统计学意义(P<0.05)。PCI术后6个月,替格瑞洛组患者血清hs-CRP、sCD40L、P选择素水平仍低于氯吡格雷组,差异有统计学意义(P<0.05);序贯组患者血清hs-CRP、sCD40L、P选择素水平与替格瑞洛组基本一致,无统计学差异(P>0.05)(表3)。
表2 三组患者PCI术前、术后ADP抑制率比较(±s)

表2 三组患者PCI术前、术后ADP抑制率比较(±s)
注:ADP:二磷酸腺苷;PCI:经皮冠状动脉介入术;与同时间点氯吡格雷组数据比较,aP<0.05;与同时间点替格瑞洛组数据比较,bP<0.05
序贯组(n=37)PCI术前 57.68±7.42 58.57±7.59 59.10±8.16 PCI术后2 h 75.59±10.93 76.48±10.75 76.92±12.11 PCI术后3个月62.20±6.19 68.15±5.21a 68.63±5.84a PCI术后6个月63.46±5.83 74.29±5.56a 69.71±6.15ab项目 氯吡格雷组(n=38)替格瑞洛组(n=35)
表3 三组患者PCI术前、术后血清各项炎性因子比较(±s)

表3 三组患者PCI术前、术后血清各项炎性因子比较(±s)
注:PCI:经皮冠状动脉介入术;hs-CRP:超敏C反应蛋白;sCD40L:可溶性CD40配体;与同时间点氯吡格雷组数据比较,aP<0.05
组别 时间点 hs-CRP(mg/L) sCD40L(pg/ml) P选择素(ng/L)氯吡格雷组(n=38) PCI术前 12.88±3.47 427.57±113.62 39.57±17.65 PCI术后2 h 21.65±3.58 798.62±186.74 59.26±20.34 PCI术后3个月 15.32±3.79 564.19±178.45 48.73±15.28 PCI术后6个月 12.73±2.84 389.26±85.18 37.60±12.57替格瑞洛组(n=35) PCI术前 13.45±4.10 435.94±125.76 42.15±19.58 PCI术后2 h 22.11±3.96 811.20±217.48 60.73±21.65 PCI术后3个月 10.20±3.14a 425.67±152.91a 38.69±15.72a PCI术后6个月 7.57±2.85a 237.48±68.54a 32.18±11.87a序贯组(n=37) PCI术前 13.32±3.43 442.38±130.54 41.47±20.53 PCI术后2 h 22.13±3.85 807.64±212.39 61.59±22.14 PCI术后3个月 11.08±3.25a 433.29±164.05a 39.41±14.37a PCI术后6个月 8.16±2.97a 250.50±92.58a 33.28±12.90a
2.4 三组患者血清内皮细胞功能相关因子变化PCI术前和术后2 h三组患者血清sICAM-1、ESM-1、ET-1、NO水平比较无统计学差异(P>0.05)。PCI术后3个月,替格瑞洛组和序贯组患者血清sICAM-1、ESM-1、ET-1水平明显低于氯吡格雷组,而NO水平高于氯吡格雷组,差异有统计学意义(P<0.05)。PCI术后6个月,替格瑞洛组患者血清sICAM-1、ESM-1、ET-1水平仍然低于氯吡格雷组,而NO水平依然高于氯吡格雷组,差异有统计学意义(P<0.05);序贯组患者血清sICAM-1、ESM-1、ET-1、NO水平与替格瑞洛组基本一致,无统计学差异(P>0.05)(表4)。
表4 三组患者PCI术前、术后血清内皮细胞功能相关因子比较(±s)

表4 三组患者PCI术前、术后血清内皮细胞功能相关因子比较(±s)
注:PCI:经皮冠状动脉介入术;sICAM-1:可溶性细胞间粘附分子-1;ESM-1:内皮细胞特异性分子1;ET-1:内皮素-1;与同时间点氯吡格雷组数据比较,aP<0.05
组别 时间点 sICAM-1(μg/L) ESM-1(μg/L) ET-1(pg/ml) NO(μmol/L)氯吡格雷组(n=38)PCI术前 477.85±134.62 1.13±0.19 79.85±27.46 46.65±17.58 PCI术后2 h 745.18±228.35 1.27±0.25 135.63±38.28 47.73±17.97 PCI术后3个月 523.76±168.54 1.17±0.13 92.47±30.51 53.18±12.54 PCI术后6个月 371.82±123.46 1.10±0.12 67.12±18.75 56.55±9.87替格瑞洛组(n=35)PCI术前 465.13±153.28 1.18±0.17 84.67±30.18 44.19±16.35 PCI术后2 h 761.32±247.45 1.30±0.27 128.73±41.26 48.32±17.58 PCI术后3个月 447.86±179.63a 1.05±0.14a 81.32±26.11a 64.27±10.73a PCI术后6个月 285.57±117.31a 1.02±0.15a 54.20±17.65a 71.62±9.15a序贯组(n=37) PCI术前 449.38±158.73 1.15±0.20 82.10±28.64 48.28±15.74 PCI术后2 h 750.49±216.90 1.30±0.22 125.75±37.63 47.57±18.69 PCI术后3个月 432.53±165.28a 1.04±0.11a 80.58±23.20a 64.65±10.48a PCI术后6个月 311.72±98.64a 1.02±0.13a 58.43±15.76a 67.11±7.85a
2.5 三组患者随访期间MACE、出血并发症以及药物相关不良反应发生情况随访期间氯吡格雷组和序贯组各有1例患者全因死亡,另外三组各有1例患者再次靶血管血运重建,氯吡格雷组由1例患者发现急性心肌梗死,三组患者MACE发生率比较,无统计学差异(χ2=0.897,P=0.639)。氯吡格雷组发生1例次要出血事件和2例轻微出血事件,而且总的出血事件发生率高于替格瑞洛组和序贯组,但是并未发现统计学差异(χ2=1.502,P=0.472)。替格瑞洛组有2例患者出现呼吸困难,发生率高于氯吡格雷组和序贯组,同样并未发现统计学差异(χ2=1.364,P=0.502)(表5)。
3 讨论
PCI是目前ACS患者最有效的救治手段之一,但是易造成远端微循环堵塞,影响患者预后,因此P2Y12受体拮抗剂联合阿司匹林双联抗血小板方案已经成为抗血栓治疗的基石[10]。其中氯吡格雷是临床上使用最广泛、最成熟的P2Y12受体拮抗剂,但易受药物代谢酶相关基因多态性、环境因素等影响,抗血小板反应性存在较大的个体差异性,部分患者会发生氯吡格雷抵抗[12]。替格瑞洛属于环戊己三唑嘧啶类可逆性P2Y12受体拮抗剂,经PLATO研究证实,替格瑞洛对ACS患者临床抗血小板作用优于氯吡格雷,且降低了患者死亡率,但是并未增加出血风险。这可能与替格瑞洛的代谢途径有关。与氯吡格雷不同,替格瑞类本身就属于活性物质,不需要经肝药酶激活代谢,因此一方面早期抗血小板聚集作用起效快,作用更显著;另一方面也弥补了氯吡格雷易发生血小板高反应性的缺陷。

表5 三组患者随访6个月MACE、出血事件、不良反应发生情况(n,%)
在本研究中,我们纳入的患者均为非氯吡格雷抵抗的ACS患者,即ADP诱导的血小板聚集抑制率≥30%,这部分患者择期行PCI术,术后口服替格瑞洛3个月和6个月的患者,ADP抑制率明显高于氯吡格雷组。这与PLATO研究结果基本一致。说明替格瑞洛不仅抗血栓作用起效快,而且持续抗血栓作用也较强。虽然在临床试验中,替格瑞洛表现出良好的抗血小板聚集的作用,但是在临床实际中,替格瑞洛价格较高,而且服药频率和时间较长,很多患者难以负担高昂的治疗费用,因此替格瑞洛和氯吡格雷序贯治疗在临床上也较为常见[13]。根据ONSET/OFFSET研究[14]显示,停用替格瑞洛24 h后抗血小板聚集效应相当于氯吡格雷血药浓度稳定期,由于两类药物同属于P2Y12受体拮抗剂,给药方式和作用途径都类似,具有生物学等效性。我院心内科医师对于选择替格瑞洛和氯吡格雷序贯治疗的ACS患者,建议停用替格瑞洛次日先服用负荷剂量(300 mg)氯吡格雷,迅速达到氯吡格雷有效血药浓度,而后以75 mg/d维持治疗。
根据药物代谢动力学数据,中国人群口服替格瑞洛约72 h即可达到稳定血药浓度[15]。但是目前国内市面上销售的替格瑞洛一般一盒是7 d用量,很多学者认为口服替格瑞洛7 d后可更换为氯吡格雷[16,17]。但由于本研究的目的之一是比较氯吡格雷和替格瑞洛对血小板聚集抑制率、炎性因子、血管内皮细胞功能的影响,因此我们设置的序贯组是替格瑞洛用药3个月桥接氯吡格雷用药3个月。本研究结果显示,PCI术后3个月,替格瑞洛组和序贯组患者ADP抑制率明显高于氯吡格雷组;而PCI术后6个月,替格瑞洛组患者ADP抑制率仍然高于氯吡格雷组,但序贯组患者ADP抑制率虽仍高于氯吡格雷组,但却低于替格瑞洛组,说明替格瑞洛持续抗血小板聚集作用高于氯吡格雷。
鉴于抗血小板药物的抗血小板聚集作用与炎症反应、血管内皮细胞功能密切相关[18,19],本研究进一步分析了氯吡格雷、替格瑞洛、以及序贯治疗对ACS患者血清hs-CRP、sCD40L、P选择素等炎性因子和sICAM-1、ESM-1、ET-1、NO等血管内皮功能相关因子的影响。hs-CRP是目前临床上最常使用的非特异性急性期炎症反应因子,而P选择素属于细胞黏附分子家族成员,可特异性反应血小板的活化和释放状态。杨礼等[20]学者证实,血清P-选择素、hs-CRP水平的升高与ACS的发生密切相关,可作为判断ACS患者粥样斑块是否稳定以及观察病情变化的血清学指标之一。另外,CD40L是大量存在于未活化的血小板α颗粒中,一旦血小板被激活,CD40L即转移至血小板表面,胞外段被血浆中的降解酶分离进入循环血,成为sCD40L[21]。通过与内皮细胞相互作用诱导炎性因子、基质金属蛋白酶、白细胞粘附分子的分泌。在本研究中,ACS患者PCI术后2 h血清hs-CRP、sCD40L、P选择素水平已出现异常升高,可能与手术创伤、支架置入等有关。但是随着治疗的进行,替格瑞洛和序贯组患者术后3个月,血清hs-CRP、sCD40L、P选择素水平已经低于入院时水平,而且术后3个月和6个月一直低于氯吡格雷组,说明替格瑞洛治疗3个月后,已经良好地控制了患者炎症反应,虽然序贯组更换药物,但是对炎症因子影响不是很明显了。
另外内皮功能障碍是冠状动脉粥样硬化病变的病理基础,与心血管事件密切相关。Camargo等[22]学者通过临床研究发现,连续嚼服氯吡格雷28 d,并未发现对ACS患者血管内皮功能有显著改善作用。但是在本项研究中,我们发现,PCI术后3个月,氯吡格雷组患者血清sICAM-1、ESM-1、ET-1、NO水平较PCI术后2 h明显降低,尤其是NO水平甚至已经低于入院时水平。因此氯吡格雷对血管内皮功能仍然具有一定的改善作用。sICAM-1是血管内皮特别是微血管内皮损伤重要的标志分子,Gao等[23]研究发现ACS患者血清ESM-1水平将健康志愿者明显增加,推测ESM-1可能是反映内皮细胞病理和功能的一种新型生物标记物。一氧化氮合酶稳定性下降、NO合成量降低是血管内皮功能紊乱的病理基础,内源性NO属于扩血管物质,可抑制血小板聚集和血栓形成。ET-1生物学作用与NO活性相反,两者相互拮抗,可维持血管舒缩平衡。在本研究中,三组患者血清sICAM-1、ESM-1、ET-1、NO等血管内皮功能相关因子的变化规律与炎性因子基本一致,这与炎症反应和血管内皮功能障碍相互关联有关。
综上所述,对于非氯吡格雷抵抗的ACS患者,替格瑞洛和氯吡格雷单药或序贯用药都可以显著改善患者PCI术后血小板反应性、血清炎性因子水平和血管内皮细胞功能紊乱,而且替格瑞洛改善作用更明显[24]。但是序贯组患者PCI术后口服替格瑞洛3个月桥接氯吡格雷治疗3个月后,血清各项炎性因子和血管内皮功能相关因子水平与替格瑞洛组比较未见统计学差异。建议临床患者口服替格瑞洛维持治疗3个月后可更换为氯吡格雷,虽然对血小板聚集抑制作用稍弱于长期使用替格瑞洛,但在抑制炎症反应、维持内皮功能平衡方面与长期使用替格瑞洛的作用基本一致。但是本研究样本纳入量偏少,随访时间较短,而且属于单中心研究,并未在MACE、出血事件、药物相关不良反应方面得出差异性结论。
