KLF9通过增加氧化应激对心肌细胞缺血损伤的影响
2020-12-16袁鹰何平汤祥瑞李炯侠
袁鹰,何平,汤祥瑞,李炯侠
缺血性心脏病时发达国家最常见的疾病之一,也是死亡的主要原因[1]。心肌梗死是由于心肌供血量减少的原因引起的,缺血性心脏病患者发生心力衰竭(心衰)和死亡率的风险明显增加[2]。心肌梗死是一个复杂的过程,过度氧化应激引起的心肌细胞损伤导致心肌梗死的发生[3]。为了维持缺血性心脏病患者的心脏功能和降低心肌梗死的相关风险,迫切需寻找导致心肌梗死的分子机制[4]。人们早期就认识了缺血性心脏病和活性氧增加相关,心肌缺血时,细胞内的ATP降低,导致心力功能障碍和活性氧的过量产生,引起了氧化应激和能力的不足,导致核酸、蛋白质、脂质等关键大分子的损伤[5],从而通过细胞凋亡、坏死等过程加速了心肌细胞的死亡。Kruppel样转录因子9(KLF9)是一种调节氧化应激的转录因子[6]。它参与广泛的神经发育、细胞分化、增殖和凋亡等过程。最近KLF9作为NF-E2相关转录因子2(Nrf2)的下游靶点和氧化应激的调节关系密切[7]。Nrf2是诱导抗氧化的表达的关键因子。此外,研究报道KLF9与黑素瘤的氧化应激关系密切,但与心肌梗死相关调节心肌细胞的损伤尚未研究[8],本研究主要探讨KLF9通过增加氧化应激对心肌细胞缺血损伤的影响。
1 材料和方法
1.1 细胞培养和分组将心肌细胞H9c2分为正常组和缺血组,正常组将心肌细胞H9c2置于37℃的10%胎牛血清的DMEM细胞培养基中,100 U/ml的青霉素和链霉素中培养24 h。缺血组用无血清代替培养基,添加10 μg/ml转铁蛋白和10 μg/ml胰岛素,培养3~4 d,在体外缺血处理中,心肌细胞H9c2暴露于缺血(1%氧,0.1%葡萄糖,无血清)2~24 h,在无血清的DMEM中加入0.45%葡萄糖在常氧下培养。
1.2 材料心肌细胞H9c2购自上海生命科学研究院细胞所;RIPA,DAPI和PMSF、胎牛血清、DMEM细胞培养基购自Takara公司;KLF9 cDNAs在慢病毒表达载体PLV-SV40-puro购自Pierce公司;阴性对照(siRNA)、KLF9(si KLF9#1和si KLF9#2)购自英韦创津公司;PVDF膜购自北京莱宝公司;Mito-tracker红色荧光探针购自美国Sigma公司,LDH细胞毒性试剂盒购自南京建成生物公司。
1.3 细胞转染把KLF9 cDNAs在慢病毒表达载体PLV-SV40-puro转染到心肌细胞中,使用Lipofectamine RNAiMAX(In-vitrogen)按照使用说明将siRNAs转染到心肌细胞中,空向量作为对照组,阴性对照组为KLF9(siKLF9#1和siKLF9#2)。
1.4 Rt-PCR检测KLF9 mRNA水平把心肌细胞H9c2置于液态氮中保存,加入1 ml Trizol试剂,放于玻璃匀浆器中匀浆,组织完全融化,进行RNA提取,加入细胞裂解液100 μl,放置5 min,进行吹打,PBS洗涤3次,再放入EP管中,三组各加入100 μl氯仿,混匀,静置5 min,离心10 000 g,5 min,去上清液,加入1 ml无水乙醇,注入400 μg/ml的外泌体悬液溶液,离心10 min后去上清,各取2 μl RNA为样品,β-actin为内参,KLF9合成引物序列,引物序列上游为5′-G CACCTTTGGTTATGTGGG-3′,下游为5′-CGT TTGGTCTCCTTTTCGTC-3′,β-actin引物序列上游为5′-CGTTATGCCCTGTATTGGTA-3′,下游为5′-CTACTATTGGTGGCCGTTCG-3′,计算缺血2 h、4 h、6 h、12 h、24 h的RNA浓度,并提取RNA进行逆转录聚合酶链反应,PCR 反应条件:在90℃下预变性5 min和在80℃下变性45个循环,持续10 s,在70℃ 20 s,65℃延伸30 s。
1.5 Western blotting检测KLF9蛋白的表达取心肌细胞H9c2放于6孔板中,加入100 μg的胰蛋白酶提取液,在注入2 ml的培养基停止消化,再将细胞提取液放入EP管中,并与胰蛋白酶提取液按照1:100进行混合,再放入冰箱中冷冻10 min,进行裂解,在EP管中放入KLF9抗体并按照1:100比例加入胰蛋白酶提取液2 ml,在加入1:1000的过氧化物酶标记二抗,常温下2 h,在暗室中显影,以β-actin做为内参,采用Quantity One软件评估KLF9蛋白在缺血2 h、4 h、6 h、12 h、24 h表达水平。
1.6 乳酸脱氢酶(LDH)活性测定按照LDH细胞毒性试剂盒测定说明进行操作,收集正常组和缺血组的再灌血清分别放入试管中,加入基质缓冲液200 μl,在加入50 μl的辅酶I混合均匀,水浴10 min,在加入2,4-二硝基苯肼混合均匀,水浴10 min。加入2.5 m1的0.4 mM NaOH溶液混合均匀,放置10 min,450 nm蒸馏水凋零1 cm光径测吸光值,以培养基中LDH活性占细胞总裂解液中LDH活性的比例计算LDH的释放量。
1.7 心肌细胞活力测定心肌细胞悬液1.6×104/ml置于96孔板中,在加入浓度为5 mg/ml的10 μl的MTT溶液,放在培养箱中孵育2 h,温度为37℃,去上清,再加入DMSO 100 μl,混合均匀,酶标仪检测450 nm波长的吸光度值。
1.8 TUNEL检测细胞凋亡4%多聚甲醛固定细胞爬片20 min,按照TUNEL试剂盒检测检测标准检测细胞凋亡情况,阴性对照以PBS缓冲液作为标记,高倍视野下观察爬片的视野情况,计算心肌细胞凋亡的指数=(凋亡阳性细胞数/总细胞数)×100%。
1.9 ROS的测定心肌细胞水平采用DCFH-DA荧光探针进行检测,收集心肌细胞H9c2接种于50 mm培养皿中,加入10%的FBS的α-MEM培养基中培养24 h,在加入药物处理,碳酰氰基对氯苯脘作为阳性对照,使用无血清的α-MEM培养基清洗,在加入30 μmol/L DCFH-DA放在常温孵育60 min,每10 min振荡细胞1次,无血清的α-MEM再次清洗后,消化,染色,流式细胞仪检测,Flowjo软件分析ROS的阳性率。
1.10 统计学方法采用SPSS 22.0软件处理,计数资料采用平均数±标准差(±s)表示,组间数据比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 在缺血心肌细胞中KLF9的mRNA表达采用Rt-PCR检测方法检测KLF9 mRNA在正常组和缺血2 h、4 h、6 h、12 h、24 h的水平,缺血再灌注2 h、4 h、6 h、12 h、24 h,心肌细胞中KLF9的mRNA表达水平较正常组比较明显增加(P<0.05),说明随着缺血再灌注时间的增长,KLF9 mRNA的表达水平越高(表1、图1)。

表1 各组KLF9 mRNA的表达
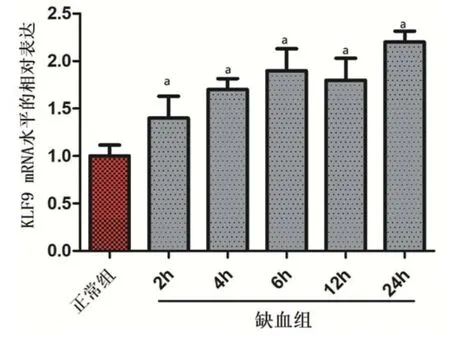
图1 心肌细胞中1KLF9 mRNA水平的相对表达
2.2 在缺血心肌细胞中KLF9蛋白的表达通过Western blotting心肌细胞中KLF9蛋白在正常组和缺血2 h、4 h、6 h、12 h、24 h的水平,心肌细胞中KLF9 蛋白水平较正常组比较明显升高(P<0.05),说明随着缺血再灌注时间的增长,KLF9蛋白水平越高(表2、图2)。

表2 各组KLF9 蛋白的表达

图2 心肌细胞中 KLF9 蛋白的表达
2.3 KLF9对心肌细胞中LDH释放情况的表达采用小干扰RNA(siRNA)降低KLF9在心肌细胞的表达,将两组不同的siRNA(siKLF9#1和siKLF9#2)分别转染到缺血和非缺血的心肌细胞当中,通过Western blotting检测观察对心肌细胞损伤的影响。LDH是心肌损伤的主要标志,缺血组的心肌细胞LDH的释放能力明显高于正常组(P<0.05),在转染siKLF9#1和siKLF9#2后的缺血组LDH的释放能力较siCtrl中的缺血组相比明显减弱(P均<0.05)(表3、图3)。
2.4 KLF9对心肌细胞活力的影响缺血组的心肌细胞活力的明显高于正常组(P<0.05),在转染siKLF9#1和siKLF9#2后的缺血组细胞活力较siCtrl中的缺血组相比明显降低(P均<0.05)(表3、图4)。
2.5 KLF9对心肌细胞凋亡能力的影响缺血组的心肌细胞凋亡能力的明显低于正常组(P<0.05),在转染siKLF9#1和siKLF9#2后的缺血组细胞凋亡能力较siCtrl中的缺血组相比明显降低(P均<0.05)(表3、图5)。
2.6 KLF9下调对缺血心肌细胞ROS的影响缺血组的心肌细胞ROS水平明显低于正常组(P<0.05),在转染siKLF9#1和siKLF9#2后的缺血组细胞ROS水平较siCtrl中的缺血组相比明显降低(P均<0.05)(表4、图6)。

表3 各组细胞LDH释放能力、活力和细胞凋亡能力的表达

图3 心肌细胞LDH释放能力的影响

图4 心肌细胞活力的影响

图5 心肌细胞凋亡能的影响

表4 心肌细胞ROS水平
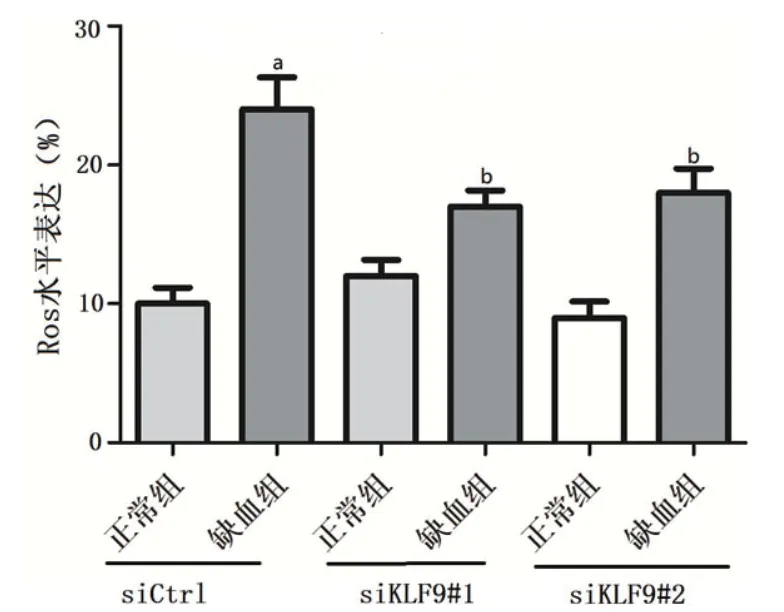
图6 心肌细胞ROS水平
3 讨论
心肌梗死的过程就是ROS的不断生成和升高引起心肌氧化应激,通过细胞的凋亡而引起心肌组织损伤和心肌细胞死亡的过程[9],从而导致心肌缺血损伤加重。在心肌梗死的患者中,一些氧化应激标志物,如C反应蛋白、硫醇和二硫化物会明显增加。此外,有研究报道,在转基因小鼠中,超氧物歧化酶(SOD)过表达,梗死的面积会出现明显的减小[10]。因此,清除活性氧累积的策略一直被认为是缓解氧化应激性心肌缺血损伤最合适的选择[11]。然而,在心肌梗死发病机制中调控ROS水平的分子机制尚未完全阐明。在本研究发现,缺血再灌注2 h、4 h、6 h、12 h、24 h,心肌细胞中KLF9 mRNA的表达水平较正常组比较明显增加,心肌细胞中KLF9蛋白水平较正常组比较明显升高,所以说明转录因子KLF9在缺血条件下的心肌细胞诱导中,KLF9 mRNA的表达和蛋白表达明显被升高,说明KLF9具有促进作用。我们发现缺血大鼠心肌细胞中的KLF9 mRNA水平和蛋白均有不同程度的上调,说明KLF9可能是一种缺血应答的转录因子。有研究报道,KLF9在心肌梗死的患者中出现过表达[12],也有相关研究报道,KLF9缺血的心肌细胞中出现上调现象,所以我们焦虑KLF9参与了心肌梗死的整个过程[13],但目前KLF9是否起到调控作用还尚不明确。有研究报道,KLF9在人体的子宫内膜上皮细胞中,HOXA10明显抑制了KLF9的表达[14]。由于KLF9与Nrf2相互结合,当细胞内ROS超过临界值时,Nrf2可诱导KLF9证明Nrf2的激活可改善氧化应激(大脑、心脏等),减少器官缺血性损伤。
本文研究证明,缺血组的心肌细胞LDH的释放能力明显高于正常组,在转染siKLF9#1和siKLF9#2后的缺血组LDH的释放能力较siCtrl中的缺血组相比明显减弱;缺血组的心肌细胞凋亡能力的明显低于正常组,在转染siKLF9#1和siKLF9#2后的缺血组细胞凋亡能力较siCtrl中的缺血组相比明显降低(P均<0.05);缺血组的心肌细胞ROS水平明显低于正常组,转染siKLF9#1和siKLF9#2后的缺血组细胞ROS水平较siCtrl中的缺血组相比明显降低。LDH是心肌损伤的主要标志,在缺血状态下,LDH的释放能力明显升高,证明心肌损伤能力越大。心肌细胞缺血损伤是通过降低一种重要的抗氧化酶的水平来增加细胞内的ROS水平,因此,我们的研究显示可将KLF9定为心肌梗死发病机制中ROS水平的一种新的阳性调节因子,其可能成为降低心肌ROS累积、减轻氧化应激,加重心肌梗死损伤的潜在治疗靶点。
最近研究中发现,一些KLFs的成员在缺血状态中发挥了很大的作用,如KLF11基因在缺失加重了缺血性脑损伤[15]。此外,KLF2和KLF4可以保护内皮细胞免受缺血性中风诱导细胞凋亡。KLFs还参与了一些心脏活动,KLF13保护了成年心肌细胞免受DNA的损伤和死亡[16]。KLF6、KLF11、KLF6可调节心肌肥厚和纤维化[17]。KLF9可调节药物诱导的多发性骨髓瘤细胞的凋亡,可以控制甲状腺髓样癌中ROS依赖性突变导致的细胞死亡[18]。在本研究中,我们发现KLF9可以促进心肌细胞缺血性损伤,其表现为LDH释放增加,细胞活性降低,细胞凋亡增加。缺血诱导的心肌细胞凋亡时心肌梗死和心力衰竭的重要因素。
综合上述,KLF9可以增加ROS的水平加重心肌细胞缺血性损伤[19],靶向KLF9可能有助于维持心肌细胞的活力,并减少心肌梗死期间心肌细胞的损伤。
