神曲消食口服液对肠道微生态影响的动物研究
2020-12-15艾奎边俊梅李桢
艾奎 边俊梅 李桢

[摘要] 目的 探討神曲消食口服液治疗儿童消化不良的机制。 方法 采用盐酸林可霉素灌胃C57小鼠进行小鼠消化不良造模,灌胃给药“妈咪爱”或神曲消食口服液进行治疗,正常组灌胃等体积的无菌生理盐水。利用16S rDNA高通量测序技术,检测各组小鼠肠道菌群多样性变化。 结果 与空白组相比,模型组小鼠体重显著降低(P<0.05)。高通量测序结果显示,与空白组相比,模型组小鼠肠道微生物多样性指数降低(Shannon指数,P>0.05),在门和属的水平上,肠道微生物多样性均降低。经神曲消食口服液治疗后,小鼠体重明显增加(P<0.05),肠道微生物多样性指数升高(Shannon指数,P>0.05),肠道微生物多样性增加。在门的水平上,硬壁菌门(Firmicutes)丰度增加(P>0.05),变形菌门(Proteobacteria)丰度降低(P>0.05)。在属的水平上,小鼠肠道内益生菌乳酸杆菌属(Lactobacillus)的丰度增加(P>0.05),有害菌巴氏杆菌属(Pasteurella)的丰度显著降低(P<0.05)。 结论 采用神曲消食口服液治疗能增加小鼠肠道菌群多样性,恢复小鼠肠道微生态平衡。神曲消食口服液治疗儿童消化不良可能与肠道乳酸杆菌增加有关。
[关键词] 消化不良;肠道微生物;菌群失调;乳酸杆菌
[中图分类号] R725.7 [文献标识码] A [文章编号] 1673-9701(2020)22-0037-04
Animal study on the effect of Shenqu Xiaoshi oral liquid on intestinal microecology
AI Kui BIAN Junmei LI Zhen
Department of Pediatrics, Wuhan Third Hospital, Wuhan 430074, China
[Abstract] Objective To explore the mechanism of Shenqu Xiaoshi oral liquid in the treatment of pediatric dyspepsia. Methods C57 mice were intragastrically administered with lincomycin hydrochloride for the modeling of dyspepsia. Medilac-vita or Shenqu Xiaoshi oral liquid was intragastrically administered for treatment. The normal group was intragastrically administered with equal volume of sterile saline. 16S rDNA high-throughput sequencing technology was used to detect the diversity changes of intestinal microflora in each group of mice. Results Compared with the blank group, the body weight of mice in the model group was significantly reduced(P<0.05). High-throughput sequencing results showed that the intestinal microbial diversity index in the model group decreased compared with the blank group(Shannon index, P>0.05). At the level of phylum and genus, intestinal microbial diversity decreased. After being treated with Shenqu Xiaoshi oral liquid, the body weight of mice increased significantly(P<0.05), intestinal microbial diversity index increased(Shannon index, P>0.05), and the intestinal microbial diversity increased. At the phylum level, the abundance of Firmicutes increased(P>0.05), and the abundance of Proteobacteria decreased(P>0.05). At the genus level, the abundance of the probiotic Lactobacillus in the intestine of mice increased(P>0.05), and the abundance of harmful bacteria Pasteurella was significantly reduced(P<0.05). Conclusion Shenqu Xiaoshi oral liquid can increase the diversity of intestinal flora in mice and restore the intestinal micro-ecological balance in mice. Shenqu Xiaoshi oral liquid in the treatment of pediatric dyspepsia may be related to the increase of intestinal Lactobacillus.
[Key words] Dyspepsia; Intestinal microflora; Flora disorder; Lactobacillus
功能性消化不良是儿科中普遍存在的一种消化系统疾病,临床上常见的异常症状是胃排空延迟,胃窦动力不足、胃功能紊乱等[1]。神曲消食口服液是一种纯中药制剂,临床研究表明,神曲消食口服液在治疗儿童功能性消化不良、儿童厌食症方面效果良好[2-4],但其具体作用机制目前尚不明确。肠道微生物菌群的平衡失调与各种疾病的发生和发展有关,肠道微生物稳态在机体代谢、抗炎、抗癌、免疫调节等方面起着关键作用[5-7]。其中益生菌是一类有益于机体健康的微生物[8]。本实验采用灌胃盐酸林可霉素制备消化不良模型小鼠,采用灌胃“妈咪爱”和盐酸林可霉素作为阳性对照组,利用肠道微生物16S rDNA测序技术,检测消化不良的小鼠经神曲消食口服液治疗前后肠道微生物种类和数量的变化情况。结果发现,与治疗前相比,治疗后小鼠体重增加,肠道内的微生物多样性显著上升。在属的水平上进行分析,结果显示,益生菌乳酸杆菌属的含量显著上调,这为进一步探讨神曲消食口服液治疗小儿消化不良的机制奠定了基础。
1 资料与方法
1.1 一般资料
4~8周龄[生长期,体重(20±2)g]雄性清洁级C57小鼠24只,购自北京中国医学科学院实验动物研究所[动物许可证编号SCXK(鄂)2015-0018],神曲消食口服液(国药准字Z20153035)由扬子江药业集团有限公司生产,枯草杆菌二联活菌颗粒(“妈咪爱”,国药准字S20020037)由北京韩美药品有限公司生产,盐酸林可霉素(国药准字H41021052)由遂成药业股份有限公司生产,高脂饲料购自北京博泰宏达生物技术有限公司。
1.2 方法
1.2.1 动物分组 24只C57小鼠空白组适应性饲养3 d后随机分成4组,每组6只。分别是空白组(生理盐水灌胃)模型组(生理盐水和盐酸林可霉素灌胃)、阳性对照组(“妈咪爱”和盐酸林可霉素灌胃)和治疗组(神曲消食口服液和盐酸林可霉素灌胃)。
1.2.2 造模 参考Ma Qingjie等[9]的造模方法,所有分组的小鼠采用高脂饲料喂养,A组采用无菌生理盐水灌胃,与此同时B、C、D组均采用盐酸林可霉素连续灌胃6 d,当出现粪便稀释即消化不良模型造模成功。之后C、D组分别同时灌胃“妈咪爱”或神曲消食口服液,每天2次,连续6 d,A、B组灌胃等体积无菌生理盐水,停止治疗后继续观察2 d,实验结束。
1.2.3 给药剂量 “妈咪爱”的剂量为910 mg/kg,神曲消食口服液的剂量为每只每次1.6 mL,盐酸林可霉素的剂量为2 g/kg。
1.2.4 肠道内容物提取 实验结束后,采用颈椎致死法处死小鼠,于超净工作台上无菌采集各小鼠空肠到回肠段内容物,置于无菌、冰盒预冷的离心管中,然后迅速置于-20℃保存备用。
1.2.5 样品预处理 参照文献[10]的处理方法,分别取各组一定量内容物于无菌离心管中进行预处理,备用。
1.2.6 肠道菌群宏基因组的提取 参照文献[10-11]的提取方法进行肠道菌群宏基因组的提取,-20℃保存备用。
1.2.7 16S rDNA高通量测序 采用Miseq测序平台对肠道内容物进行高通量测序,利用overlap将双端数据进行拼接,并进行质控、嵌合体过滤,得到高质量的有效数据。最后进行多样性分析等。
1.3 观察指标
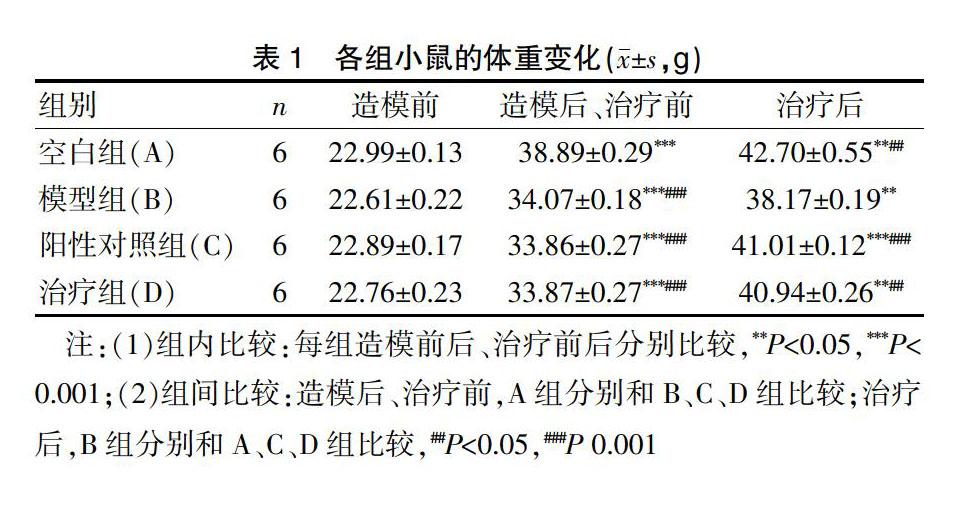
1.3.1 各组小鼠一般情况变化 观察小鼠被毛光泽度、精神状态、食欲、大便性状以及活动等情况变化;称量并记录小鼠体重,分析造模前后和治疗前后(“治疗后”统一指停止治疗并继续观察2 d后,即实验结束后)小鼠体重变化。
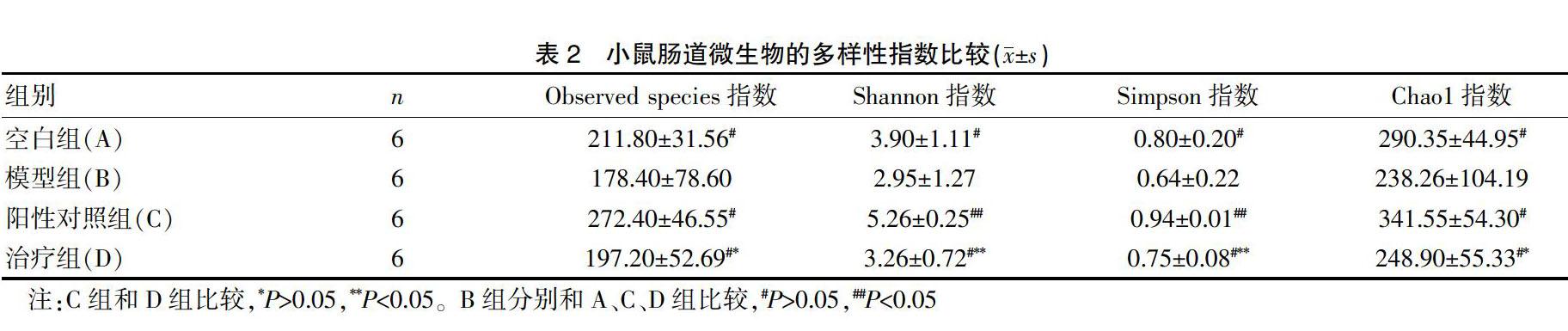
1.3.2 各组小鼠肠道菌群多样性结果 通过Shannon和Simpson指数分析造模前后和治疗前后小鼠肠道微生物多样性变化;通过Chao1和Observed species指数分析造模前后和治疗前后小鼠肠道微生物数目(即丰度)变化。
1.3.3 各组小鼠肠道菌群成分分析 分析治疗前后小鼠肠道菌群成分变化,如门水平硬壁菌门和变形菌门丰度变化,以及属水平乳酸杆菌属和巴氏杆菌属丰度变化。
1.4 统计学方法
1.4.1 統计学分析 计量资料以(x±s)表示。组间显著性差异分析采用单因素ANOVA Turkey检验和t检验,其中P<0.05表示具有差异;P<0.01表示具有显著性差异;P<0.001表示差异极显著。
1.4.2 物种多样性分析 用Observed species, Chao1, Shannon, Simpson四个指数分析肠道中微生物多样性,Shannon指数H'=-。Simpson指数:1-。Chao1指数S1=Sobs+.其中S代表总OTU数目,pi代表样品中属于第i个OTU的序列比例,S1代表估计的总OTU数目,Sobs代表实际测到的总OTU数目,F1代表只含有1条序列的OTU数目,F2代表只含有2条序列的OTU数目。
2 结果
2.1 各组小鼠一般情况变化
造模期间,空白组小鼠被毛密且有光泽,两眼有神,较为活跃,食欲较好,体重逐渐增加,大便呈颗粒状,耳色及尾色淡红。模型组小鼠出现食欲减退,体重减轻,无神,被毛无光泽、疏松并易脱落,拱背,喜扎堆,活动缓慢,部分出现便溏,肛周粪便污染。造模成功后,各组给予对应处置及治疗,阳性对照组和治疗组小鼠上述症状和体征逐渐改善、消失。
表1显示,造模前,与空白组相比,各组小鼠体重均无显著性差异;造模成功后,进行药物治疗前,与空白组相比,模型组小鼠体重显著降低[(38.89±0.29)g vs. (34.07±0.18)g,t=11.6001,P=0.0000];给予药物治疗后,与模型组比较,神曲消食口服液治疗能显著增加小鼠体重[(38.17±0.19)g vs. (40.94±0.26)g,t=3.8272,P=0.0001]。
2.2 各组小鼠肠道菌群多样性结果
Alpha多样性(Alpha_diversity)是指某个特定环境或生态系统内的多样性,主要用来反映物种丰富度和均匀度以及测序深度[12]。选取4个常用的Alpha多样性指数-Shannon、Simpson、Chao1和Observed species进行分析,其中Shannon指数和Simpson指数用来描述物种多样性,二者的数值越高,表明物种多样性越高;Chao1指数和Observed species指数用来描述物种数目,数值越大,微生物种类越多。由表2可知,与空白组相比,模型组小鼠Observed species指数,Chao1指数,Shannon指数和Simpson指数均降低,表明模型组小鼠肠道微生物的丰度和多样性均降低。经灌胃“妈咪爱”或神曲消食口服液后,各项指数值均有所增加,表明小鼠肠道微生物多样性和丰度均有所恢复,其中灌胃“妈咪爱”组小鼠肠道微生物多样性优于空白对照组,灌胃神曲消食口服液组小鼠微生物多样性略低于空白对照组,但优于模型组。
2.3 各组小鼠肠道菌群成分分析
通过16S rDNA高通量测序对小鼠肠道内容物进行检测,结果显示,正常C57小鼠的肠道菌群主要为硬壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)和疣微菌门(Verrucomicrobia)(封三图1显示,blank:空白组;control:阳性对照组;model:模型组;treat:治疗组)。经盐酸林可霉素灌胃后小鼠的肠道菌群结构发生显著变化,在门水平上表现为硬壁菌门丰度和变形菌门丰度增加,拟杆菌门丰度降低,微生物多样性降低。经“妈咪爱”治疗后,硬壁菌门丰度和变形菌门丰度降低,拟杆菌门丰度和疣微菌门丰度增加,同时放线菌属(Actinobacteria)丰度增加,微生物多样性增加。经神曲消食口服液治疗后,硬壁菌门丰度增加(54.59% vs. 78.88%,χ2=48.894,P=0.60),变形菌门丰度降低(41.57% vs. 18.81%,χ2=56.704,P=0.60)。
在屬(genus)水平上对各组小鼠肠道菌群的变化进行分析(封三图2显示,blank:空白组;control:阳性对照组;model:模型组;treat:治疗组),结果显示,与模型组小鼠相比,“妈咪爱”治疗组和神曲消食口服液治疗组小鼠肠道菌群多样性上升。其中神曲消食口服液治疗组小鼠肠道内益生菌乳酸杆菌属(Lactobacillus)丰度增加(41.42% vs. 47.29%,χ2=17.2447,P=0.8117),有害菌属巴氏杆菌属(Pasteurella)的丰度显著降低(29.03% vs. 4.25%,χ2=15.364,P=0.0040)。
3 讨论
多项临床研究表明,神曲消食口服液治疗消化不良疗效良好,但其作用机制目前尚不清楚。胃肠道是宿主免疫系统和微生物之间相互作用的主要场所,胃肠道微生物菌群的紊乱与胃肠道疾病如肠炎、腹泻等密切相关[13]。本研究旨在探讨神曲消食口服液治疗小儿消化不良的疗效与肠道微生物菌群之间的关系,为阐明神曲消食口服液治疗小儿消化不良的机制提供理论依据。
3.1 神曲消食口服液治疗小儿消化不良与肠道菌群多样性有关
肠道菌群的多样性与胃肠道健康密切相关。有研究报道,对猪感染流行性腹泻后的肠道微生物进行分析,结果显示,在门水平上,厚壁菌门,拟杆菌门和变形菌门的数量均显著降低,而梭杆菌门数量显著增加[14]。拟杆菌是动物胃肠道中最常见的微生物之一[15,16]。它们的代谢主要基于食物和黏液糖蛋白的降解,而这些物质在免疫系统调节中起着重要作用[17]。使用抗生素构建的小鼠腹泻模型中肠道菌群稳态被破坏,微生物多样性显著降低[18]。过敏性肠综合征(IBS)患者和健康受试者的粪便微生物组报告的荟萃分析结果显示,乳酸杆菌和双歧杆菌在腹泻型IBS患者中显著下调[19]。Alpha多样性指数即Shannon、Simpson、Chao1和Observed species指数分析结果显示,在门和属的水平上,“妈咪爱”和神曲消食口服液治疗后,小鼠肠道微生物多样性均有所增加,益生菌乳酸杆菌属丰度增加;“妈咪爱”治疗组肠道微生物多样性优于神曲消食口服液治疗组,但优势菌群乳酸杆菌属在神曲消食口服液治疗组丰度最高。因此,神曲消食口服液治疗可能通过恢复肠道微生物的多样性治疗小儿消化不良,上述分析数据为进一步探讨神曲消食口服液治疗小儿消化不良的机制奠定了基础。
3.2 神曲消食口服液治疗小儿消化不良与乳酸杆菌增加有关
乳杆菌属作为肠道菌群的次要成员,虽然数量少,但这些细菌的比例与人类疾病和慢性病症密切相关[20]。Li J等[21]通过肝细胞小鼠模型发现,新型益生菌混合物Prohep可显著减缓肿瘤生长。Ohtsu T等[22]的研究表明,益生菌加氏乳杆菌OLL2716可通过抑制幽门螺杆菌的作用改善幽门螺杆菌相关的消化不良。Muresan IAP等[23]发现罗伊氏乳杆菌与泮托拉唑联合可以根除幽门螺旋杆菌。在肥胖患者中厚壁细菌,尤其是乳杆菌属的比例增加[21]。乳酸杆菌与肥胖密切相关,乳酸杆菌通过参与宿主消化作用,影响宿主体重[24]。有研究显示[25],与未感染幽门螺杆菌的难民儿童相比,感染儿童形体上更加消瘦。Koga Y等[26]发现嗜酸乳杆菌LG21有望通过纠正胃内菌群失调改善功能性消化不良。小鼠体重记录显示,与模型组小鼠相比,神曲消食口服液治疗组小鼠体重增加;16S rDNA高通量测序分析结果显示,与模型组小鼠相比,神曲消食口服液治疗组小鼠肠道益生菌乳酸杆菌数量增加,有害菌巴氏杆菌数量减少。神曲消食口服液治疗可能通过增加乳酸杆菌数量,加速肠道蠕动,促进机体对营养物质的吸收,维护机体健康。
3.3 结语和展望
本研究通过16s rDNA高通量测序技术,分别对空白组、模型组、阳性对照组和神曲消食口服液治疗组小鼠肠道内容物进行检测分析,结果显示,神曲消食口服液治疗增加小鼠肠道菌群多样性,恢复小鼠肠道微生态平衡,维护机体健康。在属的水平上,神曲消食口服液治疗显著增加小鼠肠道内益生菌乳酸杆菌属数量,进而促进肠道蠕动,增加体重,治疗小儿消化不良。肠道微环境是一个复杂而又庞大的系统,需要从更广阔的角度探究神曲消食口服液治疗小儿消化不良的机制。
[参考文献]
[1] Meenakshi G,Samuel N. Functional dyspepsia in children[J].Pediatric Annals,2014,43(4):e101-e105.
[2] 赵继红.神曲消食口服液治疗儿童功能性消化不良的临床研究[J].世界最新医学信息文摘,2018,18(65):123-125.
[3] 李冉,孟宪珍,孙艳红.神曲消食口服液联合推拿疗法治疗小儿厌食脾失健运证的临床疗效[J].西南医科大学学报,2019,42(1):77-80.
[4] 吴晓燕,宋莹莹,成斌.神曲消食口服液配合五维赖氨酸治疗厌食症的疗效观察[J].中医药导报,2017,23(23):107-110.
[5] Liao X,Song L,Zeng B,et al.Alteration of gut microbiota induced by DPP-4i treatment improves glucose homeostasis[J].EBio Medicine,2019,44:665-674.
[6] Vaiserman AM,Koliada AK,Marotta F.Gut microbiota:A player in aging and a target for anti-aging intervention[J].Ageing Research Reviews,2017,35:36-45.
[7] Kang C,Wang B,Kaliannan K,et al.Gut microbiota mediates the protective effects of dietary capsaicin against chronic low-grade inflammation and associated obesity induced by high-fat diet[J].MBio,2017,8(3):e00470-477.
[8] Gupta S,Fekaninová A,Lokesh J,et al.Lactobacillus dominate in the intestine of Atlantic salmon fed dietary probiotics[J].Frontiers in Microbiology,2019,9:3247.
[9] Ma Qiongjie,Ding Jie,Zhao Hai,et al. Effects of egg white polypeptides immunized by Rotavirus on the constitution of dyspepsia mice et al[J]. Journal of Anhui Agri Sci,2013,41(34):13250-13252.
[10] Zhang QL,Peng XX,Wu H,et al. Molecular diversity of intestinal microbiota in dysbacteria diarrheal mice associated with ultra-micro qiweibaizhudan[J].Int J Curr Microbiol Appl Sci,2014,3(2):198-207.
[11] 吳海,周赛男,郭纯,等.一种基于 PCR 分析多样性的小鼠肠道微生物宏基因组提取方法[J].中国微生态学杂志,2012,24(7):648-651.
[12] Caporaso JG,Lauber CL,Walters WA,et al.Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J].The ISME Journal,2012,6(8):1621.
[13] Round JL,Mazmanian SK.The gut microbiota shapes intestinal immune responses during health and disease[J].Nature Reviews Immunology,2009,9(5):313.
[14] Liu S,Zhao L,Zhai Z,et al.Porcine epidemic diarrhea virus infection induced the unbalance of gut microbiota in piglets[J].Current Microbiology,2015,71(6):643-649.
[15] Thomas F,Hehemann J,Rebuffet E,et al.Environmental and gut Bacteroidetes:The food connection[J]. Front Microbiol,2011,2:1-16.
[16] Gibiino G,Lopetuso LR,Scaldaferri F,et al. Exploring bacteroidetes:Metabolic key points and immunological tricks of our gut commensals[J].Dig Liver Dis,2018,50, 635-639.
[17] Laville E.Investigating host microbiota relationships through functional metagenomics[J]. Front Microbiol,2019, 10:1286.
[18] 郭抗蕭,尹抗抗,王欢,等.抗生素对小鼠菌群失调腹泻肠道菌群多样性的影响[J].中国微生态学杂志,2014, 26(3):249-252.
[19] Liu HN,Wu H,Chen YZ,et al.Altered molecular signature of intestinal microbiota in irritable bowel syndrome patients compared with healthy controls:A systematic review and meta-analysis[J].Digestive and Liver Disease,2017,49(4):331-337.
[20] Heeney DD,Gareau MG,Marco ML.Intestinal lactobacillus in health and disease,a driver or just along for the ride?[J].Current Opinion in Biotechnology,2018,49:140-147.
[21] Li J,Sung CYJ,Lee N,et al.Probiotics modulated gut microbiota suppresses hepatocellular carcinoma growth in mice[J].Proceedings of the National Academy of Sciences,2016,113(9):E1306-E1315.
[22] Ohtsu T,Takagi A,Uemura N,et al.The ameliorating effect of Lactobacillus gasseri OLL2716 on functional dyspepsia in Helicobacter pylori-uninfected individuals:A randomized controlled study[J].Digestion,2017,96(2):92-102.
[23] Muresan IAP,Pop LL,Dumitrascu DL.Lactobacillus reuteri versus triple therapy for the eradication of Helicobacter pylori in functional dyspepsia[J]. Med Pharm Rep,2019, 92(4):352-355.
[24] Drissi F,Raoult D,Merhej V.Metabolic role of lactobacilli in weight modification in humans and animals[J].Microbial Pathogenesis,2017,106:182-194.
[25] Benson J,Rahim RA,Agrawal R.Newly arrived refugee children with Helicobacter pylori are thinner than their non-infected counterparts[J].Australian Journal of Primary Health,2017,23(1):92-96.
[26] Koga Y,Ohtsu T,Kimura K,et al.Gasseri strain (LG21) for the upper gastrointestinal tract acting through improvement of indigenous microbiota[J]. BMJ Open Gastroenterol,2019,6(1):e000314.
(收稿日期:2020-03-13)
