高考热点之压强平衡常数与多重平衡规则
2020-12-15山东刘树领正高级教师
◇ 山东 刘树领(正高级教师)
在突出化学核心素养教学的大潮下,对知识的理解不再停留在知道或了解层面上,而是对知识的来龙去脉、知识之间的内在联系以及实际应用进行适当的挖掘与拓展,来拓宽学生知识学习的思维角度与深度,从而提高深度学习的能力,即善于发现问题并能解决问题的能力以及良好的思维习惯及学习态度.压强平衡常数与多重平衡规则尽管在教材中没有显性出现,但在近年来的化学反应原理综合大题中经常涉及压强平衡常数的计算、多重平衡规则的灵活应用等问题,较好地体现了变化观念与平衡思想、证据推理与模型认知等化学核心素养.
1 压强平衡常数与多重平衡规则的导出
1.1 压强平衡常数Kp
1)压强平衡常数的引入及影响因素
在高中教材中出现的平衡常数从形式上看,应该称为浓度平衡常数,如可逆反应


2)分压与物质的量分数(体积分数)、总压之间的关系
平衡体系的总压是各组分的分压之和,故体系中的气体总物质的量为各气体的物质的量之和,根据气体方程pV=nRT,可知

1.2 多重平衡规则
1)源自化学平衡常数表达式的习题深化
为深刻理解平衡常数表达式,学生必须完全依据所给方程式进行书写,鲁科版化学反应原理模块“化学平衡常数”中出现了一组写出N2(g)+3H2(g)⇌的平衡常数表达式的练习.在此基础上还可得出前一个反应的平衡常数是后一个反应平衡常数的平方,同时还可继续升华,认为前式反应是两个后式反应的加和,进而可归纳推得多重平衡规则,即两个方程式相加时,平衡常数是相乘关系;两个方程式相减时,平衡常数是相除关系.
2)源自于盐类水解的实质
在为了深刻理解盐类水解规律“有弱才水解,无弱不水解;越弱越水解,谁强显谁性,同强显中性”时,鲁科版化学反应原理模块以强碱弱酸盐NaA溶液为例,水解方程式为A-+H2O⇌HA+OH-,得出了水解常数与电离常数、水的离子积之间的关系

在此基础上,还可从水解的过程角度分析,即H2O⇌H++OH-(平衡常数为Kw)、H++A-⇌HA(平衡常数为)两个方程式进行加和即得上述水解方程式,其平衡常数即为原来两个方程式的平衡常数乘积,由此可归纳总结出多重平衡规则内容.
2 典题例析
2.1 压强平衡常数的计算
例1(2020年全国卷Ⅰ,节选)硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化ΔH=-98kJ·mol-1.回答下列问题:
将组成(物质的量分数)为2m%SO2(g)、m%O2(g)和q%N2(g)的气体通入反应器,在温度t、压强p条件下进行反应.平衡时,若SO2转化率为α,则SO3压强为________,平衡常数Kp=________(以分压表示,分压=总压×物质的量分数).
解析
本题是涉及字母型数据的关于压强化学平衡常数计算类题目,计算过程比较繁杂,导致成为难点.但只要根据恒压条件下总压不变,巧妙假设、细心求算出各组分的分压,便可进一步求出平衡常数.
假设原气体的物质的量为100mol,则SO2、O2和N2的物质的量分别为2mmol、mmol和qmol,2mmol+mmol+qmol=3mmol+qmol=100 mol,SO2的平衡转化率为α,则有下列关系:

平衡时气体的总物质的量为

则SO3的物质的量分数为


该反应在恒压容器中进行,因此,SO3的分压在该条件下,

例2(2020年全国卷Ⅱ,节选)天然气的主要成分为CH4,一般还含有C2H6等烃类,是重要的燃料和化工原料.
乙烷在一定条件可发生如下反应:C2H6(g)=C2H4(g)+H2(g) ΔH,相关物质的燃烧热数据如表1所示.

表1
容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α.反应的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
解析
已知乙烷的转化率,设起始时加入的乙烷和氢气各为1mol,列出三段式,求出平衡时各物质的分压,代入平衡常数的计算公式进行计算.例如设起始时加入的乙烷和氢气各为1mol.

平衡时,C2H6、C2H4和 H2平衡分压分别为,则反应的平衡常数

由上述两例可知,压强平衡常数的计算模型与浓度平衡常数的计算类似,仍是根据题中已知信息,按照三段式格式找出起始量、变化量、平衡量的关系,然后计算出平衡时各组分的物质的量分数(或体积分数),再根据平衡时的总压计算出各组分的分压,最后代入压强平衡常数表达式进行计算即可.若平衡时压强不知,则需要利用起始压强及气体方程pV=nRT计算出平衡时的压强.
2.2 多重平衡规则的妙用
例3(2019年全国卷Ⅰ,节选)水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中.回答下列问题:
(1)Shibata曾做过下列实验:① 使纯H2缓慢地通过处于721℃下的过量氧化钴CoO(s),氧化钴部分被还原为金属钴(Co),平衡后气体中H2的物质的量分数为0.0250.② 在同一温度下用CO还原CoO(s),平衡后气体中CO的物质的量分数为0.0192.
根据上述实验结果判断,还原CoO(s)为Co(s)的倾向是CO________H2(填“大于”或“小于”).
(2)721℃时,在密闭容器中将等物质的量的CO(g)和H2O(g)混合,采用适当的催化剂进行反应,则平衡时体系中H2的物质的量分数为________(填标号).
A.小于0.25 B.0.25 C.0.25到0.50之间
D.0.50 E.大于0.50
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图1所示,其中吸附在金催化剂表面上的物种用∗标注.

图1
可知水煤气变换的ΔH________0(填“大于”“等于”或“小于”).
(4)Shoichi研究了467℃、489℃时水煤气变换中CO和H2的分压随时间变化关系(如图2所示),催化剂为氧化铁,实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等.
467℃时p(H2)和p(CO)随时间变化关系的曲线分别是______、______.489 ℃ 时p(H2)和p(CO)随时间变化关系的曲线分别是______、_____.

图2
解析
本题属于连贯性综合题目,考查化学反应原理的基本应用,注重学生学科能力的培养.
(1)H2还原氧化钴的方程式为

CO还原氧化钴的方程式为

由“平衡后气体中H2的物质的量分数为0.0250”“平衡后气体中CO的物质的量分数为0.0192”可知平衡后剩余H2的物质的量分数高于CO,故还原CoO(s)为Co(s)的倾向是CO大于H2.因两个方程式书写相似,故也可以从平衡常数大小角度分析,第一个式子的平衡常数(或压强平衡常数,下同),第2个式子的平衡常数,故还原CoO(s)为Co(s)的倾向是CO大于H2.
(2)721℃时,CO(g)+H2O(g)⇌CO2(g)+H2(g)可看作CO(g)+CoO(s)⇌Co(s)+CO2(g)减去H2(g)+CoO(s)⇌Co(s)+H2O(g)所得,利用多重规则得其平衡常数
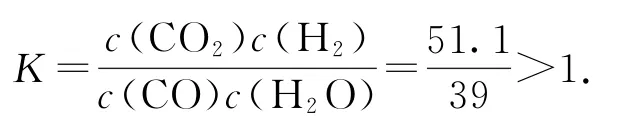
故在密闭容器中将等物质的量的CO(g)和H2O(g)混合,达到平衡时,则


(3)根据水煤气变换反应[CO(g)+H2O(g)=CO2(g)+H2(g)]并结合水煤气变换的反应历程相对能量可知,CO(g)+H2O(g)的能量(-0.32eV)高于CO2(g)+H2(g)的能量(-0.83eV),故水煤气变换的ΔH小于0.
(4)因反应正向进行放热,467℃、489℃均大于721℃时的平衡常数,均大于1,又因“实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等”,故反应达到平衡后,剩余H2的压强必然大于剩余CO的压强,故根据平衡时a、b、c、d对应的压强大小可知,a、b表示不同温度下H2的压强变化曲线,c、d表示不同温度下CO的压强变化曲线,又因467℃时的平衡常数大于489℃时的平衡常数,故a、b依次表示489℃、467℃下H2的压强变化曲线,c、d依次表示467℃、489℃下CO的压强变化曲线.还可以根据温度越高达到平衡所用时间越短可知,467℃时p(H2)和p(CO)随时间变化关系的曲线分别是b、c;489℃时p(H2)和p(CO)随时间变化关系的曲线分别是a、d,只不过是467℃下是反应通过正向达到平衡的,489℃下是反应通过逆向达到平衡的.
例4常温下,控制条件改变0.1mol·L-1二元弱酸 H2C2O4溶液的pH,溶液中的 H2C2O4、HC2O-4、C2O2-4的物质的量分数δ(X)随pOH的变化如图3所示.已知pOH=-lgc(OH-),

下列叙述错误的是( ).

图3
B.若升高温度,a点移动趋势向右

D.物质的量浓度均为0.1mol·L-1的Na2C2O4、NaHC2O4混合溶液中:c(Na+)>c(C2O2-4)>c(HC2O-4)>c(H+)>c(OH-)
解析

所以

选项C正确;因曲线a点对应的溶液呈酸性,故的电离程度大于其水解程度,所以物质的量浓度均为0.1mol·L-1的 Na2C2O4、NaHC2O4混合溶液呈酸性,混合溶液中离子浓度大小关系为

选项D正确.答案为B.
例5常温下,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9.向20mL0.1mol·L-1BaCl2溶液中滴入0.1mol·L-1的Na2SO4溶液,溶液中pBa2+[pBa2+=-lgc(Ba2+)]与Na2SO4溶液体积的关系如图4所示.下列叙述错误的是( ).

图4
A.图象中,n=1,m=5
B.若起始时c(BaCl2)=0.2mol·L-1,m不变,b点向d点移动
C.若用同浓度的Na2CO3溶液替代Na2SO4溶液,可使b点向c点移动
D.V0时,再向混合溶液中滴加Na2CO3溶液,产生BaCO3沉淀的条件是
解析
根据图象曲线起点从n开始,故n=pBa2+=-lgc(Ba2+)=-lg0.1=1,由图象知b点对应的是恰好完全反应,故

选项A正确;因m对应恰好完全反应,故m不受反应物的起始浓度影响,若起始时c(BaCl2)=0.2mol·L-1,则会导致加入Na2SO4溶液的体积增大,因此b点向右移动,选项B错误;因Ksp(BaSO4)<Ksp(BaCO3),故恰好完全反应生成BaCO3时,Ba2+浓度变大,pBa2+值小,当用等浓度的Na2CO3溶液替代Na2SO4溶液时,其消耗的碳酸钠溶液体积是相同的,因此b点应竖直向下迁移,选项C错误;V0时,再向混合溶液中滴加Na2CO3溶液时,存在


因此产生BaCO3沉淀的条件是,选项D正确.答案为B、C.
通过上述三例可知,运用多重平衡规则能够使解题思路更清晰、计算更简单,同时在电解质溶液的图象中,其突破口常常是从曲线的始点、交点、恰好反应点等特殊点来寻找等量、比值等关系.
综上所述,命题对于压强平衡常数的考查是显性的,对于多重平衡规则的考查则是隐性的,因而研究教材、深挖教材隐含的知识衍生点,是科学备考、提升能力的基础与根本.
