酸碱中和滴定曲线分析及溶液中粒子浓度大小的比较难点剖析
2020-12-15山西张建东
◇ 山西 张建东
酸碱中和滴定反应曲线分析及反应过程中溶液所含粒子浓度大小的比较是高考化学的必考题型之一,试题以酸碱中和反应、电离平衡、盐类水解等为素材,考查变化观念与平衡思想、证据推理与模型认知等核心素养.近年来高考对该题型的考查有以下特点:1)与图象结合,并且图象中常涉及多条曲线.2)定性分析与定量计算相结合,涉及化学反应产物的判断、物质的浓度化学平衡常数的计算等.解题步骤为:先分析反应过程,确定图象上特定点的溶质成分,再运用电荷守恒、物料守恒、质子守恒等原理确定溶液中粒子浓度间的关系.常见难点及解题策略如下:
1)等物质的量的CH3COONa和CH3COOH存在于同一溶液中,判断溶液的酸碱性要抓主要矛盾及矛盾的主要方面.
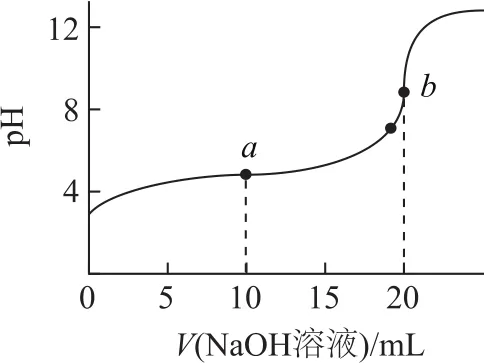
图1
例125℃时,将0.1mol·L-1NaOH溶液加入20mL0.1 mol·L-1CH3COOH溶液中,所加入溶液体积(V)和混合液的pH关系曲线如图1所示.下列结论正确的是( ).
A.pH=7时,c(CH3COO-)+c(CH3COOH)=c(Na+)
B.a点所示的溶液中c(CH3COOH)>c(CH3COO-)
C.b点所示的溶液中c(CH3COOH)+c(H+)=c(OH-)
D.a、b两点所示的溶液中水的电离程度相同
解析
pH=7时,c(H+)=c(OH-),此时溶液中电荷守恒,即
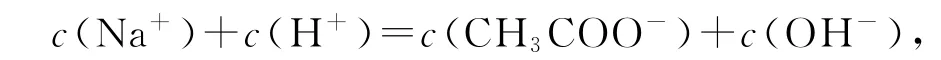
得c(Na+)=c(CH3COO-),所以
c(CH3COO-)+c(CH3COOH)>c(Na+),选项A错误.a点溶质为CH3COONa和CH3COOH,且物质的量的比为1∶1,存在CH3COOH的电离和CH3COO-的水解:

由图可知pH=4时,溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度(CH3COOH的减少量大于增加量,CH3COO-的增加量大于减少量),所以c(CH3COOH)<c(CH3COO-),选项B错误.b点溶质为 CH3COONa,质子守恒式为c(CH3COOH)+c(H+)=c(OH-),选项 C正确.a点溶液显酸性,说明溶液中起主导作用的是CH3COOH对水电离的抑制,继续加入NaOH溶液到b点,b点溶液为CH3COONa溶液,CH3COO-的水解促进了水的电离,所以,a、b两点所示的溶液中水的电离程度不同,选项D错误.答案为C.
点评
比较c(CH3COOH)和c(CH3COO-)的相对大小,主要看CH3COOH电离程度和CH3COO-水解程度的相对大小,溶液的pH<7说明CH3COOH电离起主导作用;比较a、b两点所示的溶液中水的电离程度,a点CH3COOH对水电离的抑制起主导作用,b点CH3COO-对水电离的促进起主导作用.所以,抓主要矛盾及矛盾的主要方面,能确定事物发展的方向.
2)二元弱酸的两步电离,一般情况中存在特殊情况,用证据推理来验证假设.
例2(2020年全国卷Ⅰ)以酚酞为指示剂,用0.1000mol·L-1的NaOH溶液滴定20.00mL未知浓度的二元酸H2A溶液.溶液中,pH、分布系数δ随滴加NaOH溶液体积V(NaOH)的变化关系如图2所示.下列叙述正确的是( )[A2-的分布系数:.
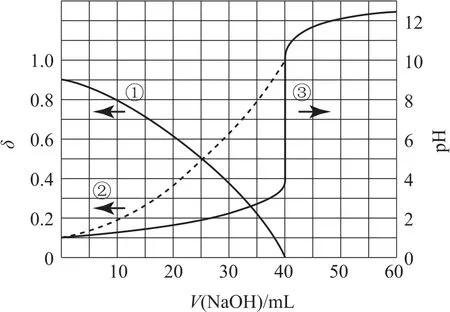
图2
A.曲线①代表δ(H2A),曲线②代表δ(HA-)
B.H2A溶液的浓度为0.2000mol·L-1
C.HA-的电离常数Ka=1.0×10-2
D.滴定终点时,溶液中
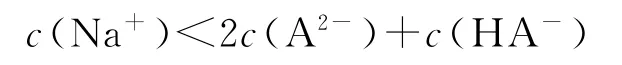
解析
由图可知,曲线①、②代表分布系数δ与V(NaOH)的关系图;曲线③代表pH与V(NaOH)的关系图.当V(NaOH)=40mL时,溶液的pH发生突跃,说明达到滴定终点,根据反应

选项B错误;当V(NaOH)=40mL时,曲线②代表的粒子的分布系数δ达到最大值(接近1),恰好完全反应时,包含A的粒子中,A2-最多,说明曲线②代表δ(A2-);由曲线③可知,当V(NaOH)=0时,H2A溶液pH为1,c(H+)=0.1mol·L-1,假设曲线①代表δ(H2A),其数值为0.9,H2A的电离度为0.1,计算得电离出的c(H+)=0.01mol·L-1<0.1mol·L-1,与题给信息不符,所以假设错误,曲线①代表δ(HA-),选项 A 错误;由图可知,当V(NaOH)=0时,δ(HA-)=0.9,δ(A2-)=0.1,此时溶液的pH=1,溶液中,c(H+)=c(H2A)=0.1mol·L-1,说明此时溶液中不存在H2A,所以,H2A第一步完全电离,因为HA-、A2-共同存在于同一溶液中,所以,第二步部分电离.则HA-的电离平衡常数
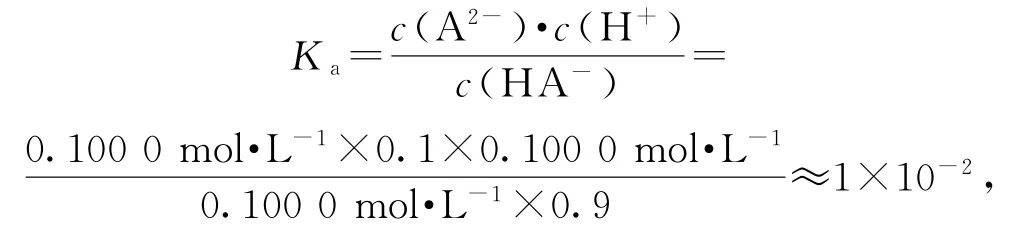
选项C正确;用酚酞作指示剂,酚酞变色的pH范围为8.2~10,终点时溶液呈碱性,c(OH-)>c(H+),溶液中的电荷守恒为

则c(Na+)>2c(A2-)+c(HA-),选项D错误.答案为C.
点评
①关于H2A的电离也可以这样判断:当V(NaOH)=0时,曲线①、②的分布系数之和为1,说明溶液中包含A的粒子只有2种,说明H2A第一步完全电离,第二步部分电离,我们常见的二元弱酸(例如H2CO3、H2S等)的两步电离均为部分电离,而本题中的H2A则不同,这就说明一般情况中存在特殊情况,我们要用证据推理来验证假设.
② 关于Ka的计算还有第二种方法:根据图象,当V(NaOH)=25mL 时,δ(HA-)=δ(A2-),c此时的c(H+)计算依据为V(NaOH)=25mL时对应的pH曲线上的值,得到Ka=c(H+)=1.0×10-2.(易错提醒:pH曲线上,pH=5时对应的V(NaOH)=40mL)两种方法均可计算Ka,比较而言,方法1(见解析)更容易理解弱酸的电离过程,方法2更好计算.方法2中,V(NaOH)=25mL时,发生的反应为HA-+OH-=A2-+H2O,还存在 HA-⇌H++A2-、A2-+H2O⇌HA-+H+,同时存在于一个反应体系中,溶液中c(A2-)、c(HA-)、c(H+)即为 HA-电离平衡体系中平衡时的浓度.
3)pH相同的溶液中,水的电离程度是否相等.抓本质、析变量,用证据推理判断.
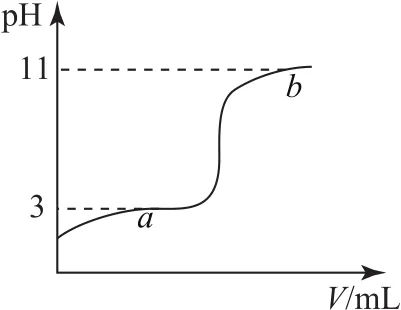
图3
例325℃时,向10mL 0.10mol·L-1的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10mol·L-1NaOH 溶液,溶液pH随加入NaOH溶液体积的变化关系如图3所示.下列说法正确的是( ).
A.a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B.溶液在a点和b点时水的电离程度相同
C.b点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D.V=10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
解析
HA+NaOH=NaA+H2O,a点的溶质为HA、NaA.pH=3时,

a点电荷守恒:c(A-)+c(OH-)=c(Na+)+c(H+),可知c(HA)+c(OH-)=c(Na+)+c(H+),选项A正确.a点溶质为HA和NaA,溶液中OH-全部来自水的电离,

b点溶质为NaOH和NaA,溶液中H+全部来自水的电离,H2O⇌H++OH-,A-+H2O⇌HA+OH-,H2O电离出的H+中的一部分会与A-结合存在于HA中.溶液pH=11,溶液中剩余的c(H+)=1.0×10-11mol·L-1,H2O电离出的 H+:c水(H+)>1.0×10-11mol·L-1,任何水溶液中c水(H+)=c水(OH-),所以溶液在a点和b点时水的电离程度不相同,选项B错误.b点溶质为NaOH和NaA,电荷守恒:
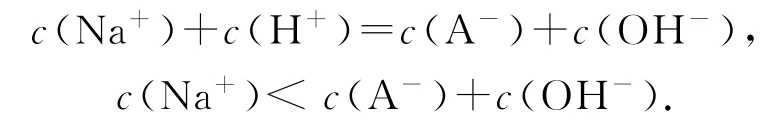
显然,c(Na+)<c(HA)+c(A-)+c(OH-),选项C错误.V=10mL时,HA与NaOH恰好完全反应生成NaA,存在水解反应:A-+H2O⇌HA+OH-,水的电离:H2O⇌H++OH-,水解后溶液显碱性,所以,离子浓度大小为:c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),选项D错误.
点评
①选项C的另一种解法如下:b点溶质为NaOH和NaA,电荷守恒:c(Na+)+c(H+)=c(A-)+c(OH-),假设选项 C正确,将c(Na+)=c(HA)+c(A-)+c(OH-)代入上式中,得c(HA)+c(H+)=0,与客观事实不符,所以,选项C错误.②本题中a,b两点的pH之和为14,a,b两点溶液中水的电离程度并不相等,关键要区分由水电离出的总的离子及溶液中现存的来自水电离的离子,这也说明了一般情况中存在特殊情况.
4)滴定反应过程中溶质在不断变化,要用运动变化的观点分析问题,分析反应原理、物质变化(哪些物质发生了变化,变化的量为多少)、曲线变化(点、斜率、线段的长短),通过分析、计算得出结论.
例如,通过分析25℃时将NaOH溶液滴入CH3COOH溶液反应过程,可确定曲线的不同阶段溶质成分,为分析溶液中的粒子浓度关系提供依据,如表1所示.

表1
例4(2019年全国卷Ⅰ)用NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10-3,Ka2=3.9×10-6)溶液,混合溶液的相对导电能力变化曲线如图4所示,其中b点为反应终点.下列叙述错误的是( ).
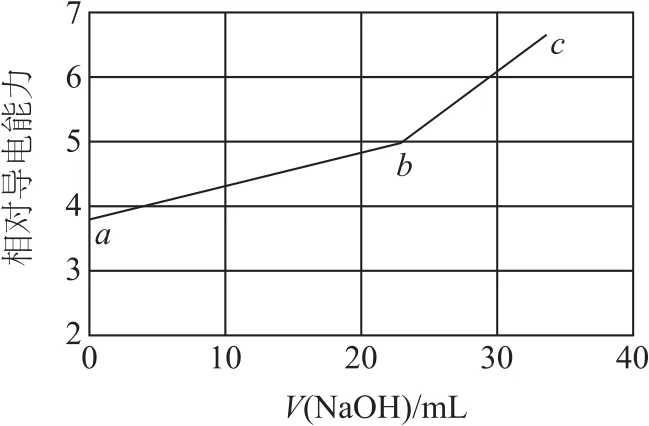
图4
A.混合溶液的导电能力与离子浓度和种类有关
B.Na+与A2-的导电能力之和大于HA-的
C.b点的混合溶液pH=7
D.c点的混合溶液中,c(Na+)>c(K+)>c(OH-)
解析
混合溶液的导电能力与离子浓度及离子所带的电荷数有关,选项A正确.由图可知,b点时二者恰好完全反应,2KHA+2NaOH=Na2A+K2A+2H2O,为便于理解,可设a点的成分为2mol KHA,b点的成分为1molNa2A和1molK2A,b点溶液的导电能力大于a点,所以,Na+与A2-的导电能力之和大于HA-的,选项B正确.A2-为弱酸根离子,易发生水解,使得b点的混合溶液显碱性,pH>7,选项 C错误.c点溶液的成分为 Na2A、K2A、NaOH,且n(Na2A)=n(K2A),所以c(Na+)>c(K+);由图可知,bc段消耗V(NaOH)小于ab段,所以,c(K+)>c(OH-),选项D正确.答案为C.
点评
① 类比思维.邻苯二甲酸H2A为二元弱酸,类比H2CO3,NaHCO3+NaOH=Na2CO3+H2O;② 运动变化思想.物质变化:a→bKHA与NaOH反应,b点恰好完全反应;b→cNaOH过量;曲线变化:ab段斜率小于bc段,说明bc段导电能力增大程度大;比长短:线段ab>bc,说明ab段消耗n(NaOH)多,可知c(K+)>c(OH-).
5)以已有熟悉知识为生长点,将复杂变量转化为熟悉的简单变量分析其变化趋势.
例5(2017年全国卷Ⅰ)常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图5.下列叙述错误的是( ).
A.Ka2(H2X)的数量级为10-6
B.曲线N表示pH与的变化关系
C.NaHX溶液中c(H+)>c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)

图5
解析

又因为函数y=lgx为增函数,所以,当c(H+)相等(pH相等)时所以,曲线M、N分别表示pH与的变化关系,选项B正确.在曲线M上取点(0,5.4),,则
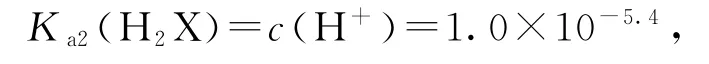
可知Ka2(H2X)的数量级为10-6,选项A正确.曲线M上(0,5.4)点,c(HX-)=c(X2-),此时溶液显酸性,可知HX-电离程度大于X2-水解程度,则NaHX溶液呈酸性,溶液中c(H+)>c(OH-),选项C正确.曲线M上当溶液的,所以,c(X2-)>c(HX-),选项D错误.答案为D.
点评
用运动变化的观点比较离子浓度大小:当c(HX-)=c(X2-)时,溶液显酸性,若要使溶液显中性,就需要加 NaOH,发生反应 HX-+OH-=X2-+H2O,使得c(HX-)<c(X2-).
以科学素养为主要考查目标的试题重在考查学生思维的全面性、灵活性、深刻性,用证据推理得出结论,用变化的观点分析化学过程,用平衡的思想判断溶液中粒子浓度间的关系.解题过程中,我们既要充分发掘题给信息,找到突破口,又要通过分析、计算,用科学的理论、准确的数据、严密的推理得出结论.
