抓住图象“五点”关键,突破酸碱混合图象问题
2020-12-15甘肃杨文军
◇ 甘肃 杨文军
近几年高考试题中酸碱中和滴定图象是考查的热点,也是难点,特别是2019年、2020年全国卷Ⅰ都涉及酸碱中和滴定图象问题.这类题纵坐标以pH、水电离出的c(H+)、水电离出的 H+浓度的负对数[-lgc水(H+)]、温度、分布系数等与横坐标体积的变化曲线图为背景,具体考查曲线的分析、电离平衡常数的计算、溶液中粒子浓度的关系等,明确实验操作、盐类水解、弱电解质的电离、离子浓度三个守恒关系等知识点是解题的关键.本文对酸碱中和滴定图象进行分析,利用“五点”法对特殊点常考的知识点进行归纳,对分析这一类图象问题起到了很好的借鉴作用.
1 滴定曲线特点
1)氢氧化钠滴定等浓度、等体积的盐酸及醋酸的滴定曲线(如图1).
2)盐酸滴定等浓度、等体积的氢氧化钠及氨水的滴定曲线(如图2).
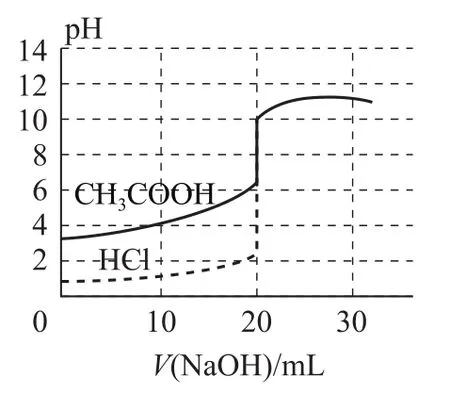
图1
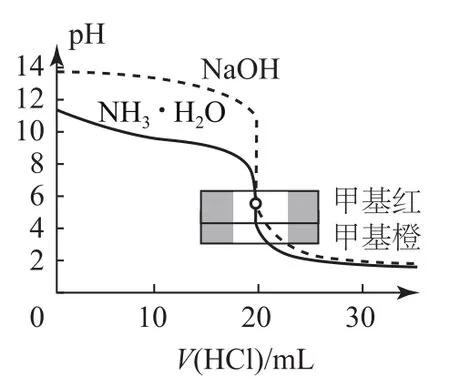
图2
曲线起点不同:强碱滴定强酸、弱酸的曲线,强酸起点低;强酸滴定强碱、弱碱的曲线,强碱起点高.
突跃点变化范围不同:强碱与强酸反应(强酸与强碱反应)的突跃点变化范围大于强碱与弱酸反应(强酸与弱碱反应).
室温下,当等体积、等浓度的一元强碱和一元强酸反应时,pH=7;但当等体积、等浓度的一元强碱和一元弱酸(或一元强酸和一元弱碱)反应时,pH>7(或pH<7).
指示剂的选择:强酸滴定弱碱用甲基橙,强碱滴定弱酸用酚酞;强酸与强碱的滴定,用甲基橙和酚酞均可.
2 滴定曲线上的特殊点的分析
典例常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.1000mol·L-1HA 溶液,随着NaOH溶液体积(V)的改变溶液pH变化所得滴定曲线如图3所示.
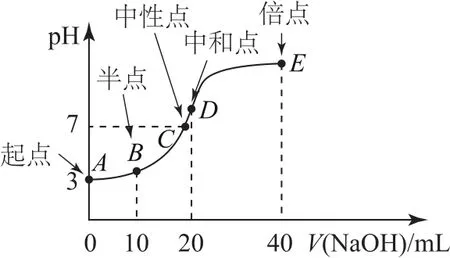
图3
典例分析酸碱反应方程式为NaOH+HA=NaA+H2O.
① 当V=0时,酸未反应,此时即为“起始”点,溶液为20.00mL0.1000mol·L-1HA溶液.看图后知0.1000mol·L-1HA 溶液的 pH=3,c(H+)<0.1000mol·L-1,说明该酸为弱酸
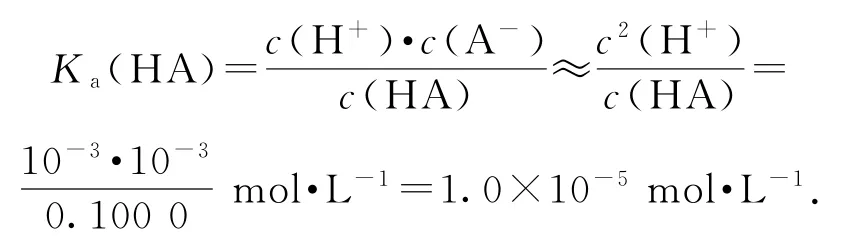
② 当V=10mL时,HA只反应了一半,此时即为“半”点,且得到等物质的量的HA和NaA,此时溶液显酸性,HA的电离程度大于A-的水解程度.关于此点各粒子浓度由大到小顺序为c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-);物料守恒式为
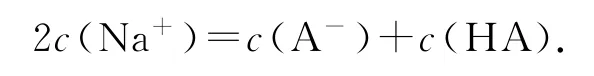
③ 当10mL<V<20mL时,加入NaOH溶液后恰好显中性的点即为“中性”点,得到溶液中溶质为HA和NaA,但不等量.此点常涉及考查的知识点为判断滴定后溶液呈中性时所加碱的体积比20mL大还是小.
④ 当V=20mL时,HA恰好完全反应,此时即为“恰好”反应点,得到溶液中溶质为NaA.看图或分析盐组成不难判断出此时溶液显碱性.
⑤ 当V=40mL时,NaOH溶液过量,所加NaOH溶液是HA物质的量的2倍,此时即为“倍”点,且得到等物质的量的NaOH和NaA的溶液.此点常涉及考查的知识点为混合溶液的物料守恒:
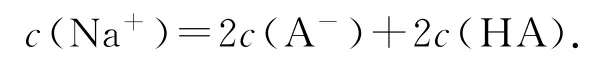
3 以酸碱中和滴定为背景的不同图象考查
题型1pH与体积图象
例125℃时,在20.0mL0.10mol·L-1氨水中滴入0.10mol·L-1的盐酸,所加盐酸的体积与溶液的pH关系如图4所示.已知该温度下0.10mol·L-1NH3·H2O 的电离度为1.32%,下列有关叙述正确的是( ).
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0mL
C.M点处的溶液中
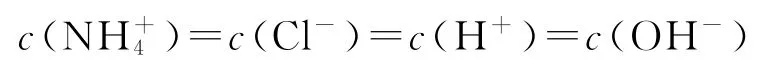
D.N点处的溶液中pH<12
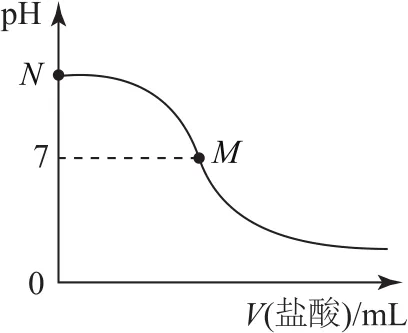
图4
解析
强酸弱碱相互滴定时,由于生成强酸弱碱盐而显酸性,而石蕊的变色范围为5~8,无法控制滴定终点,故应选择甲基橙作指示剂,选项A错误;从图上看,此时M点即为“中性”点,如果M点盐酸体积为20.0mL,则二者恰好完全反应生成NH4Cl,NH4Cl中NH+4水解导致该点溶液应该呈酸性,要使溶液呈中性,则氨水应该稍微过量,所以盐酸体积小于20.0mL,选项B错误;M处溶液呈中性,则存在c(H+)=c(OH-),根据电荷守恒得c(NH+4)=c(Cl-),该点溶液中溶质为NH4Cl和NH3·H2O,水电离程度很小,该点溶液中离子浓度大小顺序为选项C错误;N点为“起始”点,该点是浓度为0.10mol·L-1的氨水,电离度为1.32%,则该点溶液
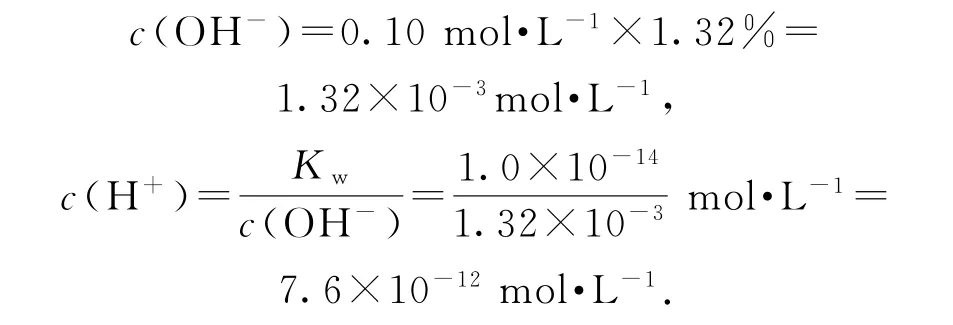
所以该点溶液的pH<12,选项D正确.答案为D.
题型2水电离出的c(H+)与反应物溶液体积图象
例225℃时,已知醋酸的电离常数Ka为1.8×10-5.将2.0mol·L-1NaOH 溶液逐滴加入20 mL2.0mol·L-1CH3COOH溶液中,所加NaOH溶液体积与溶液中水电离出的c(H+)的变化曲线如图5所示.下列说法不正确的是( ).
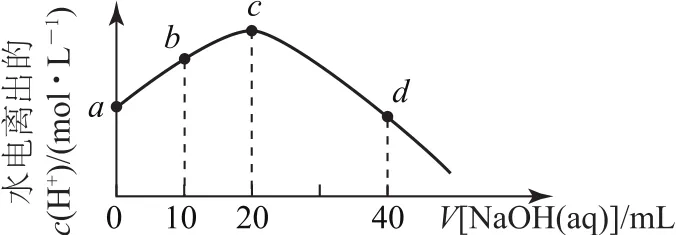
图5
A.a点溶液中:c(H+)=6.0×10-3mol·L-1
B.b点溶液中:
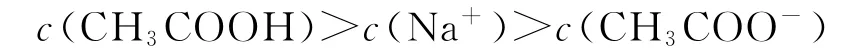
C.c点溶液中:
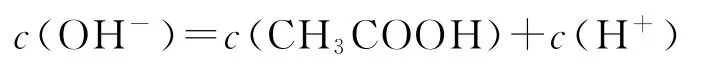
D.d点溶液中:
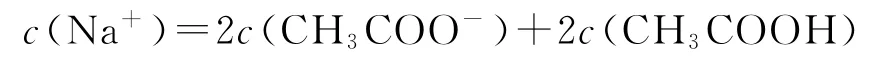
解析
a为“起始”点,溶质为CH3COOH,相当于已知Ka、c(酸),求c(H+).
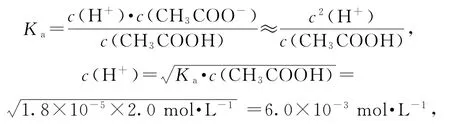
选项A正确;b点为“半”点,溶质为等物质的量的CH3COONa和 CH3COOH.CH3COO-+H2O⇌CH3COOH+OH-,水解平衡常数的电离大于CH3COO-的水解,所以c(CH3COO-)>c(Na+)>c(CH3COOH),选项B错误;c点为“恰好”反应点,溶液的溶质只有CH3COONa.该溶液中电荷守恒为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),物料守恒为c(Na+)=c(CH3COO-)+c(CH3COOH),两式联立可推导出质子守恒为c(OH-)=c(CH3COOH)+c(H+),选项C正确;d点为“倍”点,溶质有等物质的量的CH3COONa和NaOH.物料守恒为c(Na+)=2c(CH3COO-)+2c(CH3COOH),选项D正确.答案为B.
题型3水电离出的c(H+)的负对数[-lgc水(H+)]与体积图象
例3常温下,将0.1mol·L-1NaOH溶液滴入20.00mL0.1mol·L-1HA溶液中,所加NaOH溶液体积与溶液中由水电离出的H+浓度的负对数[-lgc水(H+)]的关系如图6所示,下列说法不正确的是( ).
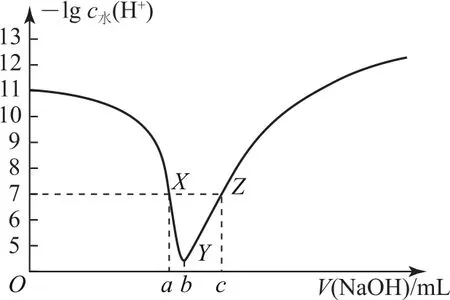
图6
A.常温下,HA的电离常数约为10-5
B.X点和Z点两溶液的pH均为7
C.V(b)=20.00mL
D.X点后溶液中均存在c(Na+)>c(A-)
解析
所加NaOH溶液体积为零时,即为“起始”点,图象上观察到-lgc水(H+)=11,推出c水(H+)=c水(OH-)=10-11mol·L-1,根据水的离子积求出溶液中
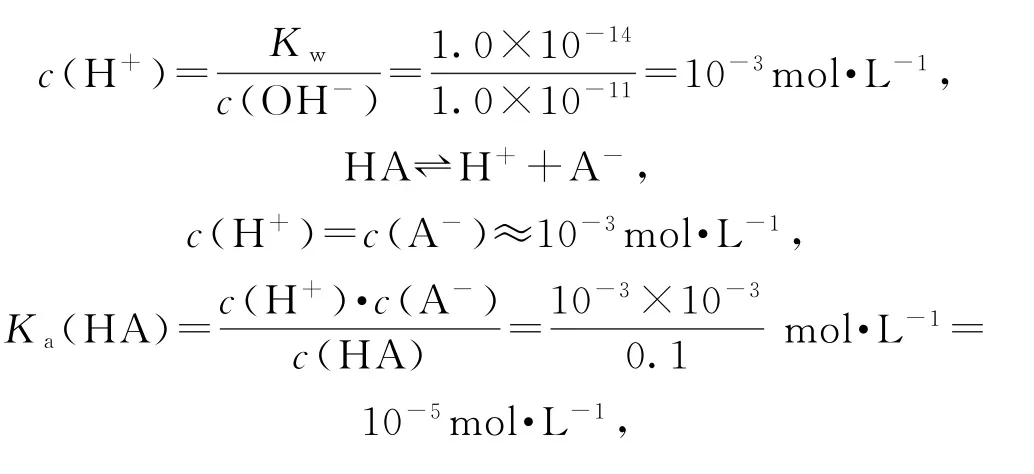
选项A正确;Y点水电离出的H+最大,说明HA与NaOH溶液恰好完全反应生成NaA,即Y点为“恰好”反应点.X点在恰好反应点之前,溶质为HA和NaA,但不等量,此时溶液呈中性,即溶液的“中性”点,HA的电离程度和A-的水解程度相同,最终对水的电离平衡无影响,c水(H+)=c水(OH-)=10-7mol·L-1.Z点溶质为NaOH和NaA,A-的水解对水电离促进程度和NaOH电离对水电离的抑制程度相同,最终水电离的c水(H+)=c水(OH-)=10-7mol·L-1,但此时溶液显碱性,即Z点pH大于7,选项B错误;O~b点水的电离程度增大,当达到b点时水的电离程度达到最大,即溶质为NaA,说明HA和NaOH恰好完全反应,即Y点为“恰好”反应点.一元酸和一元碱按物质的量1∶1反应,所以b=20.00mL,选项C正确;X点为溶液的“中性”点,即pH=7,根据溶液电荷守恒:c(H+)+c(Na+)=c(OH-)+c(A-),推出c(Na+)=c(A-),X点后,c(Na+)>c(A-),选项D正确.答案为B.
题型4温度(T)与体积图象
例4常温下,二甲胺[(CH3)2NH·H2O]为一元弱碱,其电离常数Kb=1.6×10-4.将0.1mol·L-1盐酸滴入10mLcmol·L-1二甲胺溶液中,反应得到的混合溶液的温度与盐酸体积的关系如图7所示.下列说法不正确的是( ).
A.二甲胺溶液的浓度为0.2mol·L-1
B.在Z和W点之间某点溶液pH=7
C.Z点存在:c(Cl-)>c[(CH3)2NH+2]>c(H+)>c(OH-)
D.常温下,(CH3)2NH2Cl的水解常数Kh=6.25×10-11
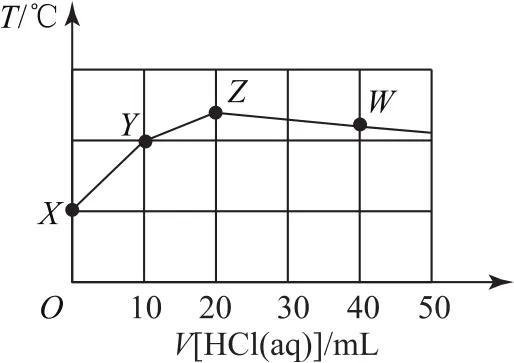
图7
解析
酸碱中和反应为放热反应,二甲胺与盐酸恰好完全中和时放出热量最多,此时体系温度最高,即Z点为“恰好”反应点.根据一元酸和一元碱按等物质的量反应,所以(10×10-3)L×cmol·L-1=(20×10-3)L×0.1mol·L-1,解得c=0.2,选项 A正确.
二甲胺是一元弱碱,Z点对应的溶质是(CH3)2NH2Cl,属于强酸弱碱盐,其溶液呈酸性,Z到W点继续滴加盐酸,二甲胺已经反应完,溶质为(CH3)2NH2Cl和HCl混合溶液,酸性不断增强,不可能出现pH=7的点,选项B错误.
由选项A、B分析知,Z点对应溶液呈酸性,电荷守恒为
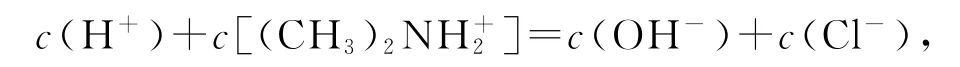
由于c(H+)>c(OH-),所以Y点存在:
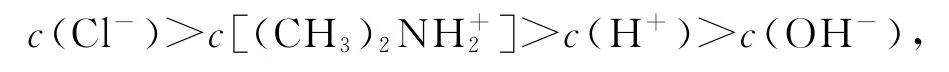
选项C正确.
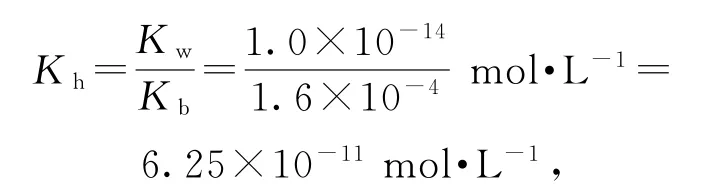
选项D正确.答案为B.
【解题感悟】1)抓反应的“起始”点,判断酸、碱的相对强弱,酸的浓度、pH(H+浓度)、K的相互计算.
2)抓反应的“半”点,判断是哪种溶质的等量混合.
3)抓溶液的“中性”点,判断溶液中溶质的成分及哪种物质过量或不足.
4)抓“恰好”反应点,判断生成的溶质成分及溶液的酸碱性.如果知道此时的pH,还可以计算A-水解常数(Kh)以及HA的电离常数(Ka).
5)抓反应的“倍”点,判断溶液中的溶质,判断哪种物质过量.
