破解高考命题中“以工农业生产”为载体的化学平衡图象类试题
2020-12-15北京李宏华
◇ 北京 李宏华
研究化学的目的是有利于提高人类生活、生产的水平.在工业生产过程中,如何提升原料利用率、降低化学反应条件、提高产物的产率等是化学工作者一直在研究的重要课题.命题者往往根据实际工业生产,结合图象,从分析投料比、转化率、产率等角度来命题.此类题目的信息量大,能充分考查学生读图、提取信息、解决实际问题的能力,因此是现代高考及平时模拟考试的“新宠”.命题一般从以下几个角度进行.
1 曲线上的每个点是否都达到平衡
解题过程中,学生往往需要通过曲线的升降趋势或斜率变化来判断是否达到平衡,只有达到化学平衡以后的点才能应用平衡移动原理.
例1党的十九大报告中多次提及“绿色环保”、“生态文明”,而CO2的有效利用可以缓解温室效应,解决能源短缺问题.
(1)某研究所的科研人员在新型纳米催化剂Na-Fe3O4和 HMCM-22的表面,以CO2为碳源,与电解水产生的H2催化转化为高附加值的烃类化合物,其过程如图1所示.
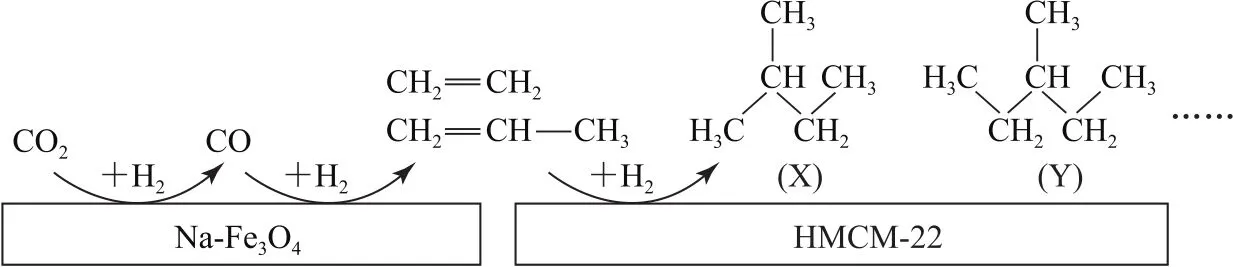
图1
图中CO2转化为CO的反应为
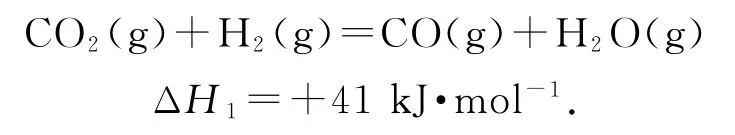
已知:2CO2(g)+6H2(g)=C2H4(g)+4H2O(g)ΔH2=-128kJ·mol-1.图中CO 转化为C2H4的热化学方程式是________.
(2)甲醇是未来重要的绿色能源之一,在工业中常用CO、H2合成甲醇,其反应为CO(g)+2H2(g)⇌CH3OH(g) ΔH3<0.
① 为探究浓度对反应速率的影响,200℃时在10L恒容密闭容器中进行实验,测得实验数据如表1所示.

表1
该反应速率的通式为v正=k正cm(CO)cn(H2)(k正是与温度有关的速率常数).由表中数据可确定反应速率通式中m=________、n=________(取正整数).实验发现,当实验1中c(H2)=0.25mol·L-1时达到平衡,请计算该反应的平衡常数K=________.
②若将一定比例的CO和H2在装有催化剂的反应器中反应12h,体系中甲醇的产率和催化剂的催化活性与温度的关系如图2所示.

图2
请判断温度为470K时,图中P点________(填“是”或“不是”)处于平衡状态,490K之后,甲醇产率随温度升高而减小的可能原因为______、______.
解析
(1)图中CO2转化为CO的反应为

已知:
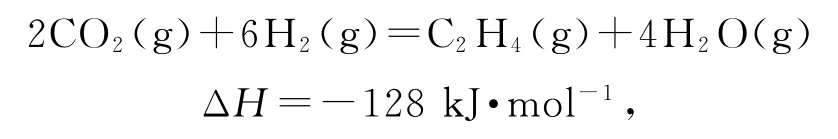
用第二个方程式减去第一个方程式的2倍得到CO转化为C2H4的热化学方程式,即
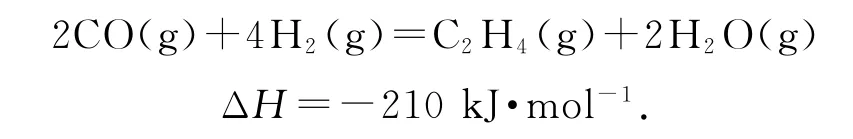
(2)①由v正=k正cm(CO)cn(H2)可知,实验1中:

实验2中:

实验3中:

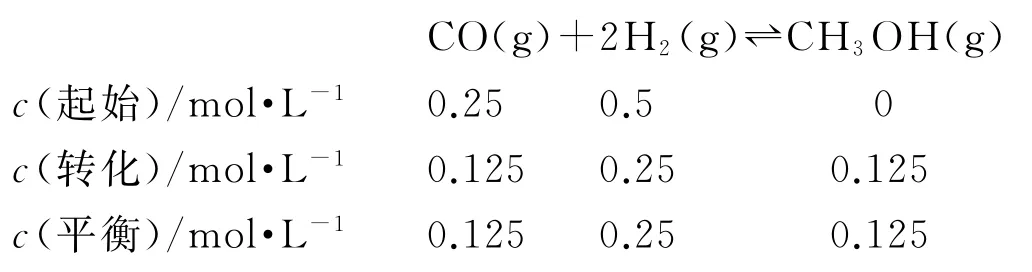
② 温度为470K时,图中P点没有处于平衡状态;在490K之前,甲醇产率随着温度升高而增大的原因是温度越高化学反应速率越快,490K之后,甲醇产率下降的原因是升高温度,反应逆向移动、催化剂活性降低.
2 催化剂的活性是否受温度的影响
不同的催化剂因选择性不同受温度的影响也会不同.一般来说,催化剂的活性在一定温度下最高,低于或高于这个温度都会下降.
例2(2018年全国卷Ⅱ)CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义.回答下列问题:
(1)CH4—CO2催化重整反应为

该催化重整反应的ΔH=______kJ·mol-1,有利于提高CH4平衡转化率的条件是______(填标号).
A.高温、低压 B.低温、高压
C.高温、高压 D.低温、低压
某温度下,在容积为2L的容器中加入2mol CH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为________mol2·L-2.
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少.相关数据见表2.

表2
① 由表2判断,催化剂XY(填“优于”或“劣于”),理由是________.在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图3所示.升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________(填标号).
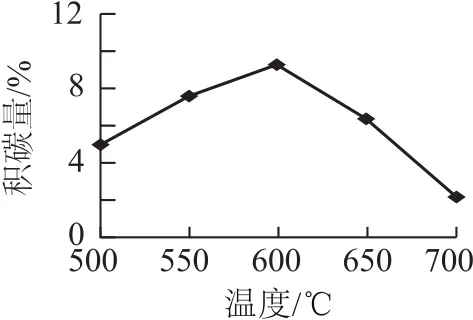
图3
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数).在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图4所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________.

图4
解析
(1)根据盖斯定律可得该催化重整反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=+247kJ·mol-1.正反应是体积增大的吸热反应,所以有利于提高CH4平衡转化率的条件是高温、低压;某温度下,在容积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,根据方程式可知

所以平衡常数为

(2)① 根据表中数据可知相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大,所以催化剂X劣于Y.正反应均是吸热反应,升高温度平衡向正反应方向进行,因此K积、K消均增加,选项A正确;升高温度,反应速率均增大,选项B错误;根据A中分析可知选项C错误;积碳量达到最大值以后再升高温度积碳量降低,这说明v消增加的倍数比v积增加的倍数大,选项D正确.② 根据反应速率方程式可知在p(CH4)一定时,生成速率随p(CO2)的升高而降低,所以根据图象可知pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为pc(CO2)、pb(CO2)、pa(CO2).
【方法点拨】注意化学平衡图象分析题的答题技巧,1)一看面:纵坐标与横坐标的意义;2)二看线:线的走向和变化趋势;3)三看点:起点、拐点、终点,然后根据图象中呈现的关系、题给信息及所学知识,做出符合题目要求的解答.
3 不同的投料比对产率也会造成影响
可以根据“定一议二”的方法,根据相同投料比下改变温度或压强对产率的影响或相同温度、相同压强下改变投料比时平衡移动的方向进行判断,确定反应的吸、放热或系数和的大小.如将燃煤废气中的CO2转化为甲醚的反应原理为2CO2(g)+6H2(g)催化剂CH3OCH3(g)+3H2O(g).已知在压强为aMPa下,该反应在不同温度、不同投料比时,CO2的转化率如图5所示.

图5
当投料比一定时,温度越高,CO2的转化率越低,所以升温,平衡向左移动,正反应为放热反应.若温度不变,提高投料比则提高了CO2的转化率.
例3(2020年山东卷)探究CH3OH合成反应化学平衡的影响因素,有利于提高CH3OH的产率.以CO2、H2为原料合成CH3OH涉及的主要反应如下:

回答下列问题:
(1)ΔH3=_______kJ·mol-1.
(2)一定条件下,向体积为VL的恒容密闭容器中通入1molCO2和3molH2发生上述反应,达到平衡时,容器中CH3OH(g)为amol,CO为bmol,此时H2O(g)的浓度为________mol·L-1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数为________.
(3)不同压强下,按照n(CO2)∶n(H2)=1∶3投料,实验测定CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图6所示.

图6
已知:CO2的平衡转化率为

其中纵坐标表示CO2平衡转化率的是图________(填“甲”或“乙”);压强p1、p2、p3由大到小的顺序为________;图6-乙中T1温度时,3条曲线几乎交于一点的原因是________.
(4)为同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择的反应条件为________(填标号).
A.低温、高压 B.高温、低压
C.低温、低压 D.高温、高压
解析
(1)根据反应Ⅰ-Ⅱ=Ⅲ可知,

(2)假设反应Ⅱ中,CO反应了xmol,则Ⅱ生成的CH3OH为xmol,Ⅰ生成的CH3OH为(a-x)mol,Ⅲ生成的CO为(b+x)mol,根据反应Ⅰ:
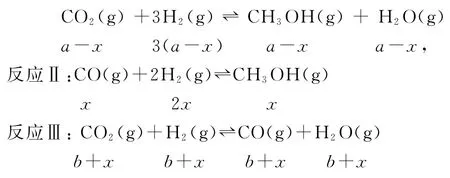
所以平衡时水的物质的量为

浓度为
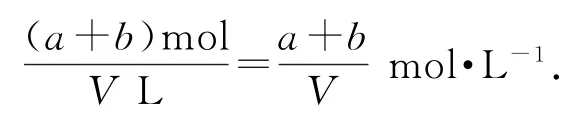
平衡时CO2的物质的量为

H2的物质的量为
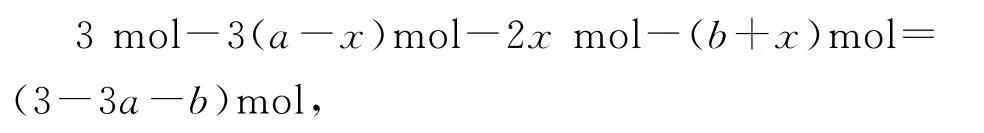
CO的物质的量为bmol,水的物质的量为(a+b)mol,则反应Ⅲ的平衡常数为

(3)反应Ⅰ和Ⅱ为放热反应,升高温度,平衡逆向移动,则CH3OH的平衡产率减少,所以图甲表示CH3OH的平衡产率,图乙中,开始升高温度,由于反应Ⅰ和Ⅱ为放热反应,升高温度,平衡逆向移动,CO2的平衡转化率降低,反应Ⅲ为吸热反应,升高温度,反应Ⅲ向正反应方向移动,升高一定温度后以反应Ⅲ为主,CO2的平衡转化率又升高,所以图乙表示CO2的平衡转化率;反应Ⅰ和Ⅱ是气体体积减小的反应,压强增大平衡正向移动,反应Ⅲ气体体积不变化,平衡不移动,故压强增大,CH3OH的平衡产率增大,所以压强关系为p1>p2>p3;温度升高,反应Ⅰ和Ⅱ平衡逆向移动,反应Ⅲ向正反应方向移动,所以T1温度时,3条曲线交于一点的原因为:T1时以反应Ⅲ为主,反应Ⅲ前后分子数相等,压强改变对平衡没有影响.
(4)根据图示可知,温度越低,CO2的平衡转化率越大,CH3OH的平衡产率越大,压强越大,CO2的平衡转化率越大,CH3OH的平衡产率越大,所以选择低温和高压.
4 考虑副反应的干扰或影响
涉及副反应试题一般在题干中会有一定的信息提示,尤其是温度的改变影响较大的反应.如磷石膏是湿法生产磷酸排出的工业废渣,主要成分是CaSO4·2H2O.用不同的还原剂可以将CaSO4还原,所得SO2可用于工业生产硫酸.以C作还原剂,向密闭容器中加入相同质量的几组不同C/S值(C与CaSO4的物质的量比)的混合物在1100℃加热,结果如图7所示.当C/S值为0.5时,反应产物为CaO、SO2、CO2;当C/S值大于0.7时,反应所得气体中SO2的体积分数不升反降,其可能的原因是当C/S值大于0.7时,原料中的还原剂C的含量增加,则高温下过量的C与CO2发生反应从而使得气体总体积增大(或部分转化为其他含S物质).
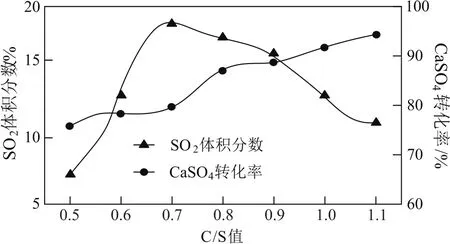
图7
例4乙烯、环氧乙院是重要的化工原料,用途广泛.回答下列问题:

① 反应达到平衡后,仅降低温度,下列说法正确的是________.
A.k正、k逆均增大,且k正增大的倍数更多
B.k正、k逆匀减小,且k正减小的倍数更少
C.k正增大、k逆减小,平衡正向移动
D.k正、k逆均减小,且k逆减小的倍数更少
② 若在1L密闭容器中充入1molCH2CH2(g)和1molO2(g),在一定温度下只发生反应Ⅰ,经10 min反应达到平衡,体系的压强变为原来的0.875,则0~10min内.
(2)现代制备乙烯常用乙烷氧化裂解法:

ΔH2=-110kJ·mol-1,反应中还存在 CH4、CO、CO2等副产物(副反应均为放热反应),图8为温度对乙烷氧化裂解反应性能的影响.
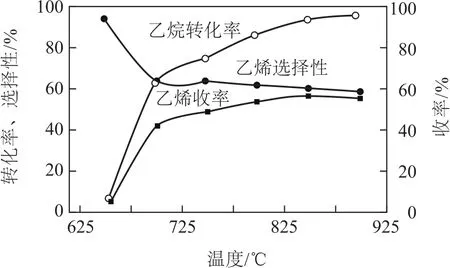
图8
①乙烷的转化率随温度的升高而升高的原因是________;反应的最佳温度为________(填序号).
A.650℃ B.700℃
C.850℃ D.900℃

② 工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是________.
解析
(1)① 该反应是放热反应,反应达到平衡后,仅降低温度,速率降低,k正、k逆匀减小,平衡向放热方向即正向进行,正反应速率大于逆反应速率,因此k正减小的倍数更少.

(2)① 由图可知,随温度的升高,乙烷的转化率在升高,考虑化学反应速率的影响因素,温度升高,反应速率加快,转化率升高;要使乙烷的转化率尽可能高,而副产物又相对较少,及乙烯的选择性较高,应找到乙烯收率较高时的温度,对应温度为850℃;② 工业上,保持体系总压恒定为100kPa的条件下进行该反应,通常在乙烷和氧气的混合气体中掺混惰性气体(惰性气体的体积分数为70%),掺混惰性气体的目的是正反应是气体分子数增多的反应,恒压充入惰性气体相当于扩大容器容积,降低分压,有利于平衡正向移动.
总之,探究性课题具有理论联系实际的观念,有将化学成果应用于生产、生活的意识,能依据实际条件并运用所学的化学知识和方法解决生产、生活中简单的化学问题;在实践中逐步形成节约成本、循环利用、保护环境等意识.同时培养学生进行“科学探究与创新意识”和“科学态度与社会责任”学科素养教育.
