雷诺嗪预处理对缺氧/复氧损伤H9C2 心肌细胞自噬的调控及对心肌细胞的保护作用
2020-12-15刘明远栾海艳马春艳张宝成赵锦程杨光远
赵 茜, 刘明远, 李 萌, 栾海艳, 杨 玉, 马春艳, 张宝成, 赵锦程, 杨光远
(1.佳木斯大学附属第一医院心内一科,黑龙江 佳木斯 154002;2.佳木斯大学基础医学院药理学教研室,黑龙江 佳木斯 154002)
针对心肌梗死进行再灌注治疗可明显改善患者的生存率,但再灌注过程中却出现了心肌继发性损伤或细胞死亡的病理现象即心肌缺血/再灌注损伤(myocardial ischemia reperfusion injury,MIRI),导致心脏组织损伤或功能障碍,并增加心肌梗死范围[1-2]。自噬是细胞中去除受损物质和更新细胞器的一种降解过程[3-4],适度自噬可以保护细胞免受各种损害,但是,过度自噬会导致重要的细胞器降解,从而损害细胞。心肌细胞自噬与MIRI 和心力衰竭等多种心血管疾病的发病机制有密切关联[5],可明显影响MIRI 程度,表明对自噬的治疗性干预可能有益于MIRI 心肌的预后。雷诺嗪是心肌细胞晚期钠电流的选择性抑制剂,可防止细胞中钙离子蓄积,减少缺血心肌耗能,从而对MIRI 心肌起保护作用,但其作用机制尚未完全阐明。本课题组前期研究[6]显示:雷诺嗪预处理对大鼠MIRI 心肌起保护作用,且呈剂量依赖性。本研究在此基础上,建立体外缺氧/复氧损伤模型,研究雷诺嗪预处理保护缺氧/复氧损伤心肌细胞是否是通过哺乳动物雷帕素靶蛋白(mamalian target of rapamycin,mTOR) 调控自噬水平实现的, 为雷诺嗪治疗MIRI 提供理论依据。
1 材料与方法
1.1细胞、主要试剂和仪器心肌H9C2 细胞购于中国科学院上海细胞库。DMEM 培养基购于美国Hyclone 公 司, 胎 牛 血 清(fetal bovine serum,FBS) 购于美国BI 公司,雷诺嗪购于大连美仑生物技术有限公司,渥曼青霉素和雷帕霉素购于北京索莱宝公司, 微管相关蛋白轻链3 (microtubuleassociated protein light chain 3, LC3) 购 于 美 国Abcam 公 司, mTOR 和 磷 酸 化 mTOR(phosphorylated mTOR, p-mTOR) 购于美国Cell Signaling Technology 公司。 CO2培养箱购于美国SHEL LAB 公司,酶标仪购于美国博腾公司,激光共聚焦显微镜购于美国Olympus 公司,电泳仪购于美国伯乐公司。
1.2细胞分组和CCK-8法检测各组H9C2细胞活性将H9C2 细 胞 以1×105mL-1的 密 度 接 种 于96 孔培养板,待细胞生长至约80% 时进行后续实验,将H9C2 细胞随机分为正常对照组和不同浓度雷诺嗪组(给予2、5 、10、15 、20和30 μmol·L-1雷诺嗪),每组6 复孔。药物孵育24 h 后,每孔加入200 μL 含10% CCK-8 溶 液 的 高 糖DMEM, 置 于37 ℃、5% CO2培养箱孵育1.5 h。于酶标仪上读取450 nm 处的吸光度(A) 值。将H9C2 细胞接种于96 孔板,随机分为正常对照组和不同浓度雷诺嗪组(给予0、2、5、10、 15、20 和30 μmol·L-1雷诺嗪), 每组6 复孔。 正常对照组为正常培养的H9C2 细胞, 不做任何处理, 不同浓度雷诺嗪组H9C2 细胞给予不同浓度雷诺嗪预处理30 min 后,每孔更换200 μL 磷酸盐缓冲液(PBS),置于37℃、95% N2和5% CO2培养箱中模拟缺氧4 h 后,更换为10%FBS 培养基200 μL 后于5% CO2恒温培养箱内模拟复氧培养3 h。0 μmol·L-1雷诺嗪组即为缺氧/复氧模型组。CCK-8 法检测各组细胞活性,于酶标仪上记录450 nm 处吸光度(A) 值, 以A (450) 值代表细胞活性。
1.3雷诺嗪对缺氧/复氧损伤的H9C2细胞保护作用实验分组和处理方式实验分组为正常对照组、缺氧/复氧模型组、雷诺嗪预处理组、雷诺嗪+渥曼青霉素组、雷帕霉素组。正常对照组为常规培养的H9C2 细胞。缺氧/复氧模型组:取生长至80%的H9C2 细 胞, 更 换 为PBS 缓 冲 液, 于37 ℃、95% N2、5% CO2的培养箱中缺氧处理4 h 后,更换为10% FBS 培养基,于37℃、5% CO2培养箱内复氧处理3 h;雷诺嗪预处理组:20 μmol·L-1雷诺嗪浓度预处理30 min 后,再行缺氧/复氧处理;雷诺 嗪+ 渥 曼 青 霉 素 组: 20 μ mol·L-1雷 诺 嗪 和200 nmo·L-1渥曼青霉素预处理30 min,再行缺氧/复氧处理;雷帕霉素组:25 g·L-1雷帕霉素预处理30 min,再行缺氧/复氧处理。
1.4 CCK-8法检测缺氧/复氧损伤后各组细胞活性操作方法同试剂盒说明书, 酶标仪检测各孔A (450) 值, 以A (450) 值 代 表 各 组 细 胞活性。
1.5乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒检测各组H9C2细胞中LDH水平操作方法同LDH 试剂盒说明书, 酶标仪检测各孔于450 nm 波 长 处A 值, 计 算LDH 活 性。 LDH 活 性(U·L-1)(测定孔A 值-对照孔A 值) /(标准孔A 值-空白孔A 值) ×0.2 mmol·L-1×1 000。
1.6免疫荧光染色技术检测各组H9C2细胞中LC3阳性细胞率以8×103mL-1的细胞密度给予6 孔板内爬片处理后, 镜下观察细胞融合至约80%,药物预处理、缺氧/复氧处理后,给予细胞固定、通透、封闭、一抗孵育、FITC 标记荧光二抗孵育、DAPI 染核后,于激光共聚焦显微镜上观察。参照既往研究[7]计算LC3 阳性细胞率(随机选择5 个高倍镜下视野, 每组细胞总数不少于100 个)。LC3 阳性细胞率=LC3 阳性细胞数/细胞总数×100%。
1.7 Western blotting 法检测各组H9C2 细胞中LC3、mTOR 和p-mTOR 蛋白表达水平
裂解细胞,刮取蛋白,以15 000 r·min-1离心蛋白,取上清,调整蛋白浓度。经SDS-PAGE 电泳分离蛋白、转膜、5% 脱脂奶粉-TBST 于37 ℃温箱封 闭2 h、 一 抗(β -actin 、 LC3、 mTOR 和p-mTOR) 4 ℃冰箱过夜孵育、TBST 洗膜,加入对应的过氧化物酶标记的山羊抗小鼠IgG (H+L)、山羊抗兔IgG (H+L) 二抗于37 ℃温箱孵育45 min,TBST 洗膜,ECL 化学发光检测试剂盒显色,以β-actin 作为内参,采用Image J 软件分析各蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/β-actin 条带灰度值。
1.8统计学分析采用SPSS 22.0 和GraphPad Prism6.01 统计软件进行统计学分析。各组细胞活性、各组H9C2 细胞中LDH 活性、LC3 阳性细胞率、LC3 Ⅱ/LC3 Ⅰ和p-mTOR/mTOR 比 值 以x±s表示,两组间比较采用t检验,多组间比较采用单因素方差分析LSD 和Tamhane 法。 以P<0.05 为差异有统计学意义。
2 结 果
2.1各组H9C2细胞活性与正常对照组比较,不同浓度雷诺嗪组H9C2 细胞活性差异无统计学意义(P>0.05), 即雷诺嗪浓度在2 ~30 μmol·L-1对H9C2 心肌细胞无毒性作用。 与正常对照组比较,缺氧/复氧模型组H9C2 细胞活性下降约41%(P<0.01); 与缺氧/复氧模型组比较, 10、 15、20 和30 μmol·L-1雷 诺 嗪 组 细 胞 活 性 升 高(P<0.05),以20 μmol·L-1雷诺嗪组H9C2 细胞活性升高最为明显。综合上述实验结果,选定20 μmol·L-1雷诺嗪为最佳药物浓度以进行后续实验。见表1。
2.2缺氧/复氧损伤后各组H9C2细胞活性和细胞中LDH活性与正常对照组比较,缺氧/复氧模型组H9C2 细胞活性降低(t=18.654,P<0.01),LDH 活性升高(t=-11.865, P<0.01); 与缺氧/复氧模型组比较,雷诺嗪预处理组和雷帕霉素组H9C2 细胞活性明显升高(P<0.01), LDH 活性明显降低(P<0.01),雷诺嗪+渥曼青霉素组H9C2 细胞活性和LDH 活性差异无统计学意义(P>0.05)。见表2。
2.3各组H9C2细胞中LC3阳性表达率镜下可见,正常对照组H9C2 细胞中LC3 弥散分布于细胞浆中,LC3 阳性表达率为(0.08±0.03) %;与正常对照组比较, 缺氧/复氧模型组H9C2 细胞中LC3 表达水平明显增多,细胞中LC3 呈点状聚集现象, 阳 性 细 胞 率(0.27±0.07) % 升 高(P<0.05);与缺氧/复氧模型组比较,雷诺嗪预处理组[(0.55±0.06)%]、 雷帕霉素组[(0.61±0.11)%] H9C2 细胞中LC3 阳性表达率均升高(P<0.01);雷诺嗪+渥曼青霉素组LC3 免疫荧光强度明显降低, 阳性表达率仅为(0.25±0.04) %,与模型组比较差异无统计学意义(P>0.05)。见图1 (插页八)。
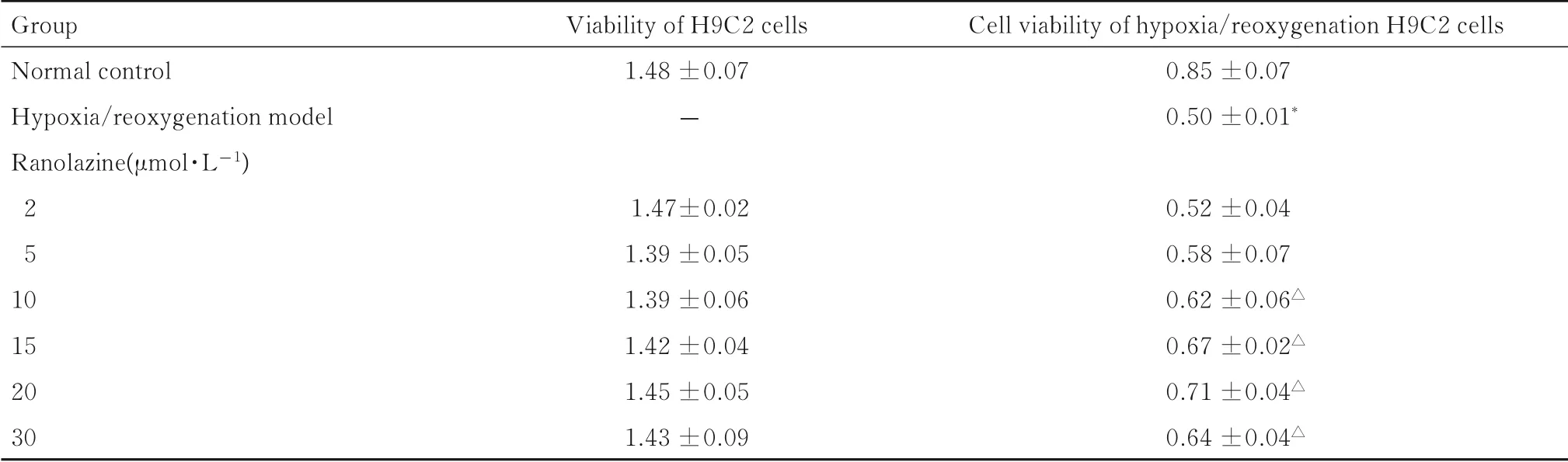
表1 CCK-8 法检测各组H9C2 细胞活性Tab.1 Cell viabilities of H9C2 cells in various groups detected by CCK-8 method (n=6,x±s)
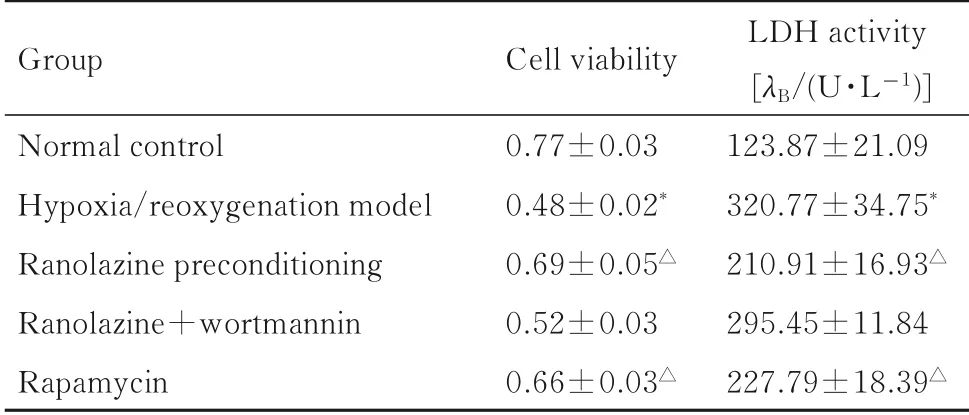
表2 缺氧/复氧损伤后各组H9C2 细胞活性和细胞中LDH活性Tab.2 Cell viabilities and LDH activities of H9C2 cells in various groups after hypoxia/reoxygenation injury (n=6,x±s)
2.4各组H9C2细 胞 中LC3 Ⅱ/LC3 Ⅰ和p-mTOR/mTOR比值与正常对照组比较,缺氧/复氧模型组H9C2 细胞中LC3 Ⅱ/LC3Ⅰ比值升高(P<0.01), p-mTOR/mTOR 比 值 降 低 (P<0.01)。与缺氧/复氧模型组比较,雷诺嗪预处理组和雷帕霉素组H9C2 细胞中LC3 Ⅱ/LC3Ⅰ比值明显升高(P<0.01),p-mTOR/mTOR 比值明显降低(P<0.01);雷诺嗪+渥曼青霉素组H9C2 细胞中LC3 Ⅱ/LC3Ⅰ和p-mTOR/mTOR 比值与缺氧/复氧模型组比较差异无统计学意义(P>0.05)。见图2 和表3。
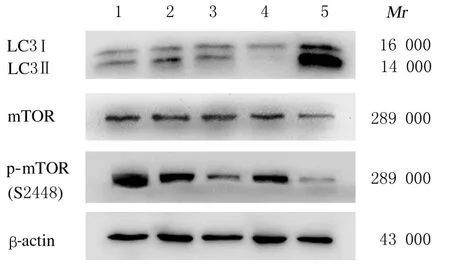
图2 各组H9C2 细胞中LC3、mTOR 和p-mTOR 蛋白表达电泳图Fig.2 Electrophoregram of expressions of LC3, mTOR,and p-mTOR proteins in H9C2 cells in various groups
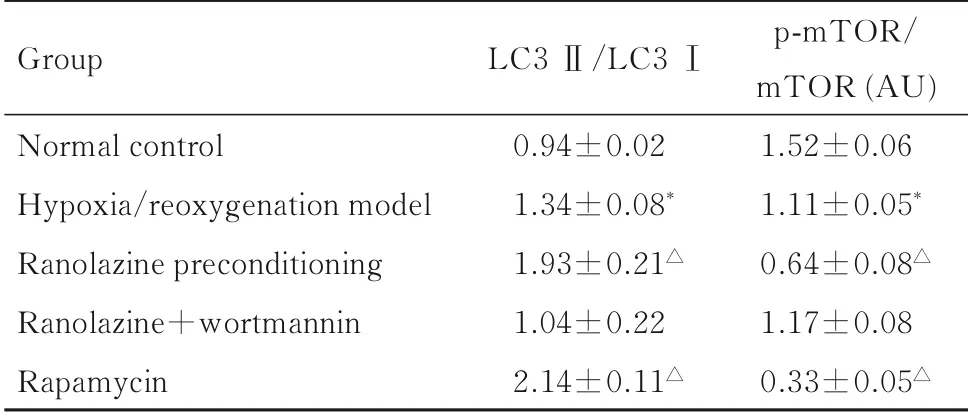
表3 各组H9C2 细胞中LC3 Ⅱ/LC3Ⅰ和p-mTOR/mTOR比值Tab.3 Ratios of LC3 Ⅱ/LC3 Ⅰand p-mTOR/mTOR in H9C2 cells in various groups (n=6,x±s)
3 讨 论
研究[8]证实: 缺氧/复氧可以损伤心肌细胞膜,导致心肌酶LDH 大量释放,细胞活性降低,因此,通过检测培养基中LDH 水平可分析心肌细胞损伤程度。细胞活性降低25% 或以上可明确成功建立缺氧/复氧损伤模型[9-10]。本研究结果显示:缺氧/复氧模型组H9C2 心肌细胞中细胞活性明显降低约41%,LDH 释放量明显增多,说明成功建立缺氧/复氧损伤模型。
近年来,雷诺嗪在临床试验中已被证实对经皮冠状动脉介入治疗后的患者有益处,可明显改善心功能并减少心绞痛发作,复发性缺血和需要重复血运重建的患者也明显减少[11]。本研究结果显示:2 ~30 μmol·L-1雷诺嗪对H9C2 心肌细胞无毒性作用, 且 雷 诺 嗪 浓 度 为20 μmol·L-1时 使 缺 氧/复 氧H9C2 心肌细胞活性升高最为明显。因此在探讨雷诺嗪对缺氧/复氧损伤心肌细胞的保护机制时,选定该浓度为最佳药物浓度进行后续实验。
自噬是一种进化保守并严格调控的生理现象,自噬可对受损物质进行降解和再利用以维持细胞内环境稳态。在机体正常情况下,心脏的自噬维持着低水平,当发生炎症、营养缺乏和低氧等应激情况时,自噬增强[12]。自噬在维持心肌细胞形态、结构和功能等方面具有重要的调节作用,研究[13-14]表明:在心脏疾病或机体应激状态下均可观察到自噬活动的改变。因此,如何利用心肌细胞内源性保护机制降低心肌缺血再灌注损伤已成为当今研究心肌缺血再灌注损伤的新焦点。
LC3 是自噬过程中必不可少的因子[15],自噬被激活时,LC3 从胞质形式LC3Ⅰ转变为膜结合形式LC3Ⅱ,LC3 Ⅱ水平与自噬呈正相关关系;通过细胞免疫荧光技术检测可见,LC3 在胞质中以弥散状态分布,在自噬增强时,细胞中LC3 免疫荧光明显增强,可观察到呈荧光点聚集分布的LC3 明显增多,因此,LC3 Ⅰ到LC3 Ⅱ转换的检测被广泛应用于细胞自噬的判定。哺乳动物mTOR 是自噬的主要负性调节剂[16-19],在自噬活动中起重要作用,对其抑制剂雷帕霉素较敏感。在营养物质充足时,mTOR 被激活,自噬被阻断,在营养物质匮乏时,mTOR 活性低,减弱了对自噬的抑制作用,自噬活动增强[20]。雷帕霉素是自噬的一种特异性激动剂,可通过抑制mTOR 通路,诱导和促进细胞自噬的发生。研究[21]显示:雷帕霉素在细胞缺氧/复氧损伤过程中诱导自噬从而对H9C2 细胞起保护作用。PI3K-Akt-mTOR 信号转导通路是参与心肌缺血再灌注损伤过程的重要信号通路,渥曼青霉素即可作为PI3K 通路的有效抑制剂,也可作为自噬抑制剂通过抑制在自噬体形成中起作用的Ⅲ型PI3K 来发挥抑制自噬作用[7]。
本研究结果显示:与正常对照组比较,缺氧/复氧模型组细胞中LC3 免疫荧光染色阳性细胞率升高,LC3 Ⅱ/LC3Ⅰ比值升高,p-mTOR/mTOR比值降低,说明缺氧/复氧诱导心肌细胞自噬;与缺氧/复氧模型组比较,雷诺嗪预处理组细胞活性升高,LDH 释放量减少,说明雷诺嗪对缺氧/复氧损伤H9C2 心肌细胞具有保护作用;雷诺嗪预处理组细胞中LC3 免疫荧光阳性细胞率升高,LC3 Ⅱ/LC3 Ⅰ比值升高,mTOR 去磷酸化明显,与雷帕霉素组结果一致,表明雷诺嗪诱导自噬增强,初步证实雷诺嗪可能通过抑制mTOR 在Ser2448 位点磷酸化而诱导自噬是其保护氧/复氧损伤心肌细胞的作用机制之一。而加入渥曼青霉素预处理后,细胞活性和培养基中LDH 活性均与缺氧/复氧模型组相似,细胞受损伤严重,说明自噬抑制剂渥曼青霉素可以抑制雷诺嗪对缺氧/复氧损伤H9C2 心肌细胞的保护作用; 且LC3 免疫荧光染色阳性细胞率、LC3 Ⅱ/LC3 Ⅰ比值及p-mTOR/mTOR 比值等指标均与缺氧/复氧模型组无差异,提示抑制自噬可抑制雷诺嗪对缺氧/复氧损伤心肌细胞的保护作用,进一步推测雷诺嗪抗心肌细胞缺氧/复氧损伤作用可能与诱导细胞适度自噬有关联。以上研究结果与既往研究[22-24]结论一致,适度调控自噬水平可有效减轻心肌缺血/再灌注损伤程度。
综上所述, 雷诺嗪预处理对缺氧/复氧损伤H9C2 心肌细胞具有保护作用,其作用机制可能与雷诺嗪抑制mTOR 蛋白磷酸化水平而诱导心肌细胞自噬有关联。有关雷诺嗪对mTOR 通路上的其他分子的影响及其与自噬的作用机制还需进一步研究。
