BTg-3 对甲状腺滤泡癌细胞增殖、侵袭和迁移及WNT/β-catenin信号通路的影响
2020-12-15杜静海
杜静海, 郭 欣
(河北医科大学附属唐山工人医院头颈外科,河北 唐山 063000)
甲状腺滤泡癌的发生发展与癌基因和抑癌基因表达失调关系密切,抑癌基因功能缺失或发生突变可导致甲状腺滤泡癌的发生发展[1]。B 细胞转位基因(BTg) 家族成员为抑癌基因,该家族成员最重要的生理功能为抑制细胞的增殖。BTg-3 为该家族成员之一, 也具有抑制恶性肿瘤发生发展的特性[2],研 究[3]显 示:BTg-3 在 多 种 恶 性 肿 瘤 中 具有抑制肿瘤增殖、侵袭和迁移的作用。本课题组[4]对甲状腺乳头状癌组织中BTg-3 的表达进行研究发现:甲状腺乳头状癌组织中BTg-3 呈低表达,过表达BTg-3 可通过抑制甲状腺乳头状癌细胞的上皮-间质转化抑制细胞增殖、 侵袭和迁移过程, 但BTg-3 在甲状腺滤泡癌发生发展中的作用及其机制尚不清楚。本研究观察甲状腺滤泡癌组织和细胞中BTg-3 表达情况及过表达BTg-3 对甲状腺滤泡癌细胞增殖、侵袭和迁移过程中WNT/β-连环蛋白(βcatenin) 信号通路的影响,探讨其在甲状腺滤泡癌发生发展中的作用及其可能机制。
1 材料与方法
1.1组织标本选择2019 年1 月—12 月本院头颈外科收治的甲状腺滤泡癌组织和甲状腺滤泡腺瘤组织标本各80 例, 甲状腺滤泡癌患者平均年龄为(54.32±7.16) 岁, 其中男性14 例, 女性66 例;甲状腺滤泡腺瘤患者平均年龄为(53.64±7.35) 岁,男性16 例,女性64 例。2 组患者年龄和性别构成比比较差异无统计学意义(P>0.05)。纳入标准:均首次确诊;行手术治疗;术前未进行其他相关治疗;病理证实为甲状腺滤泡癌或甲状腺滤泡腺瘤。排除标准:其他恶性肿瘤者;甲状腺其他疾患者;其他类型甲状腺癌者。
1.2细胞、 主要试剂和仪器甲状腺滤泡癌CGTHW-1 细胞和甲状腺滤泡上皮Nthy-ori 细胞(上海中科院细胞库)。兔抗人BTg-3 多克隆抗体、兔抗人Ki67 多克隆抗体、兔抗人增殖细胞核抗原(proliferating cell nuclear antigen, PCNA) 多克隆抗体、兔抗人波形蛋白(Vimentin) 多克隆抗体、兔抗人上皮性钙黏蛋白(E-cadherin) 多克隆抗体、兔抗人WNT1 多克隆抗体、兔抗人β-catenin 多克隆抗体、兔抗人糖原合成激酶3β (GSK3β) 多克隆抗体和兔抗人磷酸化GSK3β (p-GSK3β) 多克隆抗体(美国Abcam 公司),BTg-3 慢病毒过表达载体和阴性对照载体(上海吉玛公司),胎牛血清、胰蛋白酶、杜尔伯科改良伊格尔(DMEM) 培养基和Lipofectamine 2000 转染试剂(美国DBI 公司),DAB 试剂盒、CCK-8 试剂盒和结晶紫(美国Gibco 公司), Transwell 小室(美国Millipore 公司),Matrigel 胶(美国BD 公司)。酶标仪(美国Bio-Rad 公司)。
1.3免疫组织化学法检测甲状腺滤泡癌组织和甲状腺滤泡腺瘤组织中BTg-3表达情况将甲状腺滤泡癌组织和甲状腺滤泡腺瘤组织石蜡块切成4 μm 厚切片,采用免疫组织化学法检测甲状腺滤泡癌组织和甲状腺滤泡腺瘤组织中BTg-3 蛋白表达情况:将石蜡切片常规脱蜡至水,枸橼酸缓冲液修复抗原,加入过氧化氢去除可能产生干扰的过氧化物酶,加入一抗兔抗人BTg-3 多克隆抗体(1∶100) 过夜孵育,加入二抗(1∶5 000) 孵育45 min,加入DAB显色3 min,苏木素染色5 min,氨水返蓝5 s,显微镜下观察免疫组织化学染色情况。结果判断:根据阳性细胞染色程度和范围进行分级。染色程度:无染色为0 分,浅黄色为1 分,棕黄色为2 分,棕褐 色 为3 分。 染 色 范 围: 显 色 细 胞 数<25%为1 分,25%≤显色细胞数≤50% 为2 分,50%≤显色细胞数≤75% 为3 分, 显色细胞数>75%为4 分。总积分=显色程度积分+显色范围积分。总积分0~3分判定为阴性,总积分≥4分判定为阳性[5]。
1.4细胞培养将甲状腺滤泡癌CGTHW-1 细胞和甲状腺滤泡上皮Nthy-ori 细胞置于含胎牛血清的DMEM 培养基中培养,每2~3 d 换液1 次,培养至细胞达80% 以上融合时采用胰蛋白酶进行消化,并进行传代培养,取第3 代CGTHW-1 和Nthy-ori细胞进行后续研究。
1.5 Western blotting法检测甲状腺滤泡癌CGTHW-1细胞和甲状腺滤泡上皮Nthy-ori细胞中BTg-3蛋白表达水平每组设7 个复孔,每孔2 mL,培养24 h,加入细胞裂解液,提取总蛋白,采用Bradford 法测定组织蛋白浓度,制备SDS-PAGE 凝胶, 取50 μg 蛋白上样, 80 V 恒压电泳, 湿法转膜,脱脂奶粉封闭1 h,加入一抗:兔抗人BTg-3多克隆抗体(1∶100), 过夜孵育; 加入二抗(1∶5 000) 孵育1 h,显影、曝光后,采用Image-Pro Plus6.0 软件分析条带灰度值,以β-actin 为内参照,计算目标蛋白表达水平。目标蛋白表达水平=目标蛋白条带灰度值/β-actin 条带灰度值。
1.6细胞分组和转染将甲状腺滤泡癌CGTHW-1细胞随机分为空白对照组、阴性对照组和BTg-3 过表达组。转染前1 d,取3 组CGTHW-1 细胞接种到6 孔板中,每组设7 个复孔,每孔4×105个细胞,加入含胎牛血清和双抗的DMEM 培养基过夜培养;细胞达85% 以上融合时进行转染。BTg-3 过表达组每孔加入10 μL 转染试剂和4 μg BTg-3 过表达载体培养,阴性对照组加入10 μL 转染试剂和4 μg 阴性对照载体培养,空白对照组不转染。6 h 后更换培养基,24 h 后移去病毒液加入完全培养基,再培养48 h 用于后续研究。采用Western blotting 法检测转染后各组CGTHW-1细胞的转染效率。转染效率=转染细胞数/总细胞数×100%。
1.7 CCK-8法检测各组甲状腺滤泡癌CGTHW-1细胞增殖活性取转染48 h 后甲状腺滤泡癌CGTHW-1 细胞,加入到96 孔培养板, 每孔3×103个细胞,每组设7 个复孔, 分别于24、 48 和72 h 时, 每 孔 加 入10 μL CCK-8 溶 液, 培 养2 h,采用酶标仪于波长450 nm 处测定各组细胞吸光度(A) 值,以A 值代表细胞增殖活性。
1.8平板克隆实验检测各组甲状腺滤泡癌CGTHW-1细胞克隆形成率取转染48 h 的CGTHW-1 细胞,接种到6 孔板上,每孔500 个细胞,每组设7 个复孔, 加入完全培养基, 培养14 d,见细胞克隆时弃去上清液,加入多聚甲醛静置30 min,加入结晶紫静置30 min,自然晾干,拍照观察,计算克隆形成率。克隆形成率=克隆形成数/接种细胞数×100%。
1.9 Transwell法检测各组甲状腺滤泡癌CGTHW-1细胞侵袭和迁移能力侵袭能力检测:取转染48 h的CGTHW-1 细胞,制成细胞悬液。Transwell 上室采用Matrigel 胶包被。 取200 μL 重悬细胞(含8×104个细胞) 加入Transwell 上室,置入培养箱中 培 养24 h, 擦 去 小 室 细 胞, 多 聚 甲 醛 固 定30 min,结晶紫染色30 min,显微镜下拍照,观察并计数200 倍视野下侵袭细胞数。迁移能力测定:Transwell 小室上室不用Matrigel 胶包被,其他步骤同侵袭能力检测实验。
1.10 Western blotting法检测各组甲状腺滤泡癌CGTHW-1细胞中Ki67、PCNA、Vimentin、E-cadherin、WNT1、β -catenin、GSK3 β和p-GSK3β蛋白表达水平取转染48 h 的甲状腺滤泡癌CGTHW-1 细胞,调整细胞浓度为2×105mL-1,接种至6 孔板中,每组设7 个复孔,每孔2 mL,培养24 h,加入细胞裂解液,提取总蛋白,BCA 法测定各组细胞蛋白浓度,经电泳、湿法转膜,脱脂奶粉封闭2 h, 加入一抗兔抗人Ki67 多克隆抗体(1∶200)、兔抗人PCNA多克隆抗体(1∶200)、兔抗人Vimentin多克隆抗体(1∶200)、兔抗人E-cadherin多克隆抗体(1∶200)、兔抗人WNT1 多克隆抗体(1∶300)、兔抗人β-catenin 多克隆抗体(1∶300)和兔抗人GSK3β 多 克 隆 抗 体(1∶300)、 兔 抗人p-GSK3β 多克隆抗体(1∶300) 过夜孵育,加入二抗(1∶2 000) 孵育2 h,ECL 发光,Image图像分析系统分析条带灰度值,以β-actin 为内参,计算目标蛋白表达水平。目标蛋白表达水平=目标蛋白条带灰度值/β-actin 条带灰度值。
1.11统计学分析采用SPSS 20.0 统计软件进行统计学分析。2 种组织中BTg-3 阳性表达率和各组细胞克隆形成率组间比较采用χ2检验,各组细胞增殖活性、侵袭细胞数、迁移细胞数和甲状腺滤泡癌CGTHW-1 细 胞 中 BTg-3、 Ki67、 PCNA、Vimentin 、 WNT1 、 β -catenin 、 p-GSK3 β 及E-cadherin 蛋白表达水平以±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD 检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1甲状腺滤泡癌组织和甲状腺滤泡腺瘤组织中BTg-3阳性表达率甲状腺滤泡癌组织中BTg-3 阳性表达率(30.00%,24/80) 低于甲状腺滤泡腺瘤组织(91.25%,73/80)(χ2=62.864,P<0.01)。见图1 (插页七)。
2.2甲状腺滤泡癌CGTHW-1细胞和甲状腺滤泡上皮Nthy-ori细胞中BTg-3蛋白表达水平甲状腺滤泡癌CGTHW-1 细胞中BTg-3 蛋白表达水平(0.14±0.03) 低于甲状腺滤泡上皮Nthy-ori 细胞(0.90±0.08)(t=34.484,P<0.01)。见图2。
2.3各组甲状腺滤泡癌CGTHW-1细胞中BTg-3蛋白表达水平与空白对照组(0.12±0.04) 和阴性对照组(0.14±0.03) 比较,BTg-3 过表达组甲状腺滤泡癌CGTHW-1 细胞中BTg-3 蛋白表达水平(0.93±0.06) 升高(P<0.01)。见图3。
2.4各组甲状腺滤泡癌CGTHW-1细胞增殖活性与空白对照组和阴性对照组比较,各时间点BTg-3 过表达组甲状腺滤泡癌CGTHW-1 细胞增殖活性降低(P<0.05)。见表1。

图2 Western blotting 法检测甲状腺滤泡癌CGTHW-1 细胞和甲状腺滤泡上皮Nthy-ori 细胞中BTg-3 蛋白表达电泳图Fig.2 Electrophoregram of expressions of BTg-3 protein in thyroid follicular carcinoma CGTHW-1 cells and thyroid follicular epithelial Nthy-ori cells detected by Westen blotting method

图3 Western blotting 法检测各组甲状腺滤泡癌CGTHW-1细胞中BTg-3 蛋白表达电泳图Fig.3 Electrophoregram of expressions of BTg-3 protein in thyroid follicular carcinoma CGTHW-1 cells in various groups detected by Western blotting method
表1 各组甲状腺滤泡癌CGTHW-1 细胞增殖活性Tab.1 Proliferation activities of thyroid follicular carcinoma CGTHW-1 cells in various groups (n=7,±s)

表1 各组甲状腺滤泡癌CGTHW-1 细胞增殖活性Tab.1 Proliferation activities of thyroid follicular carcinoma CGTHW-1 cells in various groups (n=7,±s)
*P<0.05 compared with blank control group;△P<0.05 compared with negative control group.
Group Blank control Negative control BTg-3 over-expression FP Proliferation activity(t/h) 24 0.48±0.05 0.49±0.06 0.40±0.05*△5.942 0.010 48 0.87±0.08 0.85±0.09 0.63±0.06*△20.757<0.001 72 1.44±0.12 1.45±0.11 0.95±0.09*△49.587<0.001
2.5各组甲状腺滤泡癌CGTHW-1细胞克隆形成率与空白对照组和阴性对照组比较,BTg-3 过表达组甲状腺滤泡癌CGTHW-1 细胞克隆形成率降低(P<0.05)。见图4 (插页七) 和表2。
2.6各组甲状腺滤泡癌CGTHW-1细胞侵袭和迁移细胞数与空白对照组和阴性对照组比较,BTg-3 过表达组甲状腺滤泡癌CGTHW-1 细胞侵袭和迁移细胞数减少(P<0.05)。见图5 (插页七)和图6 (插页七) 及表2。
表2 各组甲状腺滤泡癌CGTHW-1 细胞克隆形成率、侵袭细胞数和迁移细胞数Tab.2 Clone formation rates, number of invasion cells, and number of migration cells of thyroid follicular carcinoma CGTHW-1 cells in various groups (n=7,±s)

表2 各组甲状腺滤泡癌CGTHW-1 细胞克隆形成率、侵袭细胞数和迁移细胞数Tab.2 Clone formation rates, number of invasion cells, and number of migration cells of thyroid follicular carcinoma CGTHW-1 cells in various groups (n=7,±s)
*P<0.05 compared with blank control group;△P<0.05 compared with negative control group.
Group Blank control Negative control BTg-3 over-expression FP Clone formation rate(η/%)29.64±2.79 31.02±2.84 14.25±2.61*△80.310<0.01 Number of invasion cells 215.42±19.46 213.54±20.31 73.24±15.67*△134.711<0.01 Number of migration cells 209.51±15.62 207.84±16.02 84.19±14.32*△153.737<0.01
2.7各组甲状腺滤泡癌CGTHW-1细胞中Ki67、PCNA、Vimentin和E-cadherin蛋白表达水平与空白对照组和阴性对照组比较,BTg-3 过表达组甲状 腺滤泡癌CGTHW-1 细胞 中Ki67 、 PCNA 和E-cadherin 蛋白表达水平 降 低 (P<0.05 ),E-cadherin 蛋白表达水平升高(P<0.05)。见图7和表3。
2.8各组甲状腺滤泡癌CGTHW-1细胞中WNT1、β-catenin、GSK3β和p-GSK3β蛋白表达水平与空白对照组和阴性对照组比较,BTg-3 过表达组甲状腺滤泡癌CGTHW-1 细 胞 中WNT1 、β -catenin 和p-GSK3β 蛋 白 表 达 水 平 降 低(P<0.05)。见图8 和表4。

表3 各组CGTHW-1 细胞中Ki67、PCNA、Vimentin 和E-cadherin 蛋白表达水平Tab.3 Expression levels of Ki67, PCNA, Vimentin ,and E-cadherin proteins in CGTHW-1 cells in various groups(n=7,x±s)

表4 各组CGTHW-1 细胞中WNT1、β-catenin、GSK3β 和p-GSK3β 蛋白表达水平Tab.4 Expression levels of WNT1, β-catenin, GSK3β and p-GSK3β proteins in CGTHW-1 cells in various groups(n=7,x±s)
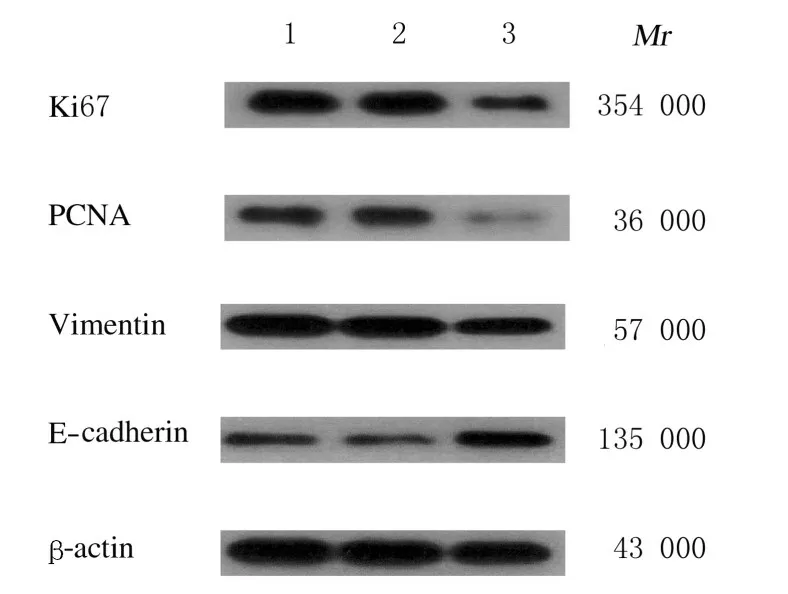
图7 Western blotting 法检测各组甲状腺滤泡癌CGTHW-1细胞中Ki67、PCNA、Vimentin 和E-cadherin 蛋白表达电泳图Fig.7 Electrophoregram of expressions of Ki67, PCNA,Vimentin, and E-cadherin proteins in thyroid follicular carcinoma CGTHW-1 cells in various groups detected by Western blotting method

图8 Western blotting 法检测各组甲状腺滤泡癌CGTHW-1细胞中WNT1、β-catenin、GSK3β 和p-GSK3β 蛋白表达电泳图Fig.8 Electrophoretogram of expressions of WNT1,β -atenin, GSK3β ,and p-GSK3β proteins in thyroid follicular cacinoma CGTHW-1 cells in various groups detected by Western blotting method
3 讨 论
BTg 家族成员除具有抑制细胞增殖能力外,还具有调控细胞生长、促进细胞分化和成熟、对受损伤的DNA 进行修复等功能。BTg-3 为BTg 家族成员之一,也具有抑制细胞增殖、调控细胞生长、修复受损伤的DNA、 促进细胞分化和成熟等作用;在BTg-3 的结构域中存在1 个 特 异 性 的N 端 和A 盒,N 端和A 盒共同作用于E2FI,可有效抑制E2FI-DPI 转录复合物的生成, 阻止癌细胞进入S 期,从而对癌细胞的增殖发挥抑制作用[6-7]。目前有不少学者对BTg-3 在恶性肿瘤中的作用进行研究,如下调BTg-3 表达可促进非小细胞肺癌细胞增殖、抑制细胞凋亡[8];靶向下调BTg-3 表达可促进肾癌细胞的生长和迁移[9];过表达BTg-3 可抑制结直肠癌的表型和侵袭行为[10];调节BTg-3 甲基化状态可抑制大肠癌细胞增殖、诱导细胞凋亡[11]。
上述研究均表明:BTg-3 作为抑癌基因在多种恶性肿瘤的增殖、侵袭和迁移中发挥重要作用。本研究结果显示:甲状腺滤泡癌组织和细胞中BTg-3表达水平降低;过表达BTg-3 可降低甲状腺滤泡癌细胞增殖活性、细胞克隆形成率、侵袭和迁移细胞数, 降低细胞中Ki67、 PCNA 和Vimentin 蛋白表达水平,升高E-cadherin 蛋白表达水平。Ki67 在增生细胞核中普遍存在,为增生细胞核的标志性抗原,可比较好地反映细胞核的增殖能力。PCNA 为细胞增殖蛋白,可反映细胞的增殖状态。Ki67 和PCNA 为恶性肿瘤生长相关蛋白,其水平升高可反映恶性肿瘤细胞增殖能力增加。上皮-间质转化为介导恶性肿瘤侵袭迁移的关键步骤,其特点为使上皮细胞失去特性,转化为具有间充质和侵袭表型,上皮-间质转化程度可反映恶性肿瘤细胞的侵袭迁移能力。在上皮-间质转化过程中,上皮细胞标志分子E-cadherin 表达水平降低,间质细胞标志分子Vimentin 表达水平升高。本研究结果表明:过表达BTg-3 可抑制甲状腺滤泡癌细胞的增殖、侵袭和迁移能力,BTg-3 也可抑制甲状腺滤泡癌增殖、侵袭和迁移,与本课题组前期研究[4]结果相似,表明BTg-3 在甲状腺滤泡癌中具有抑癌作用, 考虑BTg-3 对甲状腺滤泡癌细胞增殖有抑制作用,故根据本研究结果分析BTg-3 对甲状腺滤泡癌侵袭和迁移的影响可能也与细胞增殖受到抑制有关联,本研究未对其进行详细探讨,拟在未来研究中进行专项研究。
本研究结果显示:过表达BTg-3 可降低甲状腺滤 泡 癌 细 胞 中WNT1、 β-catenin 和p-GSK3β 蛋 白表达水平。WNT1 和β-catenin 为WNT/β-catenin 信号通路的主要成员,胞浆中β-catenin 水平可决定WNT 信号传递, 为WNT 的主要效应分子,GSK3β 在 静 息 状 态 下 可 抑 制β -catenin 表 达,GSK3β 被磷酸化后失去活性,升高胞浆中β-catenin水平[12-13]。本研究结果表明:过表达BTg-3 可抑制甲状腺滤泡癌细胞中WNT/β -catenin 信号通路。WNT/β-catenin 信号通路在恶性肿瘤细胞的增殖、凋亡、侵袭和迁移等过程中发挥重要作用,该通路的异常激活与甲状腺癌的发病和进展关系密切[14],WNT/β-catenin 可通过靶向调控细胞的上皮-间质转化影响恶性肿瘤细胞的侵袭和迁移过程[15-16]。BTg-3 可通过WNT/β-catenin 信号通路发挥作用,如BTg-3 过表达通过调节AKT /GSK3β/β-catenin信号转导抑制卵巢上皮癌细胞的增殖和侵袭[17];BTg-3 过表达通过Wnt /β-catenin 信号通路抑制大肠癌SW480 细胞的增殖和侵袭[18]。 结合WNT/β -catenin 信号通路在甲状腺癌发病中的作用和BTg-3 可通过WNT/β-catenin 发挥作用的结论并分析本研究结果表明:BTg-3 可能通过抑制WNT/β -catenin 信号通路激活,从而抑制甲状腺滤泡癌细胞上皮-间质转化过程,抑制其增殖、侵袭和迁移能力,在甲状腺滤泡癌发生发展过程中发挥抑癌作用。
综上所述,甲状腺滤泡癌组织和细胞中BTg-3表达水平降低, 过表达BTg-3 可能通过抑制WNT/β-catenin 信号通路抑制甲状腺滤泡癌细胞的增殖、侵袭和迁移。
