检测水痘-带状疱疹病毒糖蛋白水平双抗体夹心ELISA 法的建立和验证
2020-12-15朱琨莹郭世杰袁若森陈晓旭衣延明郑柏松姜春来
朱琨莹, 郭世杰, 袁若森, 潘 东, 张 春, 陈晓旭, 衣延明, 杨 阳, 郑柏松, 姜春来
(1.吉林大学第一医院艾滋病与病毒研究所,吉林 长春 130021;2.吉林大学第一医院新生儿科,吉林 长春130021;3.长春百克生物科技股份公司,吉林 长春 130012;4.吉林大学生命科学学院微生物免疫系,吉林 长春 130012)
水痘- 带状疱疹病毒(varicella zoster virus,VZV) 属疱疹病毒科、α-疱疹病毒亚科,以人类为其唯一自然宿主且具有嗜神经性[1-3]。水痘多好发于儿童,初次感染会出现发热和皮疹等症状,病愈后少量病毒会终身潜伏于宿主感觉神经节的神经细胞中[4-6]。若宿主高龄或机体免疫力降低时,潜伏的病毒会被再次激活并大量增殖,对皮肤细胞和局部神经产生损伤,从而形成带状疱疹[7]。带状疱疹的患病率和严重程度随着年龄增加而升高,尤其50 岁后明显升高[8-10],可反复发作,愈后神经痛可持续数月甚至数年,严重影响患者的身心健康。目前,对于水痘和带状疱疹的治疗尚无特效方法,接种疫苗是唯一有效且可靠的预防控制手段。
我国现行用于预防水痘和带状疱疹疾病的疫苗中主要成分多为水痘减毒活病毒OKA 株[11]。在疫苗的研发和生产过程中,病毒滴度作为其主要质控项目,需要在多个步骤中进行多次检测。经典的VZV 滴度检测方法(药典方法) 为蚀斑法[12],该方法包括培养细胞、感染病毒、染色、计数和判定等步骤,检测周期至少7 d (不包括染毒前细胞传代的时间),因此在某些需要根据病毒滴度结果进行下一步骤操作的生产环节中,该方法会成为研发与生产的限速环节。同时,该方法需要检测人员具有较强的无菌操作技术和相关实验经验,来完成细胞建库、复苏和传代等步骤及斑块的人工计数;且检测细胞均为人二倍体细胞,在细胞库建立和维护方面花费的成本较大。有研究[13]采用PCR 法扩增病毒以快速检测VZV 病毒滴度,可将检测时间缩短至24 h (感染病毒后),且该方法与蚀斑法检测结果无明显差异,但要根据VZV 病毒基因设计引物和探针,试验过程需要PCR 法与荧光定量检测系统,对检测设备的要求较高。因此,开发一种能快速、准确、低成本、且对人员操作经验要求低的检测病毒滴度的方法,对蚀斑法进行替代,作为疫苗研发与生产过程中的检测方法,可大大加快研究进程,缩短生产过程中的检测时间。
VZV 表面的糖蛋白至少有8 种,集中存在于病毒的囊膜和感染细胞的胞膜中,与病毒的致病性与免疫原性有密切关系[14]。有报道[15-16]针对VZV 表面糖蛋白进行ELISA 双抗体夹心定量方法的开发,但该方法中应用的单克隆抗体为杂交瘤所产生,且酶标抗体为IgG2a 类型,抗体的批间差异较大,不易质控,从而导致方法稳定性差。本研究以IgG1类型的针对空间构象表位的基因工程单抗为基础,针对抗原性最强的IgE 糖蛋白进行研究,建立更稳定、 更准确的ELISA 双抗体夹心定量检测方法,为疫苗的研发和质控提供依据。
1 材料与方法
1.1疫苗、病毒和参考品
水痘减毒活疫苗(Var)、水痘减毒活疫苗参考品、百白破疫苗(DPT)、狂犬疫苗(PM 株) 和流感减毒活疫苗由长春百克生物制品有限公司提供,流感裂解灭活疫苗为长春生物制品所有限责任公司产品,狂犬疫苗(aG 株) 为宁波荣安生物药业有限公司产品,HPV-18 型纯化液由吉林大学生命科学院实验室提供。
1.2主要试剂和仪器
抗VZV 糖蛋白的基因工程抗体VZV-mAb-01、VZV-mAb-02、 VZV-mAb-03、 VZV-mAb-04、VZV-mAb-05、 VZV-mAb-HRP-01、 VZV-mAb-HRP-02 和VZV-mAb-HRP-03 由长春百克生物科技股份公司提供, 人血清白蛋白(human serum albumin, HSA) 购自奥地利国奥克特珐玛公司,牛血清购自北京希凯创新科技有限公司,脱脂奶粉购自蒙牛乳业, 牛血清白蛋白(bovine serum albumin, BSA) 购自新西兰Proliant New Zealand公司,精氨酸购自上海协和氨基酸有限公司,谷氨酸钠购自湖南新绿方药业有限公司,尿素购自湖南芙蓉制药有限公司,氯化钠购自河北华晨药业有限公司,海藻糖、蔗糖、葡萄糖、甘露醇和甘氨酸购自北京鼎国昌盛生物技术有限责任公司。全自动酶标仪(iMark) 和微孔板洗板机(1575) 购自美国Bio-Rad 公 司, CO2培 养 箱(311) 购 自 美 国Thermo 公 司, 电 子 天 平(A1104) 购 自 美 国Mettler Toledo 公司。
1.3检测方法的建立
1.3.1 筛选捕获抗体和酶标抗体组合 根据说明书所提供的浓度, 将5 种捕获抗体(VZV-mAb-01、 VZV-mAb-02、 VZV-mAb-03、 VZV-mAb-04和VZV-mAb-05) 分 别 稀 释 至1 mg·L-1, 每 孔100 μL 包被 酶标板; 抗 原为100 倍稀释的VZV,加入阳性孔中, 对应的阴性孔加入1%BSA [含1% BSA 的0.5% 磷酸盐吐温缓冲液(PBST),pH 值为7.4±0.1] 溶液;将3 种酶标抗体(VZVmAb-HRP-01、 VZV-mAb-HRP-02 和VZV-mAb-HRP-03) 分别稀释至0.1 g·L-1,将每种酶标抗体稀释为低、中和高浓度,分别加入不同捕获抗体包被的酶标板中,以确保每种捕获抗体与每种酶标抗体均进行交叉实验,检测450 nm 处捕获抗体与酶标抗体的阳性样品(VZV) 与阴性样品(1%BSA) 的吸光度(A) 值,其比值即阳性值/阴性值(positive value/negative value, P/N), P/N 比值越大, 对应的捕获抗体与酶标抗体的组合越优[17-18]。
1.3.2 捕获抗体和酶标抗体工作浓度的选择 将“1.3.1” 步骤中筛选出来最优包被抗体与酶标抗体组合用棋盘滴定法进行最适浓度的筛选。将捕获抗体以1∶2 500(900 μg·L-1)、1∶5 000(450 μg·L-1)、1∶7 500 (338 μg·L-1) 和1∶10 000(225 μg·L-1) 进行包被,酶标抗体分别以1∶2 000 (0.28 μg·L-1)、1∶4 000(0.14 μg·L-1)、1∶6 000 (0.09 μg·L-1)、1∶8 000 (0.07 μg·L-1) 和1∶10 000 (0.05 μg·L-1)进行交叉实验,以P/N 比值最大值所对应的浓度作为包被抗体和酶标抗体的最适工作浓度。
1.3.3 包被条件的选择 包被液的选择:分别以0.05 mol·L-1CBS 缓冲液(pH 9.6)、0.05 mol·L-1PBS 缓冲液(pH 7.4)、0.05 mol·L-1Tris-HCl 缓冲液(pH 6.6) 和0.05 mol·L-1Tris-HCl 缓冲液(pH 8.8) 为包被抗体稀释液,稀释相同浓度的包被抗体进行酶标板包被,以P/N 比值最大值所对应的该种包被稀释液为最适包被液。包被温度和时间的选择:以最适包被液包被酶标板, 分别置于4℃过夜,采用37 ℃、1 h,37 ℃、2 h 和37 ℃、3 h 条件进行包被,其他步骤均相同,检测450 nm处A 值,综合A 值和P/N 比值,选择2 个数据均较大的包被条件为最适包被条件[19]。
1.3.4 封闭条件的选择 分别以 1%BSA、3%BSA (含3% BSA 的0.5% PBST 缓 冲 液,pH 值为7.4±0.1)、5% 脱脂奶粉和10% 新生牛血清作为封闭剂,其他步骤均相同,综合P/N 比值最大值和检测值的范围确定最适封闭剂。对比不同封闭条件(37 ℃、1 h 和37 ℃、2 h) 下的检测值,确定最适封闭条件。
1.3.5 夹心抗原和酶标抗体反应条件的选择 样品稀释液的选择:分别以1%BSA、0.5%PBST (含0.5% 吐 温-20 的PBS 缓 冲 液,pH 值 为7.4±0.1)和PBS 缓冲液(pH 值为7.4±0.1) 为样品稀释液,稀释VZV 与酶标抗体,以P/N 比值最大值所对应的该种稀释液为最适样品稀释液。
夹心抗原与酶标抗体反应时间的确定:采用最适包被液稀释包被抗体至最适浓度后,稀释相同浓度的夹心抗原,保证后续步骤中酶标抗体37 ℃、1 h 反应条件下,夹心抗原37 ℃分别作用30、45、60、75 和90 min,采用ELISA 法检测A (450) 值并计算P/N 比值,以确定夹心抗原的最适反应时间;夹心抗原于37℃、1 h 反应条件下,酶标抗体于37℃条件下分别作用30、45、60、75 和90 min,采用ELISA 法检测A (450) 值并计算P/N 比值,以确定酶标抗体最适反应时间。
1.3.6 显色条件的选择 显色温度为37℃时,采用TMB 终 点 法 测 定 显 色5 、 10 、 15 、 20 、 25 和30 min 时的A (450) 值,并计算P/N 比值。综合P/N 比值与阴性对照的A (450) 值,选择P/N 比值较大且阴性对照A (450) 值较小的显色时间为最适显色时间。
1.4检测方法的验证
1.4.1 特异性验证 采用建立的双抗体夹心法以相同的样品稀释倍数(10、30、90 和270 倍) 检测Var、 冻干人用狂犬病疫苗aG 株与PM 株(RabaG、 Rab-PM)、 冻干流感减毒活疫苗(LAIV)、流感裂解灭活疫苗(TIV)、DPT 和HPV-18 型病毒纯化液(HPV-18);市售多家水痘减毒活疫苗中辅料成分: HSA、海藻糖、谷氨酸钠、蔗糖、葡萄糖、尿素、精氨酸、甘氨酸、甘露醇和氯化钠,以验证方法的特异性[20-21]。
1.4.2 线性验证 将Var 参考品进行2 倍系列稀释,最高稀释至16 384 倍,采用建立的双抗体夹心方法进行检测[20]。以病毒滴度对A (450) 值进行直线回归分析,选取至少连续6 点对应曲线的R2>0.95为线性范围。后对线性范围内至少6 个浓度在不同时间进行6 个独立批次的校准曲线的线性验证。
1.4.3 准确性和精密性验证 批内回收率与精密度:包被同一批酶标板,将3 份参考品分别稀释为506 (定量下限)、1 013 (低浓度)、1 520 (中浓度)、2 027 (高浓度) 和2 534 PFU·mL-1(定量上限),每份参考品的每个稀释度进行4 次重复检测,同时建立标准曲线和回归方程计算样品的病毒滴度,计算批内变异系数(coefficient of variation,CV) 及回收率[20]。批间回收率与精密度:将参考品分为3 块板、3 d 分别稀释为上述浓度,每个稀释度进行8 次重复检测,同时建立标准曲线和回归方程回算样品的病毒滴度,计算CV 和回收率。
2 结 果
2.1检测方法的优化
2.1.1 捕获抗体和酶标抗体最优组合 捕获抗体VZV-mAb-03 和酶标抗体VZV-mAb-HRP-02 的组合P/N 比值为5.9,远高于其他组合(1.0~2.6),故选用该组合为最优组合,并继续进行方法的优化和验证。捕获抗体和酶标抗体的筛选P/N 比值结果见表1。
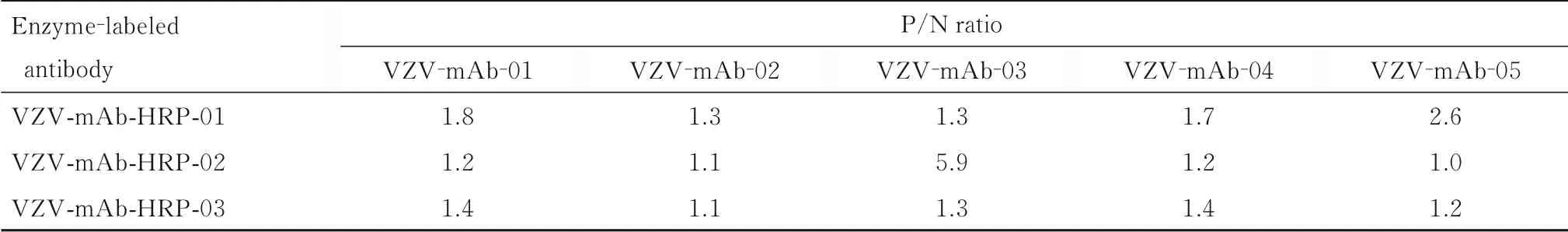
表1 捕获抗体和酶标抗体组合筛选P/N 比值Tab.1 P/N ratios screened by combination of capture antibodies and enzyme-labeled antibodies
2.1.2 捕获抗体和酶标抗体的最适工作浓度VZV-mAb-03 和VZV-mAb-HRP-02 组合棋盘滴定法确定的A (450) 值见表2,根据结果可确定捕获抗体VZV-mAb-03 的最适浓度范 围 为1 ∶2 500~1 ∶7 500,酶标抗体VZV-mAb-HRP-02 的最适浓度范围为1∶4 000~1∶8 000,二者的稀释倍数的乘积为2 000 ~3 000 万。在后续实验中,取VZVmAb-03 和VZV-mAb-HRP-02 的 稀 释 度 均 以1∶5 000 为最适浓度。
2.1.3 最适包被条件 在3 种VZV 浓度条件下,Tris-HCl (pH 值为8.7±0.1) 作为包被液的P/N比值均最大, 包被效果最好, 因此选择Tris-HCl(pH 值为8.7±0.1) 为最适包被液。4 种包被液包被效果的P/N 值见图1。
4 种包被条件的阴性A (450) 值相差很小,阳性A (450) 值与P/N 比值呈现相同的趋势,4 ℃过夜包被的P/N 比值最大,确定最适包被条件为4 ℃过夜(18 h)。包被温度和时间的A (450) 值及P/N 值见表3。
2.1.4 最适封闭条件 不同种类封闭液和相同浓度VZV 条件下,封闭2 h 时阳性A (450) 值约为封闭1 h 时的1.2~1.6 倍,差别较大;而封闭2 h 时阴性A (450) 约为封闭1 h 的0.8~1.1 倍,差别较小, 可 确 定 最 适 封 闭 条 件 为37 ℃、 2 h。 以1%BSA 为封闭剂时P/N 比值最大,为10.32,因此选择1%BSA 为最适封闭剂。封闭条件和封闭液筛选结果见表4。
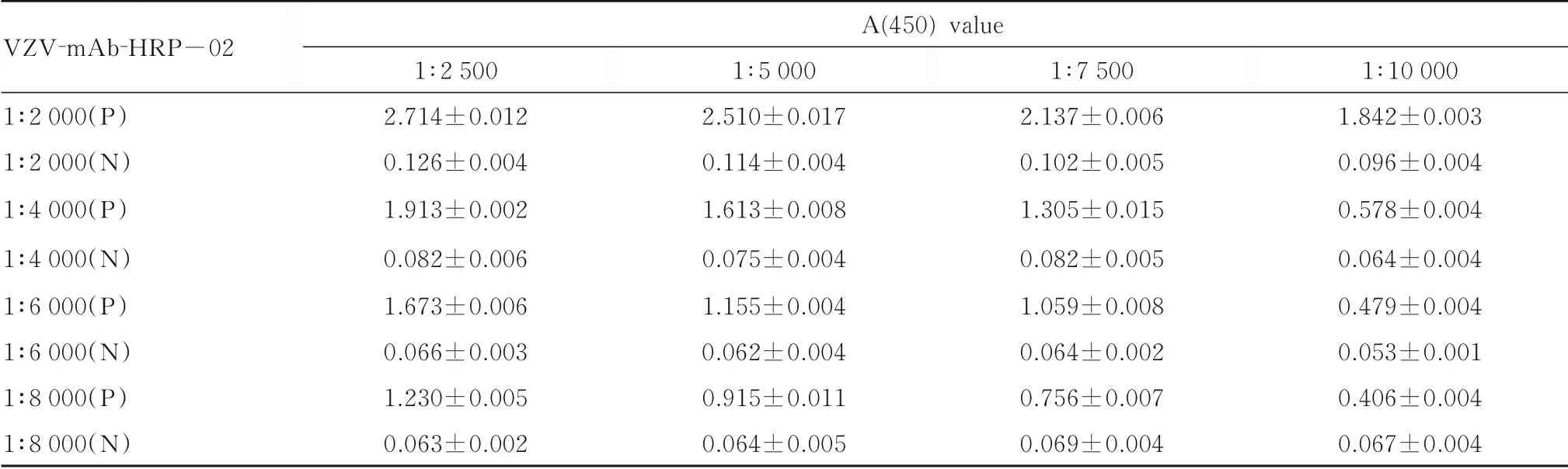
表2 VZV-mAb-03 和VZV-mAb-HRP-02 组合棋盘滴定法确定的A(450)值Tab.2 A(450) values identified by checkerboard titration with VZV-mAb-03 and VZV-mAb-HRP-02 (x±s)
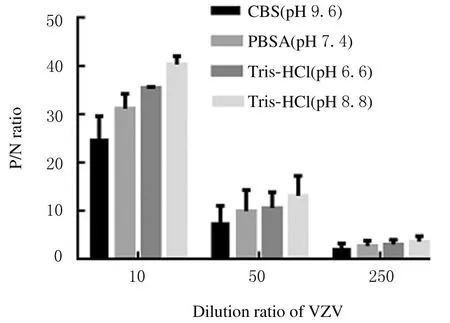
图1 4 种包被液包被效果的P/N 比值Fig.1 P/N ratios of coating effects of 4 kinds of coating solution
2.1.5 最适夹心抗原和酶标抗体反应条件3 种VZV 浓度条件下,以PBST 为样品稀释液所对应的P/N 比值均为最高,因此,选择PBST 为最适样品稀释液。3 种样品稀释液稀释VZV 与酶标抗体的P/N 比值见图2。
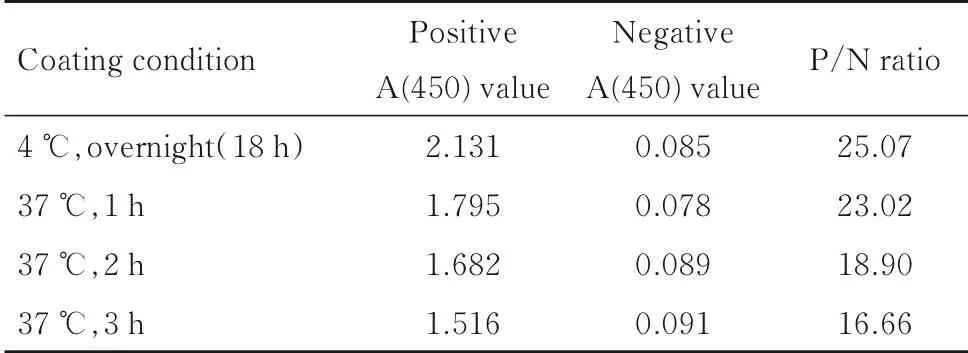
表3 包被温度和时间的A(450)值及P/N 比值Tab.3 A(450)values and P/N ratios of coating temperature and time
随着反应时间的增加,夹心抗原和酶标抗体的P/N 比值均呈明显升高趋势,2 次反应时间分别达到60 min 时,P/N 比值增加至较高水平,且基本稳定。因此,夹心抗原和酶标抗体的最适反应时间均为60 min。当反应温度为37℃时,夹心抗原与酶标抗体反应时间对应的P/N 比值见图3。
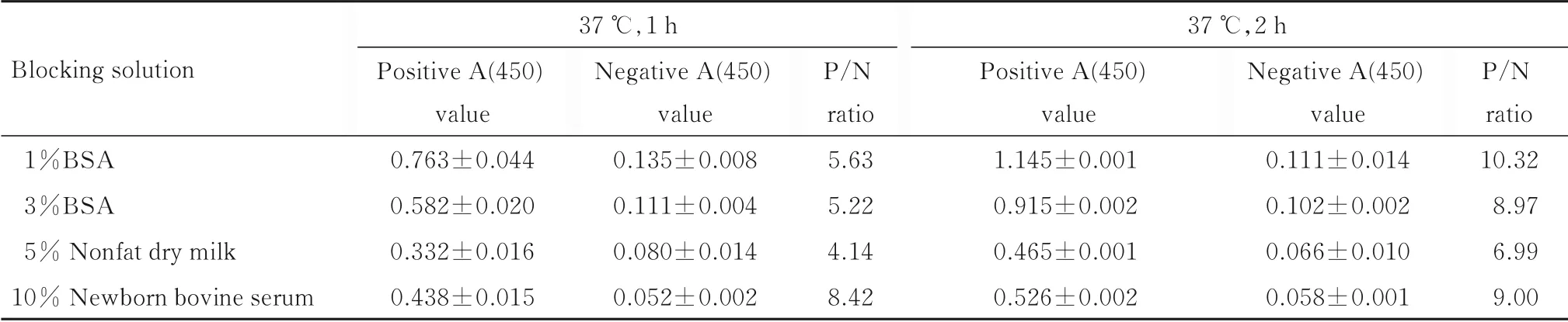
表4 封闭条件和封闭液筛选结果Tab.4 Screening results of blocking conditions and blocking solutions (x±s)
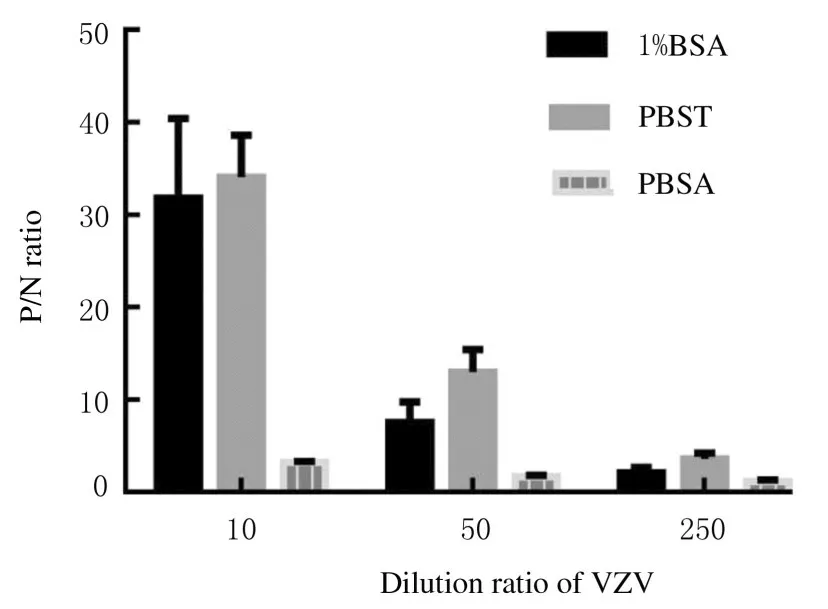
图2 3 种样品稀释液稀释VZV 和酶标抗体的P/N 比值Fig.2 P/N ratios of 3 kinds of sample dilutions in diluting VZV and enzyme-labeled antibody
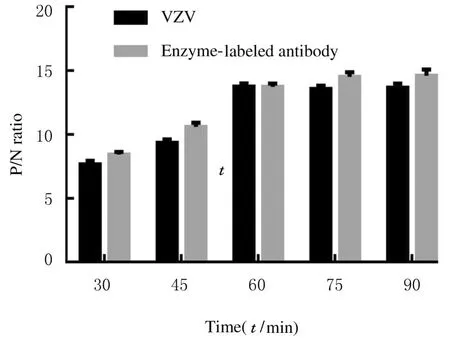
图3 夹心抗原和酶标抗体的反应时间对应的P/N 比值Fig.3 P/N ratios corresponding to reaction time of sandwich antigen and enzyme-labeled antibody
2.1.6 最适显色条件 随着显色时间的增加,阳性A(450) 值、阴性A (450) 值和P/N 比值均呈升高趋势,但随着时间的增加, 相邻5 min 的阳性A(450) 差值呈递减趋势,而阴性A(450)值不断增加使得P/N 比值变化趋于平缓。 综合阴性值<0.1、P/N比值尽可能大这2个条件,显色时间为10~20 min均符合要求。当显色15 min 时,阳性A (450) 值接近2.0,阴性A (450) 值小于0.1,且P/N 比值较大,10 min 与15 min 的P/N 比值差值较小,因此,选择37 ℃、15 min 为最适显色条件。显色温度为37 ℃时不同显色时间的A (450) 值和P/N 比值见表5。
2.2方法的初步验证
2.2.1 特异性 选择Var、 冻干人用狂犬病疫苗(aG 株与PM 株)、LAIV、TIV、DPT、HPV-18型病毒纯化液、 HSA、 海藻糖、 谷氨酸钠、 蔗糖、葡萄糖、尿素、精氨酸、甘氨酸、甘露醇和NaCl进行检测,检测结果见图4 和图5,可见其他人用疫苗及辅料成分平均A (450) 值均<0.2,判定为阴性(以阴性值的2.1 倍作为Cut-off 值)。该方法的检测结果与Var 的稀释度呈剂量依赖性,而与其他人用疫苗及其辅料成分无交叉反应, 特异性良好。
2.2.2 线性和定量限度 经6 批次重复检测,抗原病毒滴度在 500~2 600 PFU·mL-1范 围 内 与A (450) 值呈良好的线性关系,回归方程分别为Y1=0.000 745 8X+0.362 1、 Y2=0.000 617 0X+0.468 2、 Y3=0.000 525 0X+0.553 7、 Y4=0.000 614 6X+0.459 3、 Y5=0.000 846 4X+0.325 1、 Y6=0.000 473 4X+0.569 3,R2分 别 为0.984 3、 0.974 5、 0.960 1、 0.973 5、 0.959 3 和0.970 8, 均R2>0.95, 定 量 限 度 为500 PFU·mL-1。见图6。
2.2.3 准确性和精密性批内回收率与精密度回收率为82.2%~115.7%, 批内CV<10.2%, 符合定量下限与定量上限的准确性与精密性为75%~125%, 其他校正点的准确性与精密性为80%~120%。见表6。
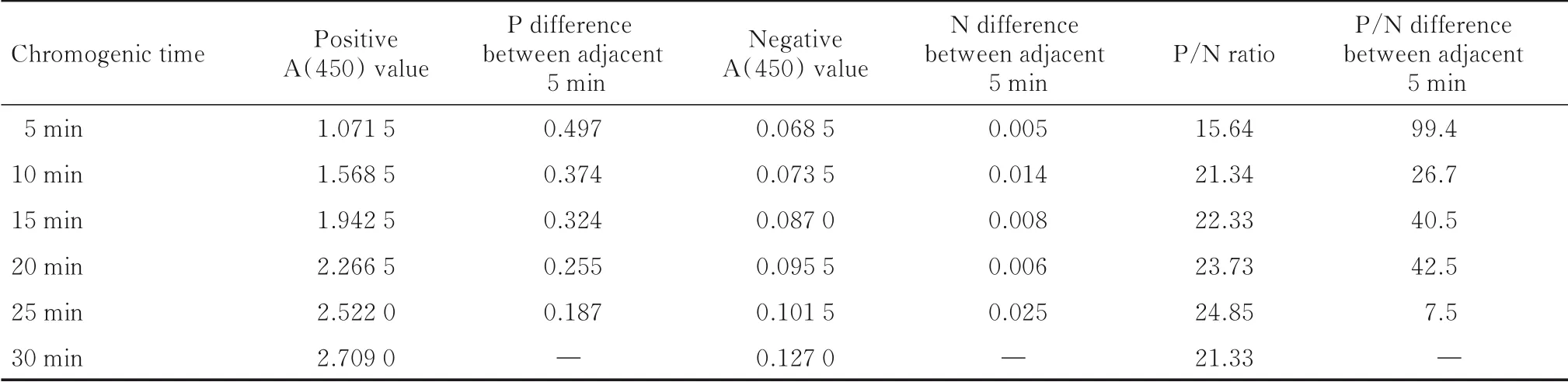
表5 不同显色时间的A(450)值和P/N 比值Tab.5 A(450) values and P/N ratios of different color reaction time
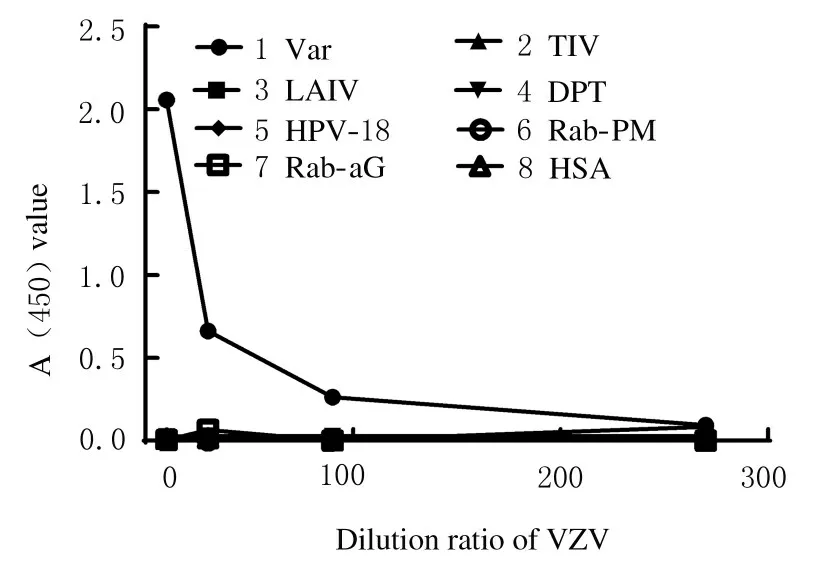
图4 不同病毒疫苗和HSA 的平均A(450)值Fig.4 Average A(450)values of different virus vaccines and HSA
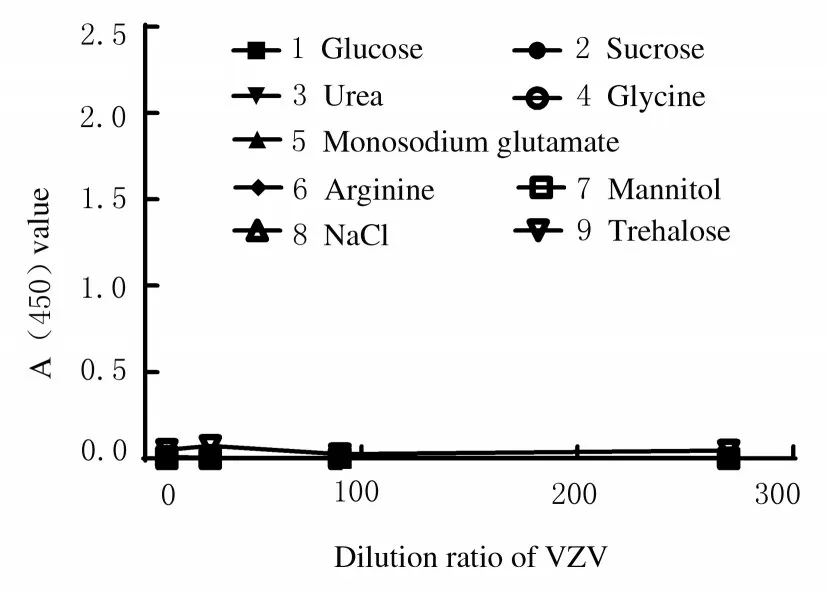
图5 其他辅料的平均A(450)值Fig.5 Average A(450)values of other ingredients
批间回收率和精密度: 回收率为80.5%~118.6%, 板内CV<17.4%, 板间CV<14.9%,符合定量下限与定量上限的准确性与精密性为75%~125%, 其他校正点的准确性与精密性为80%~120%。见表7。
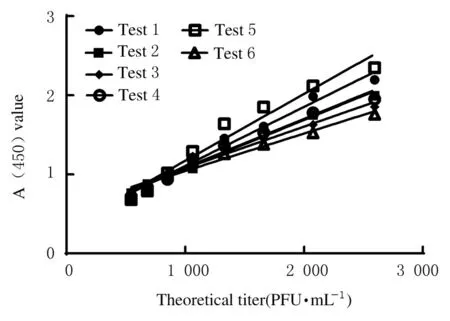
图6 抗原病毒滴度和A(450)值的线性回归验证曲线Fig.6 Linear regression validation curves of antigen virus titer and A (450) values
3 讨 论
本方法中捕获抗体为抗VZV 糖蛋白的单克隆抗体(VZV-mAb-01、 VZV-mAb-02、 VZV-mAb-03、 VZV-mAb-04 和VZV-mAb-05), 酶标抗体为与其对应的辣根过氧化物酶标记的单克隆抗体(VZV-mAb-HRP-01、 VZV-mAb-HRP-02 和VZVmAb-HRP-03), 所 有 抗 体 皆 识 别VZV 表 面 糖 蛋白,通过基因工程构建,在CHO 细胞中表达纯化后定量。经过对8 种单抗进行两两交叉筛选,得到了1 对对VZV 的特异性极好的夹心抗体—VZVmAb-03 和VZV-mAb-HRP-02,同时确定了最适包被条件、捕获抗体最适工作浓度、最适封闭条件、最适封闭液、最适样品稀释液、酶标抗体最适工作浓度及最适显色条件,全方位地对该方法进行了优化,使得该方法可快速、有效地检测VZV 糖蛋白水平。
该方法验证结果显示:该方法对VZV 具有良好的特异性,而对疫苗生产过程中需要引入的如冻干保护剂中的小分子、大分子均无交叉反应;将病毒滴度和A (450) 值进行线性回归, R2>0.95,可见两者具有显著的线性相关性, 线性范围内(500~2 600 PFU·mL-1) 准确性和精密性良好。
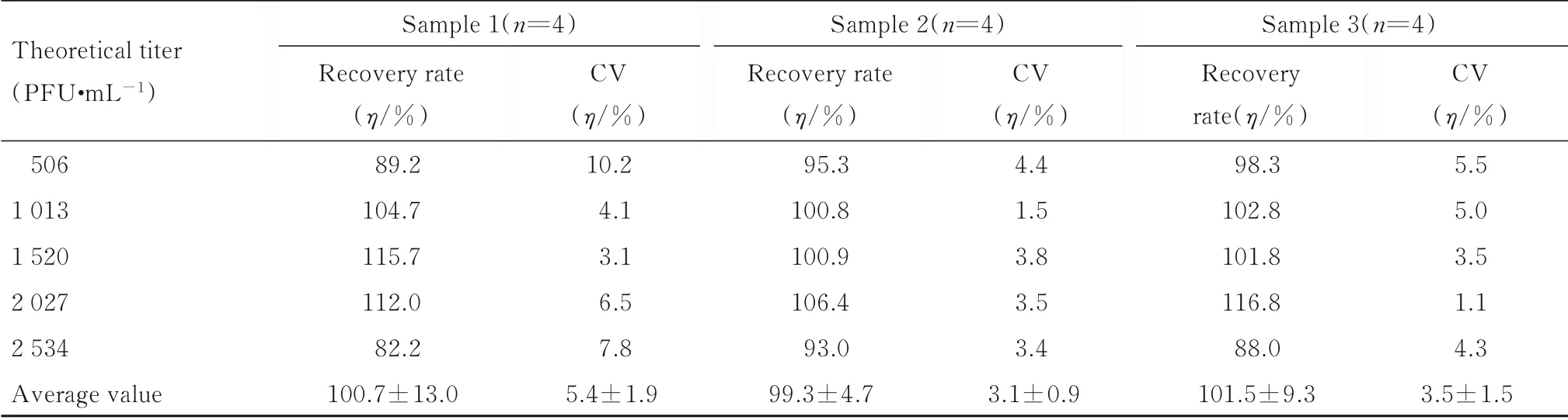
表6 批内准确性和精密性验证结果Tab.6 In-batch verification results of accuracies and precisions
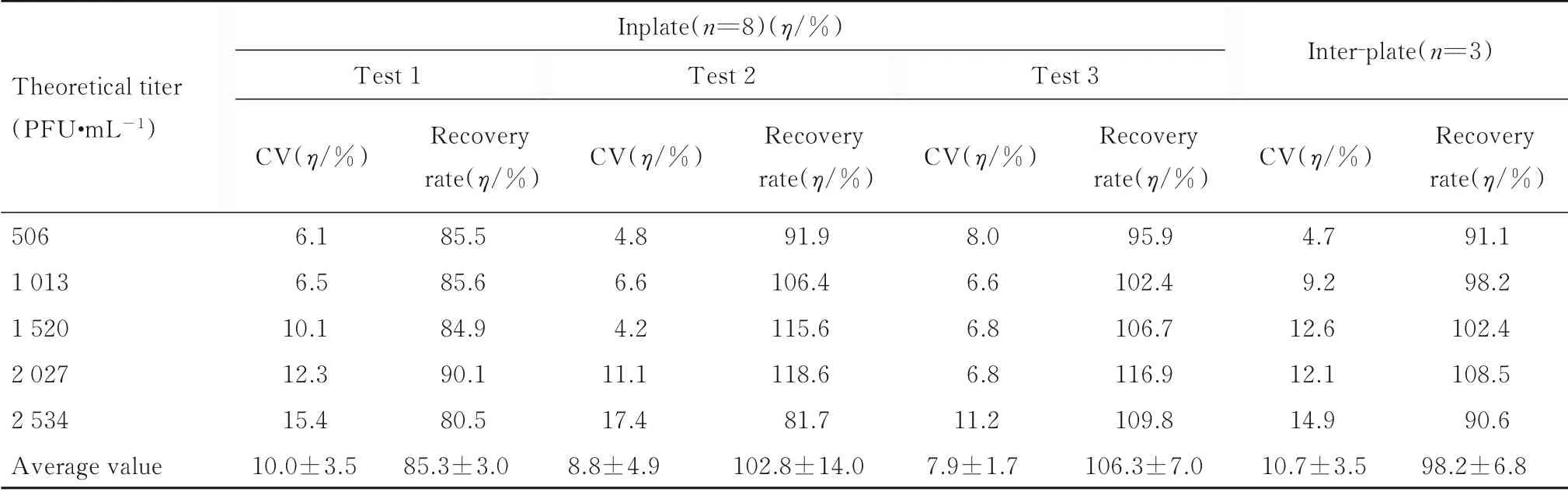
表7 批间准确性和精密性验证结果Tab.7 Batch to batch verification results of accuracies and precisions
以标准曲线中间点1 500 PFU·mL-1作为示例进行病毒滴度计算,其回收率允许范围为80%~120%,则回收浓度为1 200~1 800 PFU·mL-1,此时样品稀释倍数约为20 倍, 计算病毒滴度为4.38~4.56 lg PFU·mL-1。 对比VZV 滴定国家参考品标示的病毒滴度为(4.3±0.5) lg PFU·mL-1,其滴度范围为3.8~4.8 lg PFU·L-1,采用该方法检测并计算得到的病毒滴度的范围更精确,这更好地保证了研发过程中数据的准确性。由于ELISA法检测针对的是病毒表面的糖蛋白水平,不能区分病毒是否具有感染性,相对蚀斑法中检测的是具有感染性的活病毒的滴度,只采用该方法完全代替蚀斑法可能造成病毒滴度检测结果偏高的后果。在实际工作中,可将该方法用作中间环节检测以快速判断病毒滴度,缩短检测周期,加快相关研发进程;而在质量放行环节中,可联合该法与蚀斑法共同检测, 以确保样品符合放行标准。 本研究建立的ELISA 检测方法适合水痘病毒灭活疫苗与基因工程重组疫苗的研究,后续会进一步研究并扩大应用范围。
综上所述,该方法的建立可低成本、快速、有效和准确地检测VZV 糖蛋白水平,为水痘疫苗的生产质控及效价测定方法的替代奠定了基础。
