北柴胡多糖对D-半乳糖致衰老模型小鼠的保护作用及其机制
2020-12-15许梦然王迦琦高婧雯葛俊宏侯俊宇李明慧刘艳波
许梦然, 王迦琦, 高婧雯, 葛俊宏, 侯俊宇, 李明慧, 刘艳波, 孙 新
(1.北华大学医学院病原生物学教研室,吉林 吉林132013;2.吉林省分子老年医学重点实验室,吉林 吉林132013;3.北华大学药学院药物化学教研室,吉林 吉林 132013;4.北华大学医学院病理生理学教研室,吉林 吉林 132013)
柴胡属于柴胡属,伞形科植物,药用部位为柴胡的干燥根, 1963 年被《中国药典》 收录。柴胡多糖为柴胡中主要有效成分[1],具有调节免疫系统功能、抗炎和抗肿瘤等多种药理作用[2-3]。多糖类化合物是一类天然高分子化合物,是由多种单糖组成的生物大分子,中药多糖不良反应少,对机体正常细胞无损害,有 “生物反应调节剂” 之称[4-5]。
衰老指随机体年龄的增长,组织和器官发生功能性退化,逐步趋向死亡的生理过程,抗氧化能力会随着年龄的增加不断降低,导致自由基类的生成与清除无法达到平衡。自1999 年我国进入人口老龄化社会以来,衰老相关疾病、抗衰老和抗氧化药物及其机制研究即成为热点[6]。动物衰老模型是构建与人体衰老表征相似的模型,在当前抗衰老研究中至关重要。前期研究[7]显示:柴胡多糖具有显著的体外抗氧化作用,且其能够明显延缓过氧化氢(H2O2) 所致小鼠肺上皮细胞的衰老,但目前有 关 于 北 柴 胡 多 糖 (Bupleurum chinensepolysaccharide,BCP) 对小鼠衰老影响的相关报道较少。本研究采用D-半乳糖诱导法构建小鼠衰老模型,观察小鼠体质量、外观、行为活动和血清抗氧化酶水平、肝脏及肾脏等器官形态表现变化,探讨BCP 对衰老小鼠的保护作用及其机制,为明确BCP 的抗衰老作用及其机制提供依据。
1 材料与方法
1.1动物、主要试剂和仪器25 只健康1 月龄雄性昆明小鼠购于青岛大学,体质量(23±2) g,动物生产许可证号:SCXK (吉) -2016-0003。BCP 由北华大学生命科学研究中心制备,提取方法:北柴胡洗净干燥, 经水提醇沉后使用ÄKTA explorer 100 蛋白纯化系统进行分馏,透析,冻干,洗脱得到BCP,其总碳水化合物构成比达97.5%,主要由阿拉伯糖、半乳糖和葡萄糖组成,其摩尔质量比为2.1∶2.5∶1[8-9]。超氧化物歧化酶(superoxide dismutase, SOD) 检测试剂盒、 谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px) 检测试剂盒和丙二醛(malondialdehyde, MDA) 检测试剂盒购自中国南京建成生物工程研究所,BCA 蛋白测定试剂盒、 多聚甲醛固定液、 DAPI 染色液和HE 染色液购自中国广州碧云天公司, β -actin mouse IgG1 抗 体、 Goat Anti-Rabbit IgG 二 抗 和Goat Anti-Mouse IgG 二抗购自中国武汉博士德生物工程有限公司, Anti-p53 抗体和Anti-p16 ARC抗体均购自英国Abcam 公司。 Infinite M200 PRO酶标仪购于美国Beckman 公司,TH4-200 倒置荧光显微镜购于日本Olympus 公司,Western blotting 电泳/转仪购于美国Bio-Rad 公司,Image-ProPlus 图像分析管理系统购于美国Media Cybernetics 公司。
1.2动物培养根据实验动物指南, 在温度(25±2) ℃、 湿 度(55±5) %、 12 h∶12 h, 明暗周期光照条件下饲养,培养期间小鼠可随意饮用水与标准颗粒鼠粮。本研究经北华大学动物伦理委员会批准。
1.3小鼠衰老模型建立和给药方式正常饲养1 周后将小鼠随机分为模型组、阳性对照组、低剂量BCP 组和高剂量BCP 组,每组5 只。对照组小鼠每天腹腔注射生理盐水,模型组小鼠腹腔注射D-半乳糖(120 mg·kg-1D-半乳糖),阳性对照组小鼠腹腔注射D- 半乳糖后, 腹腔注射VE(120 mg·kg-1D-半乳糖和100 mg·kg-1VE),低剂量BCP 组小鼠腹腔注射D-半乳糖后,灌胃低剂量BCP (120 mg·kg-1D- 半 乳 糖 和 200 mg·kg-1BCP),高剂量BCP 组小鼠腹腔注射D-半乳糖后,灌 胃 高 剂 量BCP (120 mg·kg-1D- 半 乳 糖 和400 mg·kg-1BCP),连续7 周,所有样品均溶于生理盐水。以小鼠出现一些明显的衰老症状如体质量减轻和动作缓慢等代表衰老模型成功建立。
1.4各组小鼠每日体质量和行为活动观察在实验期间,每周利用电子天平测量小鼠的体质量,绘制小鼠体质量曲线。 观察和记录各组小鼠的食欲、外表、精神状况和行为活动。
1.5各组小鼠脏器组织样本制备和脏器指数计算小鼠持续7 周给药后, 眼球取血, 血液经10 000 r·min-1、 4 ℃离 心10 min, 分 离 血 清 置于- 80℃保存,通过颈椎脱位方法处死小鼠,分离脏器组织,采用生理盐水(4 ℃) 冲洗小鼠脏器组织后称其质量,测定脏器指数。滤纸干燥后立即置于-80℃保存或多聚甲醛固定4 ℃保存,以进行后续生化分析。小鼠脏器指数=脏器质量/小鼠体质量。
1.6各组小鼠血清SOD和GSH-Px活性及MDA水平检测在D-半乳糖刺激下,衰老小鼠血清中会产生氧化酶从而导致自由基的产生,各组小鼠血清中SOD、 GSH-Px 活性及MDA 水平采用SOD、GSH-Px 及MDA 检测试剂盒进行检测,按照说明书将血清稀释成不同倍数置于4 ℃下进行实验。
1.7 HE染色观察各组小鼠肝组织形态表现采用HE 染色对小鼠肝脏组织的病理形态学进行初步观察, 将置于-80℃中的各组小鼠肝脏解冻切小块,采用包埋剂固定,冰冻切片机切成5 μm 的薄片,贴附于载玻片上,切片采用多聚甲醛固定液固定,经过苏木素染色,促蓝液返蓝,伊红染色,脱水,封片后镜下观察各组肝组织形态表现。
1.8 Western blotting法检测各组小鼠肾脏组织中p53和p16蛋白表达水平采用NP40 蛋白裂解液提取小鼠肾脏组织中蛋白。通过BCA 蛋白质检测试剂盒测定提取物浓度,统一蛋白上样量为50 μg 后采用SDS-PAGE 凝胶电泳(15%) 将蛋白进行分离, 电转至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF) 上, 采用5% 脱脂牛奶封闭,然后采用含有小鼠p53、 p16 蛋白和β -actin 一抗的PBST (含0.1% 吐 温-20 的PBS) 孵 育,4°C 过 夜后, PVDF 膜 采 用 PBST 洗 涤 3 次, 每 次10 min, 并采用辣根过氧化物酶缀合的二抗孵育1 h,膜再重新洗涤3 次,每次10 min,吸去液体,采用超敏ECL 化学发光试剂盒,孵育2 min 进行显影,计算p53 和p16 蛋白表达水平。p53 和p16蛋白表达水平=p53 和p16 蛋白条带灰度值/β -actin 条带灰度值。
1.9统计学分析采用GraphPad Prism 6.0 统计软件进行统计学分析。各组小鼠体质量、脏器指数、血清SOD 和GSH-Px 活性、MDA 水平和肾脏组织中p53 及p16 蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠体质量、肝脏指数和肾脏指数正常组小鼠活跃、敏捷,并且饮食健康。与正常组比较,模型组小鼠则表现出明显的衰老症状,包括动作缓慢,逐渐减轻食物摄入,毛发稀疏且暗淡。在实验开始时,各组小鼠体质量比较差异无统计学意义。从第2 周开始,模型组小鼠体质量明显减轻;与模型组比较,不同浓度BCP 组小鼠体质量表现出明显改善。见图1。与正常组比较,模型组小鼠肝脏指数和肾脏指数明显增加(P<0.05);与模型组比较, 低剂量BCP 组小鼠肝脏指数降低了(28.52±2.55) % (P<0.05), 肾脏指数降低了(22.56±2.09) % (P<0.05); 高剂量BCP 组小鼠肝脏指数降低了(34.35±2.6) % (P<0.05),肾脏指数降低了(31.91±1.20) % (P<0.05)。见表1。
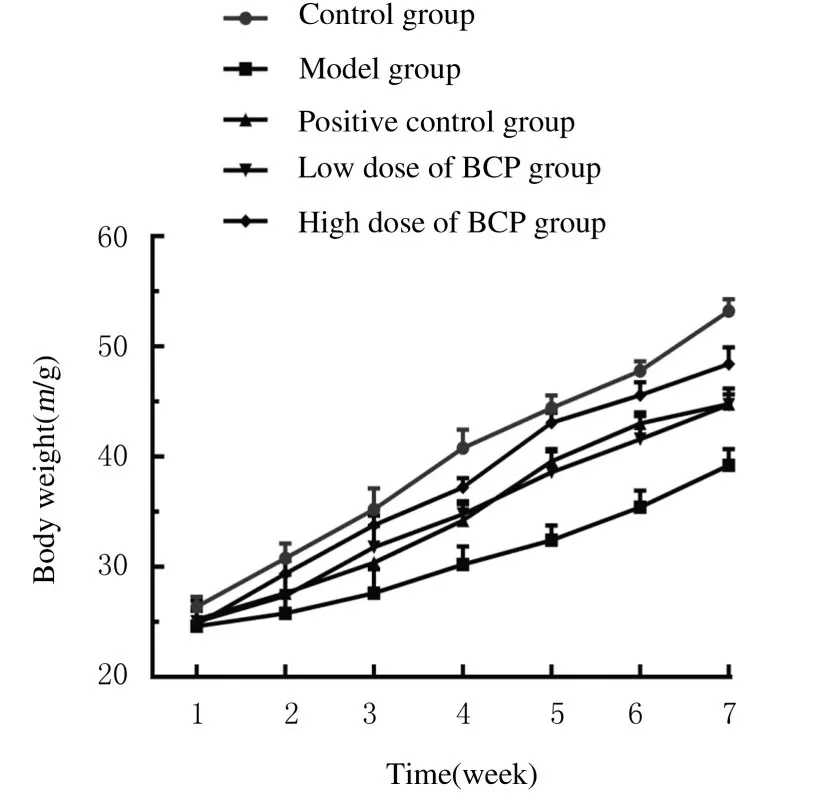
图1 各组小鼠体质量Fig.1 Body weights of mice in various groups
2.2各组小鼠血清SOD和GSH-Px活性及MDA水平与对照组[(185.16±3.47) U·mg-1] 比较, 模型组小鼠血清SOD 活性[(130.80±2.71) U·mg-1] 明显降低(P<0.01);与模型组比较, 阳性对照组[(155.37±2.89) U·mg-1]、低 剂 量[(164.35±2.99) U·mg-1] 和 高 剂 量BCP 组[(182.67±2.93) U·mg-1] 小 鼠 血 清SOD 活性升高,其中高剂量BCP 组小鼠血清SOD活 性 升 高 更 明 显 (P<0.01)。 与 对 照 组[(365.02±14.86) μmol·L-1] 比较,模型 组 小鼠 血 清 GSH-Px 活 性 [ (115.50±5.60)μmol·L-1] 明显降低(P<0.01);与模型组比较,阳性对照组[(168.51±7.13) μmol·L-1]、低剂量[(178.66±3.39) μmol·L-1] 和 高 剂 量BCP[(259.83±12.67) μmol·L-1] 组小鼠血清GSHPx 活性逐渐升高,其中高剂量BCP 组小鼠血清SHPx 活 性 升高更 明 显(P<0.01)。 与 对 照 组[ (8.95±0.81) μmol·L-1] 比 较, 模 型 组 小鼠血清MDA 水平[(14.63±1.84) μmol·L-1] 明 显升高(P<0.01); 与模型组比较, 阳性对照组[(9.55±0.71) μmol·L-1]、 低剂量[(8.46±0.49) μmol·L-1] 和 高 剂 量BCP 组[ (5.50±0.92) μmol·L-1] 小 鼠 血 清MDA 水 平 降 低,其中高剂量BCP 组小鼠血清MDA 水平降低 更 明 显(P<0.01)。
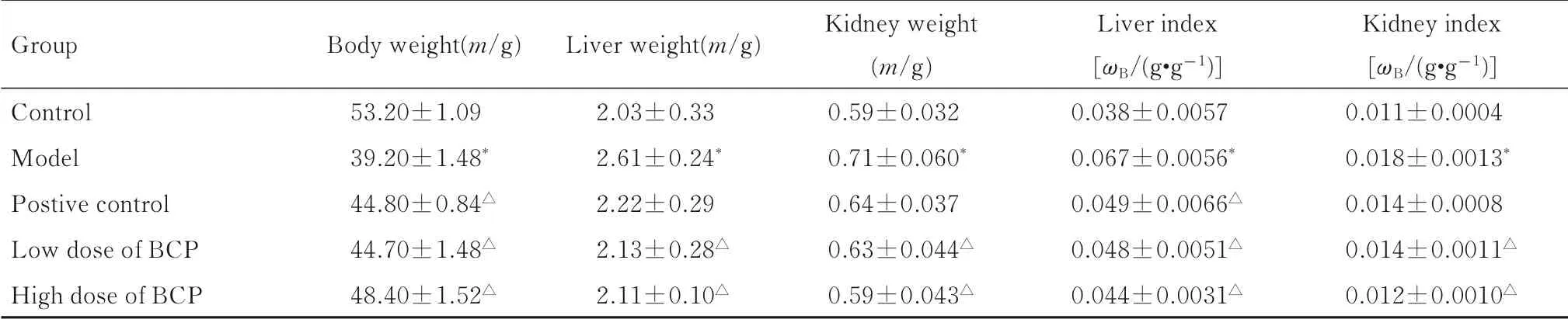
表1 各组小鼠体质量、肝脏指数和肾脏指数Tab.1 Body weights,liver indexes and kidney indexes of mice in various groups (n=5,x±s)
2.3各组小鼠肝组织形态表现对照组小鼠肝小叶结构正常,肝细胞排列紧密,胞核清晰;模型组小鼠肝细胞水肿明显,胞核增大,胞质疏松,肝组织损伤严重;低和高剂量BCP 组小鼠肝组织中水肿细胞减少,肝细胞形态逐渐趋于正常,肝损伤情况得到缓解。见图2 (插页六)。
2.4各组小鼠肾脏组织中p53和p16蛋白表达水平与对照组比较,模型组小鼠肾脏组织中p53 和p16 蛋白表达水平均增加(P<0.01);与模型组比较,低和高剂量BCP 组小鼠肾脏组织中p53 及p16蛋白表达水平有所降低(P<0.05)。 见图3和图4。
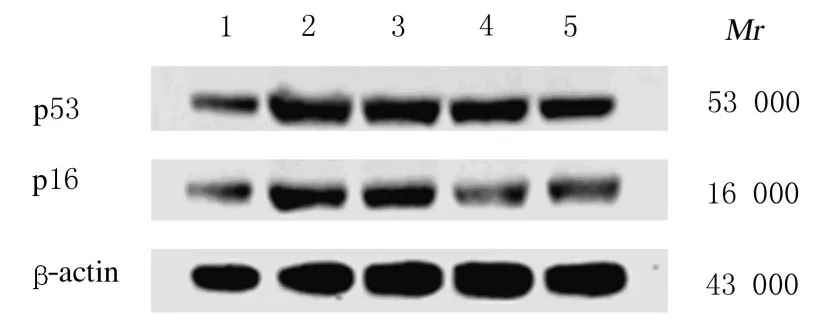
图3 Western blotting 法检测各组小鼠肾脏组织中p53 和p16 蛋白表达电泳图Fig.3 Electrophoregram of expressions of p53 and p16 proteins in kidney tissue of mice in various groups detected by Western blotting method
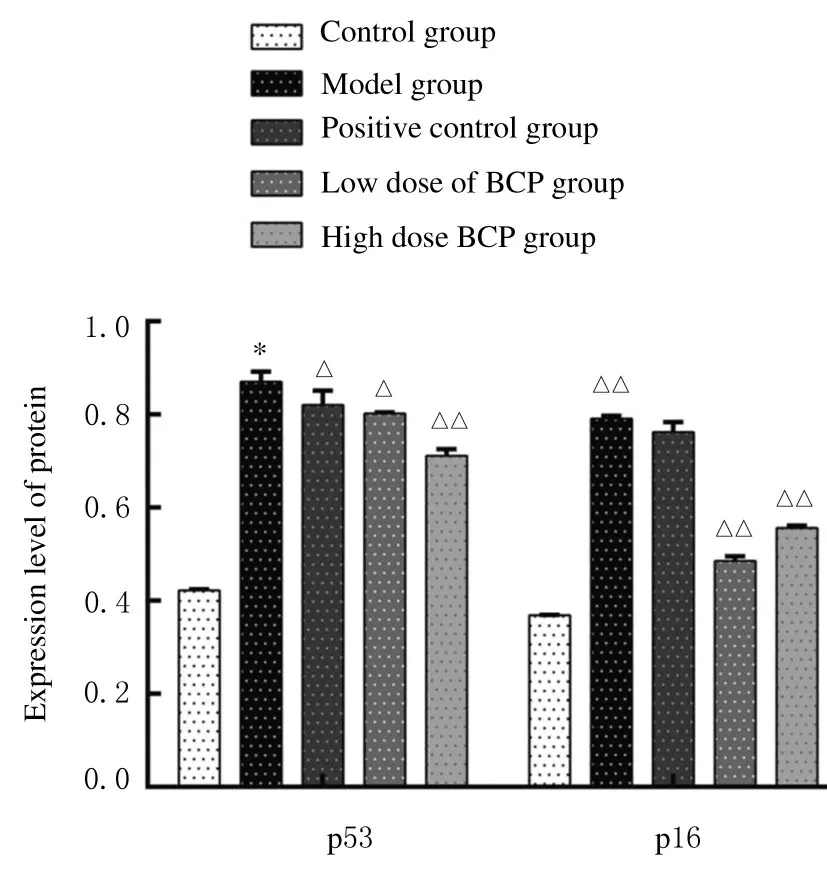
图4 各组小鼠肾脏组织中p53 和p16 蛋白表达水平Fig.4 Expression levels of p53 and p16 proteins in kidney tissue of mice in various groups
3 讨 论
研究[10-11]表明:在一定时间内将一定剂量的D-半乳糖注入小鼠体内后,浓度过高时可被半乳糖氧化酶催化成醛糖和过氧化氢,最终生成超氧阴离子,导致自由基大量产生,活性氧类增加,机体抗氧化酶活性减低,而引发衰老,衰老细胞蛋白错误折叠,亦可促进氧化应激发生;D-半乳糖已被广泛用于诱导体内氧化应激模拟小鼠自然衰老,用来探讨更有效的抗衰老抗氧化药物[12-13]。本研究采用D-半乳糖构建小鼠衰老模型,探讨BCP 对D-半乳糖诱导衰老小鼠的保护作用及其机制。
本研究结果显示:与对照组比较,模型组小鼠衰老症状明显,表现为动作缓慢,毛发稀疏,体质量减轻,肝脏指数和肾脏指数均明显增大,该结果与LI 等[14]研 究 结 论 一 致,而 各 剂 量BCP 组 小 鼠衰老症状明显好转,体质量稳定升高,肝脏指数和肾脏指数趋于正常。
研究[15-17]表明:机体中过量的自由基可导致组织氧化损伤, 影响细胞代谢。 SOD 和GSH-Px是机体中重要的抗氧化酶,可通过清除自由基从而减少对细胞的损伤[18-19],MDA 是由自由基诱导脂质过氧化作用生成的毒性产物,是机体氧化损伤的常用指标[20]。与上述研究一致,本研究结果显示:D-半乳糖诱导的模型组小鼠血清SOD 和GSH-Px活性降低,MDA 水平升高,表明小鼠发生了氧化损伤,而低和高剂量BCP 能够呈剂量依赖性升高D-半乳糖诱导小鼠血清SOD 和GSH-Px 活性,降低MDA 水平。本研究结果显示:BCP 具有较强的抗氧化活性,能够通过提升抗氧化酶活性,减少自由基生成,抑制衰老小鼠机体脂质过氧化,从而发挥对衰老小鼠的保护作用。与对照组比较,模型组小鼠肝组织切片中肝细胞胞质疏松,排列紊乱,肝组织损伤严重,低和高剂量BCP 组小鼠肝组织切片中,肿胀细胞减少,肝细胞形态与排列均明显改善,可见,BCP 有效改善了D-半乳糖刺激小鼠衰老而导致的肝组织损伤。
衰老的过程需要多种信号通路的调控,其中p53-p21 和p16-pRb 信号通路均是影响细胞周期的关键机制,在细胞衰老过程中发挥重要作用。D-半乳糖诱导机体发生氧化应激,细胞受到氧化应激刺激后诱导DNA 损伤,激活p53 基因,促进下游p21基因表达,降低了细胞周期蛋白依赖激酶复合物的活性,从而阻滞细胞周期[21-22]。p16 和p53 均为细胞周期重要的调控因子,p16 是细胞周期蛋白激酶4 (cyclin-dependent kinases 4,CDK4) 的抑制剂,细胞周期阻滞后, p16 信号通路被激活,p16 可以结合并减少CDK 细胞周期蛋白复合物生成,抑制下游基因Rb 的磷酸化,并与其共同调节E2F 转录因子活性,阻断DNA 复制,最终导致细胞周期停滞,诱导细胞衰老[23-24],因此D-半乳糖致衰老作用可能与p53 和p16 信号通路激活有关联[25-27]。本研究结果显示:模型组小鼠肾脏组织中p53 和p16蛋白表达水平明显高于对照组;与模型组比较,低和高剂量BCP 组小鼠肾脏组织中p53 和p16 蛋白表达水平下调,证实BCP 能够通过p53 及p16 信号通路抑制D-半乳糖诱导小鼠衰老相关基因的表达。
综上所述,BCP 可有效改善D-半乳糖诱导衰老小鼠的体质量、肝脏指数和肾脏指数,增强小鼠血清SOD 和GSH-Px 活性,降低MDA 水平,保护肝组织损伤,减少p53 及p16 蛋白表达,表明BCP可能通过抑制氧化应激,调控p53 和p16 衰老相关信号通路保护D-半乳糖诱导的小鼠衰老, 预示BCP 是一种具有抗衰老作用的活性成分,本实验结果为BCP 作为抗衰老药物的开发研究提供了有效靶点及理论依据。
