黄芪注射液对人角质细胞增殖和黏附功能的影响及其治疗银屑病的作用机制
2020-12-15马振卉王园园田亚萍
李 晓, 马振卉, 王园园, 田亚萍
(1.吉林大学第一医院皮肤科,吉林 长春 130021;2.山东省德州市人民医院皮肤科,山东 德州 253000)
银屑病是一种以红斑和鳞屑为主要表现的慢性炎症性皮肤病,病因复杂,目前认为由多基因遗传调控、环境因素刺激和免疫机制介导等共同作用所致。在我国该病总患病率为0.123%,发病率高,易复发,病程较长,严重影响患者的身心健康[1]。人角质细胞(keratinocyte, KC) 异常增殖和细胞免疫系统异常是银屑病特征性表现。活化T 细胞产生白细胞介素17 (interleukin-17,IL-17)、白细胞介 素 23 (interleukin-23, IL-23)、 干 扰 素 γ(interferon -γ, IFN-γ) 和肿瘤坏死因子α (tumor necrosis factor-α,TNF-α) 等[2-4]细胞因子促进KC增殖、棘层增厚和炎症细胞浸润;过度增殖的KC又通过自分泌和旁分泌方式释放细胞因子增强T 细胞 活化, 从而诱发和加重银屑病。 研究[5]显 示:KC 的增殖和分化过程与细胞间黏附结构的重要组成部分β-连环蛋白(β -catenin) 有 密 切 关 联。β -catenin 通过与细胞骨架的相互作用,协助细胞对细胞外的信号和影响做出反应。β-catenin 还可以在细胞核内充当转录因子,启动促使细胞分裂的基因。在正常分化成熟的细胞中,β-catenin 大部分结合于细胞膜,细胞中游离的β-catenin 水平极低,不能进入细胞核调控相应基因表达[5-6]。
黄芪古称 “补药之长”,具有补气固表、增强体质和扶正固本等功效,参与细胞的增殖、分化、凋亡和炎症反应等过程,具有抗炎、抗氧化及调节机体免疫功能紊乱的作用[7-8]。王辉等[9]对结肠炎患者的临床实验研究表明:黄芪颗粒可能通过降低IL-17 和 IL-23 水平从而抑制炎症反应。刘 丹 莉 等[10]研究显示:黄芪甲苷对IL-17/IL-23信号通路存在一定的抑制作用。皮肤屏障受损是银屑病加重的原因之一,KC 数占表皮细胞的80%,黄芪可能通过保护KC 改善皮肤屏障功能,抑制增殖细胞核抗原(proliferating cell nuclear antigen,PCNA) 的表达, 抑制细胞增殖, 使银屑病患者表皮增殖速度减慢, 达到治疗银屑病的目的。研究[11-14] 表明: 黄芪还能通过调节细胞中活性氧(active oxygen, ROS) 生 成、 核 因 子κB (NFκB)、 Janus 激酶信号导子和转录激活因子(JAK/STAT) 和磷脂酰肌醇3 激酶-蛋白激酶B(PI3/AKT) 等信号途径产生抗氧化和抗炎活性,改善皮肤慢性炎症反应。近年来,国内应用黄芪治疗银屑病取得较好效果,银屑病皮疹消退时间明显提前,治愈率明显提高[15-20],但未见黄芪注射液对KC 增殖和β-catenin 蛋白表达影响的相关研究报道。本研究为黄芪对银屑病的治疗作用机制研究提供初步的分子生物学基础。
1 材料与方法
1.1细胞、药物、主要试剂和仪器人永生化角质形成细胞(HaCaT 细胞) 为本实验室冻存细胞。黄芪注射液(神威药业集团有限公司, 每支装10 mL,相当于原药材20 g)。DMEM 培养基(美国Gibco 公司),CCK-8 试剂盒(上海碧云天生物技术有限公司), FastKing RT Kit 和SuperReal PreMix Plus (北京天根生化科技有限公司),兔抗人β -actin 单克隆抗体和山羊抗兔IgG (中国Biosharp 公司)。CO2培养箱、低速离心机和PCR扩增仪(美国Thermo 公司),倒置显微镜(日本Olympus 公司)。
1.2 qPCR引物序列qPCR 引物由金唯智(苏州) 生物科技有限公司合成。β-actin 引物序列:上游引物5′TCATGAAGTGTGACGTGGACATC,下游引物5′-CAGGAGGAGCAATGATCTTGATCT-3′; β -catenin 蛋 白 序 列: 上 游 引 物 5′-GGAGCCCTTCACATCCTAGG-3′,下游引物5′-GTGGCTCCCTCAGCTTCAAT-3′。
1.3各组HaCaT细胞增殖率的检测首先确定黄芪对HaCaT 细胞增殖影响的有效浓度。取对数生长期、浓度为3 ×104mL-1的HaCaT 细 胞 悬 液2 mL,接种于6 孔细胞培养板,贴壁后加入10 倍浓度梯度稀释为0、 0.01、 0.10、 1.00、 10.00 和100.00 g·L-1黄芪注射液培养24 h。对各组HaCaT细胞进行消化、计数,重复3 次,取平均值为有效浓度。在此基础上,将黄芪注射液以2 倍浓度梯度稀释,实验组细胞加入不同浓度黄芪注射液,即不同浓度黄芪注射液组,同时设置空白组(添加培养基,不添加细胞及药物) 和对照组(添加细胞,不添加药物)。以2×103个细胞接种于96 孔细胞培养板, 设5 个复孔, 置于CO2培养箱培养24、 48 和72 h。每孔加入10 μL CCK-8 溶液,置于培养箱内继续孵育2 h。酶标仪检测波长450 nm 处的吸光度(A) 值,实验重复3 次,计算各组HaCaT 细胞增殖率。细胞增殖率= (实验组A 值- 空白组A 值) /(对照组A 值-空白A 值) ×100%,细胞抑制率=1-细胞增殖率。
1.4 HaCaT细胞总RNA提取和RNA逆转录为cDNA 实验组加入1.0 g·L-1黄芪处理,对照组不加入黄芪。 细 胞 以3×105mL-1的 密 度 接 种 于10 cm 培养皿,设3 个复孔, 培 养24 和48 h 后 取1 mL 细胞悬液提取RNA, 紫外分光光度计测定RNA 浓度。按照cDNA 合成试剂盒进行实验操作。分别配置DNA 去除反应体系、反转录反应体系,得到的cDNA 用于后续实验,置于-20℃冰箱保存备用。
1.5 qPCR法检测各组HaCaT细胞中β -catenin mRNA表达水平以β -actin 为 内 参, 按 照SuperReal PreMix Plus 试剂盒说明书进行实验。根据实时结果Ct 值,采用2-△△Ct法对实验结果进行计算, 计算β-catenin mRNA 相对于内参的表达水平。△△Ct=目的基因△Ct-内参基因△Ct。
1.6 Western blotting法检测各组HaCaT细胞中β-catenin蛋白表达水平对照组(即0 g·L-1黄芪注射液组) 和实验组(给予1.0 g·L-1黄芪注射液组) HaCaT 细胞以3×105mL-1培养24 h 贴壁后,培养细胞48 h, 胰蛋白酶消化收集细胞用于Western blotting 实 验。 采 用Image J 软 件 对SDSPAGE 图谱进行蛋白灰度分析,计算各组HaCaT细胞中β-catenin 蛋白表达水平,β-catenin 蛋白表达水平=β-catenin 蛋白条带灰度值/内参条带灰度值。
1.7统计学分析采用GraphPad Prism 5.0 统计软件进行统计学分析。 各组HaCaT 细胞增殖率、各组HaCaT 细胞中β-catenin mRNA 和蛋白表达水平以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用SNK-q检验。以α=0.05 为检验水准。
2 结 果
2.1各组HaCaT细胞的增殖率以10 倍浓度梯度稀释黄芪注射液(0、0.01、0.10、1.00、10.00和100.00 g·L-1) 依次处理HaCaT 细胞24 h,计数HaCaT 细胞,结果显示: 1.00 g·L-1黄芪注射液组HaCaT 细胞增殖数降低(P<0.01)(图1)。在此基础上, 2 倍浓度梯度稀释黄芪注射液(0.5、1.0、2.0、4.0、8.0 和16.0 g·L-1) 加入实验组,对照组和空白组不加入药物。 各组分别经24、48 和72 h 孵育处理后,CCK-8法检测各组HaCaT细胞增殖情况,结果显示:与 对 照 组(0 g·L-1黄芪注射液) 比较,处理24和48 h后,1.00 g·L-1黄芪注射液组HaCaT 细胞增殖受到明显抑制,而孵育72 h 后失去继续抑制细胞增殖的效果(表1),因此后续实验选取浓度为1.0 g·L-1黄芪注射液处理细胞24 和48 h。
2.2各组HaCaT细胞中β-catenin mRNA表达水平采用1.0 g·L-1黄芪注射液对HaCaT 细胞处理24 和48 h 后 检 测 各 组HaCaT 细 胞 中β -catenin mRNA 表达水平,结果显示:与对照组比较,24 h时1.0 g·L-1黄芪注射液组HaCaT 细胞中β-catenin mRNA 表达水平比较差异无统计学意义(P>0.05);48 h 时,与对照组比较,1.0 g·L-1黄芪注射液组HaCaT 细胞中β-catenin mRNA 表达水平降低(P<0.01)。见图2。
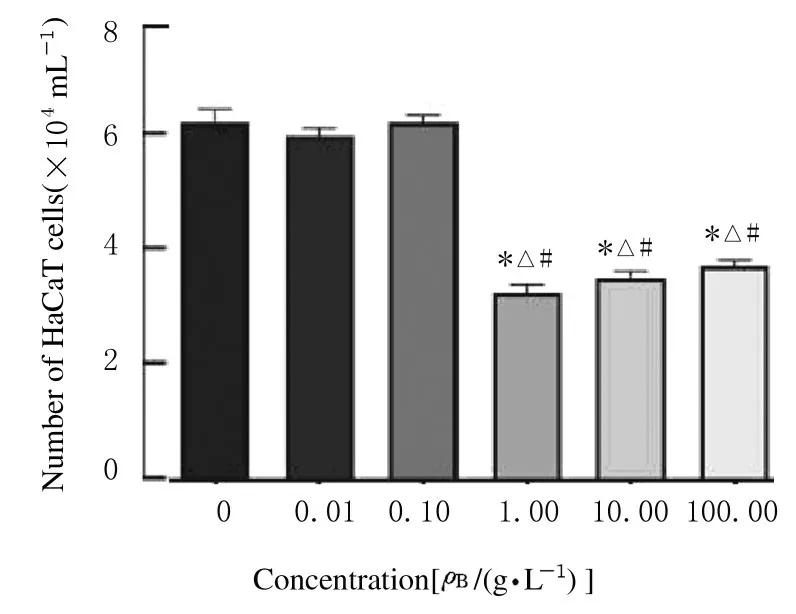
图1 不同浓度黄芪注射液处理24 h 后各组HaCaT 细胞数Fig.1 Number of HaCaT cells in various groups after treated with different concertrations of Astragalus Injection for 24 h
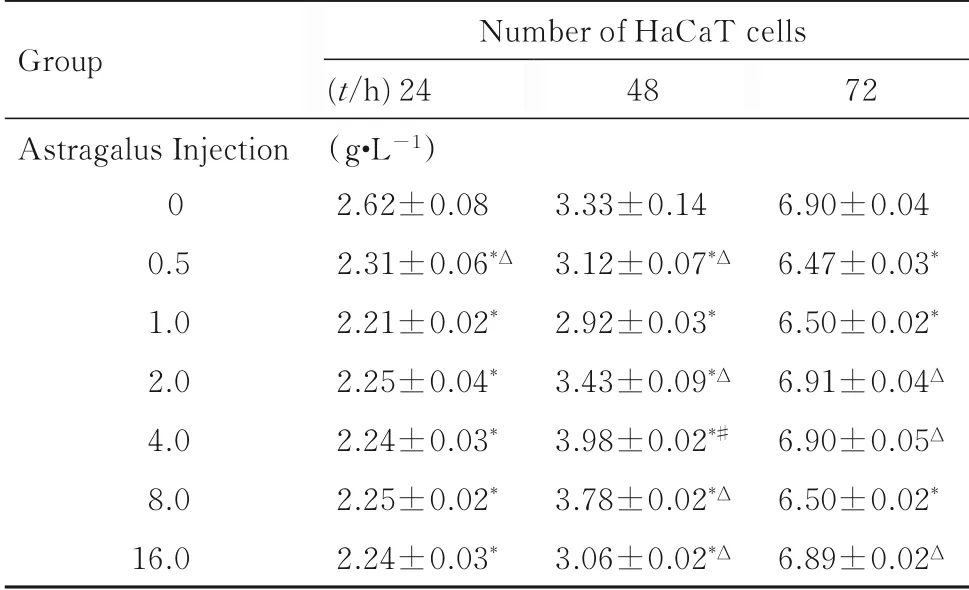
表1 CCK-8 法检测不同浓度黄芪注射液处理24、48 和72 h后各组HaCaT 细胞数Tab.1 Number of HaCaT cells in various groups after treated with different concertrations of Astragalus Injection for 24,48 ,and 72 h detected by CCK-8 method (n=3,x±s)
2.3对照组和1.0 g·L-1黄芪注射液组HaCaT细胞中β-catenin蛋白表达水平1.0 g·L-1黄芪注射液处理HaCaT 细胞48 h 后, 与对照组比较,1.0 g·L-1黄芪注射液组HaCaT 细胞中β-catenin 蛋白表达水平降低(P<0.01)。见图3。
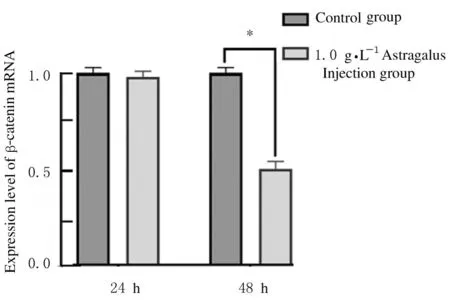
图2 处 理24 和48 h 后 对 照 组 和1.0 g·L-1 黄 芪 注 射 液 组HaCaT 细胞中β-catenin mRNA 表达水平Fig.2 Expression level of β-catenin mRNA in HaCaT cells in 1.0 g·L-1 Astragalus Injection group after treated for 24 and 48 h
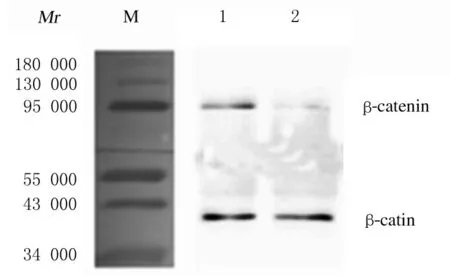
图3 Western blotting 法检测处理48 h 后对照组和1.0 g · L-1 黄芪注射液组HaCaT 细胞中β-catenin 蛋白表达电泳图Fig.3 Electrophoregram of expressions of β- catenin protein in HaCaT cells in control group and 1.0 g · L-1 Astragalus Injection group after treated for 48 h detected by Western blotting method
3 讨 论
银屑病是免疫介导的炎症性皮肤病,尚无特效药物进行治疗,其主要组织病理学主要特征为KC过度增殖,这可能与细胞间的黏附连接结构β -catenin 蛋白异常表达有关。β-catenin 蛋白是一种胞内糖蛋白,具有双重功能:一是作为附着连接的组成部分,与钙黏蛋白结合形成复合体参与细胞间连接;二是作为信号分子,是Wnt/β-catenin 信号通路的重要环节,在胚胎发育和肿瘤发生中起重要作用。β-catenin 蛋白选择何种途径发挥作用,与不同配体竞争性结合密切相关。最新研究[21-22]表明:Wnt/β-catenin 信号通路可能在银屑病中起到调节角质形成细胞分化与增殖的作用。刘国刚等[22]发现:β-catenin 蛋白在寻常型银屑病皮损区中的异位表达率明显高于正常组织。因此,β-catenin 蛋白可作为评估银屑病发展的参考指标之一。
低浓度黄芪可以抑制KC 增殖。研究[23]显示:黄芪注射液能够抑制银屑病患者表皮分离KC 的生长,且浓度增加抑制作用越明显,与本实验结果略有不同。本研究结果显示:当浓度达到1.0 g·L-1后,黄芪的抑制作用基本进入平台期,随着浓度的升高,抑制效果略有降低,随着时间的增加,黄芪注射液对KC 的增殖抑制作用逐渐减弱,72 h 时基本丧失抑制作用。 β -catenin 蛋白在48 h 转录和表达水平均明显降低, 72 h 时,抑制效应均减弱。这一结果可能与黄芪注射液药效成分较多有关。虽然黄芪注射液中的主要成分(皂苷类、黄酮类和多糖类) 相对稳定,但是黄芪至少还有十余种其他有效成分的生理作用仍需继续探索,不同产地的黄芪在成 分 上 的 微 小 差 异 也 不 容 忽 视[23]。 KC 中的β -catenin 蛋白可能存在一个临界响应阈值,黄芪的有效浓度只起到了激活作用,之后会随时间自动衰减,这种现象有待于未来深入研究。另外,银屑病患者临床表现为典型的点状出血,存在真皮浅层血管炎和微循环障碍。李炎夏等[24]研究显示:将黄芪与维胺酯合用,可明显起到抑制角化,改善微循环的作用,并且更为有效地促进皮损部位的修复。HUH 等[25]研究显示:黄芪中的芒柄花黄素可作为血液增强剂,产生更大的毛细血管芽生区域,细胞增殖和迁移也更多,由此证实黄芪具有改善血液微循环的作用。在皮肤病治疗方面,黄芪则具有改善局部微循环,促进成纤维细胞和胶原蛋白的合成、修复角质形成细胞、调节细胞因子,调整免疫活性的作用。采用黄芪根煮水提取物,作用于有开放伤口的小鼠背侧,微观组织学观察发现黄芪能够加速基底细胞生长,刺激细胞外基质的合成,抑制炎症反应,加速皮肤伤口愈合[26-28]。但无法在体外细胞学实验中观察到,因此本研究结果未展现出黄芪的全部有效性。
本研究采用细胞学实验探讨黄芪对银屑病治疗作用的结果显示:起始浓度大于1.0 g·L-1黄芪注射液可以对KC 异常增殖和黏附功能起到抑制作用,抑制效应可能随时间衰减,进一步分离提取黄芪不同的有效成分并进行深入研究,将为应用黄芪治疗银屑病提供分子生物学依据。
