FOXO1 对急性肺损伤小鼠肺泡上皮钠通道的调控作用及其机制
2020-12-15王导新
何 婧, 王导新, 邓 旺
(重庆医科大学附属第二医院呼吸与危重症学科,重庆 400010)
急性呼吸窘迫综合征 (acute respiratory distress syndrome, ARDS) 是一种常见的危重病,中 重度ARDS 死亡率高达40%[1]。 ARDS 发生发展过程中,由于肺微血管内皮细胞和肺泡上皮细胞正常屏障功能受损,大量富含蛋白的液体渗出并聚集在肺泡腔内,使有效肺泡面积减少,影响正常气体交换功能,引起顽固性低氧血症[1-3]。及时有效地清除肺泡腔内过多的液体对维持气体交换、提高氧合和改善预后至关重要[4]。研究[5]显示:肺泡上皮钠通道(epithelial sodium channel, ENaC) 是肺泡内水肿液清除(alveolar fluid clearance,AFC) 的关键环节。 本课题组前期对ENaC 的研究[6-7] 显 示: 肺 内 激 活PI3K-mTORC2-AKT/SGK1 信号可以进一步磷酸化Nedd4-2, 抑制Nedd4-2 对ENaC 的泛素化降解而使ENaC 保留在细胞膜上,以增加肺泡上皮细胞ENaC 蛋白的表达丰度、促进AFC。这一过程是从蛋白降解水平发挥对ENaC 的调控作用,理论上仅对肺泡上皮细胞ENaC 蛋白表达水平产生影响。 本课题组前期研究[6] 显 示:激 活PI3K 信 号 通 路 后,ENaC 转 录 水平明显升高,这一现象并不能采用上述机制来解释。研究[8-9]显示:叉头框(forkhead box, FOX)蛋白是胰岛素信号通路下游的关键分子,PI3K 信号可使叉形头转录因子1 (forkhead transcription factor 1, FOXO1) 发生磷酸化后转位出细胞核而失去转录活性,然而FOXO1 是否参与了胰岛素信号对肺泡ENaC 的调控及其调控效应目前尚不明确。ENaC 由α、β 和γ 3 个同源亚基组成,表达于肺泡上皮细胞顶膜, 其中α 亚基表达水平最为丰富,α 亚基在肺泡AFC 过程中起重要作用,因此本实验选取αENaC 作为研究指标。本课题组在前期研究基础上拟进一步研究FOXO1 对急性损伤状态肺泡上皮细胞αENaC 的作用,并阐明FOXO1 的调控机制。
1 材料与方法
1.1实验动物、细胞、主要试剂和仪器雄性C57BL/6J 小鼠20 只,体质量20~25 g,购于重庆医科大学实验动物中心, 动物生产许可证号:SCXK (渝) 2012-0001, 动 物 使 用 许 可 证 号:SYXK (渝) 2012-0001,于SPF 级分笼饲养,自由饮水和摄食。肺泡上皮A549 细胞由中国生命科学 院 细 胞 典 藏 库 提 供, 脂 多 糖(lipopolysaccharide , LPS) 购自美国Sigma 公司,Anti- αENaC 抗体购自中国赛默飞世尔公司,FOXO1 蛋 白 和 磷 酸 化 FOXO1 蛋 白(phosphorylated FOXO1,pFOXO1)、anti-FOXO1和anti-pFOXO1 (Ser256) 抗 体 购 自 美 国Cell Signaling 公司,二抗购自中国中杉金桥公司。酶标仪和电泳仪购自美国Bio-Rad 公司,显微镜购自日本奥林巴斯公司。
1.2动物分组和干预方式20 只雄性小鼠随机分为对照组和LPS 组,每组10 只。向小鼠腹腔注射2% 戊巴比妥钠(50 mg·kg-1) 麻醉,以腰池引流管为导管经口行气管插管,并向LPS 组小鼠气管内 滴 入LPS (5 mg·kg-1LPS 溶 于50 μL 生 理 盐 水中) 模拟急性肺损伤(acute lung injury, ALI) 模型,对照组小鼠仅滴入等量生理盐水。24 h 后过量麻醉处死小鼠,取肺组织标本进行后续实验。
1.3 HE染色观察对照组和LPS组小鼠肺损伤评分完整分离2 组小鼠左肺组织,以4% 多聚甲醛固定24 h,石蜡包埋,常规切片,HE 染色后观察肺组织病理学变化并行肺损伤评分,观察炎性细胞浸润、肺泡出血、肺水肿、肺泡间隔增宽或透明膜形成4 项指标,根据肺损伤严重程度分别进行评分(0 分:无病变;1 分:轻度病变;2 分:中度病变;3 分:重度病变;4 分:极重度病变),累计总分为小鼠肺损伤评分。
1.4 FOXO1过表达重组腺病毒载体系统的构建在基因库(GenBank) 中检索FOXO1 基因序列,通过RT-PCR 反转录合成FOXO1 基因的cDNA。引入酶切位点, 设计带酶切位点的引物, 采用PCR 技术扩增目的基因,并采用1% 琼脂糖凝胶电泳鉴定并切胶回收。将合成好的基因片段经酶切后载入穿梭质粒中,转化至DH5a 感受态大肠杆菌中扩增,回收测序,测序正确后导入慢病毒载体,构建ADV-FOXO1。以构建的ADV-NC 空载慢病毒载体作为对照组。对比FOXO1 序列,构建特异性干扰的shRNA,同时设置乱序shRNA 作为转染对照,将靶基因片段克隆至shRNA 载体质粒,导入慢病毒载体。
1.5细胞分组和干预复苏肺泡上皮A549 细胞,采用0.25% 胰酶消化传代,以含10% 胎牛血清、100 U·mL-1青霉素和0.1 g·L-1链霉素的HITFS完全培养基培养。干预前1 d,将A549 细胞接种于细胞培养板内,置于37℃、5%CO2的培养箱中孵育24 h,至30% 融合时进行感染。第一部分实验:①过表达实验分组方式: 实验分为空白对照组、ADV-NC 组和ADV-FOXO1 组;②基因沉默实验分组方式:实验分为空白对照组、shRNA-random组和shRNA-FOXO1 组; 细胞感染后在荧光显微镜下观察各孔转染细胞的荧光表达,经筛选后得到稳定表达的细胞行后续实验。第二部分实验:将A549 细胞分为空白对照组、胰岛素组、胰岛素+PI3K 抑制剂组和胰岛素+AKT 抑制剂组,分别加入胰岛素(100 nmol·L-1)、胰岛素(100 nmol·L-1) +LY294002(10 μmol·L-1)和胰岛素(100 nmol·L-1)+渥漫青霉素(30 nmol·L-1),空白对照组加入等量相应溶解剂,培养24 h 后收集细胞行后续实验。
1.6 RT-PCR法检测2组小鼠肺组织和细胞中αENaC mRNA表达水平采用TRIzol 试剂提取2 组小鼠肺组织或细胞中总RNA,测定样本260 和280 nm处吸光度(A) 值,计算A (260)/A (280)比值,并保证比值处于1.8~2.0,采用琼脂糖凝胶电泳法分析提取RNA 的纯度和完整性。 按照Prime Script RT Reagent Kit 逆转录试剂盒说明书将总RNA 逆转录为cDNA。 参照Roche FastStart Universal SYBR Green Master Version 3.0 说明书进行RT-PCR 反应(ENaC 各亚基引物由上海生工设计合成),以GAPDH mRNA 为内参,按照说明配置反应体系,设置RT-PCR 仪反应参数。计算目的基因拷贝数,定量分析结果。采用相对定量方法RQ=2-ΔΔCt计算αENa C mRNA 表达水平,ΔΔCt=(实验样品Ct-内参基因Ct) - (基准样品Ct-内参基因Ct)。
1.7 Western blotting法检测各组小鼠肺组织和细胞中αENaC、FOXO1和pFOXO1蛋白表达水平分别按蛋白提取试剂盒说明书操作,裂解组织或细胞后提取蛋白,检测蛋白浓度并调整至浓度一致,蛋白样品经SDS-PAGE 电泳分离, 转膜后于5% 脱脂奶粉(磷酸化蛋白使用5% BSA) 封闭1 h,分别加入各种抗体,4℃孵育过夜。次日洗膜后加入二抗,37℃孵育1 h。洗膜后经ECL 显色,Quality One 分析电泳图片条带,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/内参条带灰度值。
1.8免疫荧光法检测各组A549细胞中FOXO1的胞内定位情况对各组A549 细胞进行爬片,并以4% 多聚甲醛进行固定后以0.2%Triton 破膜。5% 山羊血清于37℃封闭30 min,孵育一抗,于湿盒内4℃过夜。次日以PBS 溶液清洗爬片后,采用Alexa Fluor 594 标记的二抗于37℃闭光孵育1 h。清洗后封片,避光4 ℃保存,采用倒置荧光显微镜观察A549 细胞中FOXO1 的胞内定位情况。
1.9统计学分析采用SPSS 18.0 统计软件进行统计学分析。 各组小鼠肺损伤评分、 肺组织中αENaC、FOXO1、pFOXO1 蛋白及αENaC mRNA表达水平均以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两均数比较采用LSD-t法,pFOXO1 与αENaC 蛋白表达水平的相关性采用Pearson 线性相关分析法。以P<0.05 为差异有统计学意义。
2 结 果
2.1对照组和LPS组小鼠肺组织损伤程度和损伤评分对照组小鼠肺组织未见明显炎性细胞浸润,肺泡间隔均一,肺泡腔和肺间质无出血水肿;LPS组小鼠肺组织中有明显的炎性细胞浸润、肺泡间隔增厚、肺泡和肺间质斑片状出血和肺水肿。LPS 组小鼠肺组织损伤评分(13.00±0.75) 明显高于对照组(0.50±0.16)(P<0.05)。见图1(插页三)。
2.2对照组和LPS组小鼠肺组织中αENaC、FOXO1和pFOXO1蛋白表达水平LPS 组小鼠肺组织中FOXO1 蛋白表达水平(0.86±0.02) 与对照组(0.83±0.01) 比较差异无统计学意义(P>0.05), 但pFOXO1 (Ser256) 蛋 白 表 达 水 平 和αENaC 蛋白表达水平(0.48±0.01 和0.31±0.02)较对照组(0.23±0.01 和0.19±0.02) 明显降低(P<0.05), 且 二 者 之 间 呈 正 相 关 关 系(r=0.703,P<0.05)。见图2。

图2 2 组 小 鼠 肺 组 织 中α ENaC 、FOXO1 和pFOXO1(Ser256)蛋白表达电泳图Fig.2 Electrophoregram of expressions of αENaC,FOXO1, and pFOXO1(Ser256) proteins in lung tissue of mice in two groups
2.3 FOXO1基因过表达后各组A549细胞中FOXO1和pFOXO1蛋白(Ser256) 及αENaC mRNA表达水平感 染ADV-FOXO1 (Thr24 、Ser256 和 Ser319 磷 酸 化 位 点 突 变) 后,ADV-FOXO1 组A549 细 胞 中FOXO1 蛋 白 表 达 水平(0.89±0.02) 较 对 照 组(0.46±0.01) 和ADV-NC 组(0.43±0.01) 明显升高,但pFOXO蛋白表达水平(0.11±0.01) 较对照组(0.59±0.01) 和ADV-NC 组(0.63±0.01) 明 显 降 低(P<0.05); ADV-NC 组和对照组A549 细胞中FOXO1 蛋白表达水平和pFOXO1 蛋白表达水平比较差异无统计学意义(P>0.05), ADV-FOXO1组A549 细 胞 中αENaC mRNA 表 达 水 平(0.10±0.01) 较对照组(0.19±0.00) 明 显 降低(P<0.05);ADV-NC 组A549 细 胞 中αENaC mRNA 表达水平(0.18±0.00) 与对照组比较差异无统计学意义(P>0.05)。见图3。

图3 各组A549 细胞中FOXO1 和pFOXO1 蛋白表达电泳图Fig.3 Electrophoregram of expressions of FOXO1 and pFOXO1(Ser256) proteins in A549 cells in various groups
2.4 FOXO1基因沉默后各组A549细胞中FOXO1蛋白和αENaC mRNA表达水平沉默FOXO1 基因后,shRNA-FOXO1 组FOXO1 蛋白表达水平(0.19±0.01) 较 对 照 组 (0.87±0.01) 和shRNA-random 组(0.88±0.02) 明显降低(P<0.05), shRNA-random 组 与 对 照 组A549 细 胞 中FOXO1 蛋白表达水平比较差异无统计学意义(P>0.05)。见图4。shRNA-FOXO1 组A549 细胞中αENaC mRNA 表达水平(0.21±0.01) 较对照组(0.18±0.00) 明显升高(P<0.05);shRNArandom 组A549 细 胞 中αENaC mRNA 表 达 水 平(0.19±0.00) 与对照组比较差异无统计学意义(P>0.05)。
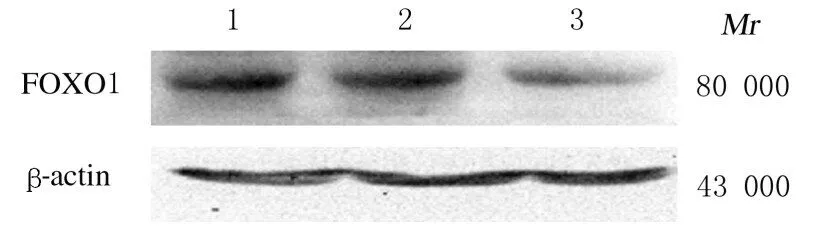
图4 各组A549 细胞中FOXO1 蛋白表达电泳图Fig.4 Electrophoregram of expressions of FOXO1 protein in A549 cells in various groups
2.5各组A549细胞中FOXO1和pFOXO1蛋白及αENaC mRNA表达水平对照组、胰岛素组、胰岛素+PI3K 抑制剂组和胰岛素+AKT 抑制剂组A549 细胞中FOXO1 蛋白表达水平(0.43±0.01、0.44±0.01、 0.44±0.01 和0.45±0.01) 组 间 比较差异无统计学意义(P>0.05);胰岛素组A549细胞中pFOXO1 蛋白表达水平(0.90±0.01) 较对照组(0.52±0.01) 明显升高(P<0.05), 胰岛素+PI3K 抑制剂组和胰岛素+AKT 抑制剂组A549 细胞中pFOXO1 蛋白表达水平(0.50±0.01和0.50±0.01) 与对照组比较差异无统计学意义(P>0.05),但较胰岛素组明显降低(P<0.05)。见图5。胰岛素组A549 细胞中αENaC mRNA 表达水平(0.21±0.01) 较对照组(0.17±0.00) 明显升高(P<0.05), 胰岛素+PI3K 抑制剂和胰岛素+AKT 抑制剂组A549 细胞中αENaC mRNA 表达水平(0.18±0.01 和0.19±0.01) 与对照组比较差异无统计学意义(P>0.05),但较胰岛素组明显降低(P<0.05)。

图5 各组A549 细胞中FOXO1 和pFOXO1 蛋白表达电泳图Fig.5 Electrophoregram of expressions of FOXO1 and pFOXO1 proteins in A549 cells in various groups
2.6各组A549细胞中FOXO1的胞内定位情况免疫荧光检测结果显示: 对照组A549 细胞中FOXO1 在肺泡上皮细胞核和细胞浆中均有表达,胰岛素组, FOXO1 主要表达于细胞浆, 而胰岛素+PI3K 抑制剂和胰岛素+AKT 抑制剂组FOXO1 主要表达在细胞核。见图6 (插页三)。
3 讨 论
ARDS 发病机制复杂,且尚未完全阐明,至今仍缺乏特异性的治疗方法。发生ARDS 时,肺泡腔内大量水肿液聚集,严重影响了正常的气体交换功能,引起了顽固性低氧血症。及时有效地清除肺泡腔内过多的液体可明显降低ARDS 死亡率[10],这是治疗的关键点。研究[5]显示:ENaC 是肺泡内AFC 的限速环节,上调ENaC 表达有利于肺泡腔内水肿液的重吸收。ENaC 由α、β 和γ3 个同源亚基组成,表达于肺泡上皮细胞顶膜,其中α 亚基表达水 平最为丰富。研究[11]显 示:αENaC 基因敲除小鼠因不能清除肺泡内液体,在出生后40 h 之内死亡,表明α 亚基在肺泡AFC 过程中起重要作用,因此本实验选取αENaC 作为研究指标。
本研究结果表明:在LPS 诱导的急性肺损伤小鼠肺组织中,αENaC mRNA 表达水平明显降低,pFOXO1 蛋白表达水平亦明显降低;相关性分析发现:二者表达存在正相关关系,提示急性肺损伤小鼠肺泡上皮细胞中αENaC 基因的表达调控可能与FOXO1 有关联。
FOX 蛋白属于核转录因子蛋白家族,广泛存在于真核生物中,通过调控靶基因的转录,参与调节糖代谢、氧化应激、细胞周期阻滞和免疫调节等多个生物学过程[12-13],FOXO1 广泛分布于各组织器官中,在肺组织中有明显表达[14]。FOXO1 在细胞核内可通过DNA 结合域结合靶基因启动子中的一段高度保守的DNA 结合序列——5′-GTAAA(C/T) A-3′或胰岛素反应元件(IRE) ——5′-CAAAA (C/T) A-3′,从而对靶基因的转录进行调控。研究[15]显示: ENaC 基因启动子序列中存在 一 段 类 似IRE [5′-CAAAA (C/T) A-3′] 的FOXO1 结合元件,因此本文作者推测:FOXO1 可能通过与ENaC 基因启动子结合元件结合或解聚对其发挥转录调控作用。 然而在不同的组织中,FOXO1 对目标靶基因转录调控效应不同。目前大多数情况下FOXO1 被认为对靶基因的转录起正向调控作用, 即FOXO1 发挥促进靶基因转录效应[16-17]。近期研究[18-19]显示:FOXO1 亦可以发挥抑制靶基因转录活性的负向调控效应,例如在肝脏内皮细胞和人脐静脉内皮细胞,过表达FOXO1 会抑制内皮细胞MYC 及其下游基因表达,在脑垂体细胞中,FOXO1 抑制Lhb 基因转录活性,降低黄体生成素的分泌水平。但FOXO1 在肺泡上皮细胞中对靶基因αENaC 转录活性的调控方向尚不明确。因此,本课题组进一步研究FOXO1 在肺泡上皮细胞中对αENaC 的调控作用的结果表明: 过表达FOXO1 时,A549 细 胞 中αENaC mRNA 表 达 水 平被抑制, 而沉默FOXO1 基因时, αENaC mRNA表达水平明显升高。本研究结果显示:在小鼠肺泡上皮细胞中,FOXO1 对αENaC 基因转录发挥负向调 控 效 应, 抑 制 了αENaC 的 转 录 水 平。 与WILHELM 等[18]的 研 究 结 果 一 致。 FOXO1 在 不同组织中对其靶基因转录活性调控方向的差异可能与靶基因的特性有关联。
FOXO1 对靶基因转录的调控活性很大程度上取决于其在细胞内的定位。当FOXO1 定位于细胞核内, 与靶基因结合, 发挥转录调控作用; 当FOXO1 从细胞核内穿梭至胞质内,遂与靶基因分离,转录调控活性降低。由此可见:FOXO1 在靶基因转录调控中起“闸门” 作用,是介导上游转录信号向下游靶基因传递的控制器。磷酸化是影响FOXO1 在细胞内定位的主要因素之一。 FOXO1具有高度保守的磷酸化位点(Thr24、 Ser256 和Ser319),可被蛋白激酶磷酸化。pFOXO1 从细胞核穿梭至细胞质内,与靶基因启动子解离,对靶基因的转录调控活性减弱;同时与14-3-3 蛋白结合,维持磷酸化状态并稳定滞留于胞质内而后被降解[20]。 PI3K 是一个能够调控FOXO1 磷酸化的上游信号分子。研究[8]证实:激活PI3K/AKT 信号通路能够使FOXO1 蛋白磷酸化,引起FOXO1穿梭出核并定位于细胞质,失去结合靶基因的能力,转录调控活性降低。
本研究结果表明: αENaC mRNA 表达水平与FOXO1 的磷酸化程度呈正相关关系。同时,胰岛素可促进FOXO1 磷酸化, 并从基因层面增加αENaC 的表达水平,该作用可分别被PI3K 抑制剂和AKT 抑制剂阻断,提示胰岛素的效应是通过其经典信号通路——PI3K/AKT 信号通路产生的。胰岛素刺激后,FOXO1 在小鼠肺泡上皮细胞中的定位由胞核易位至细胞浆,而分别采用PI3K 抑制剂和AKT 抑制剂后,FOXO1 的易位效应明显减弱,提示胰岛素激活的PI3K-AKT 信号使FOXO1 磷酸化出胞, 失去对αENaC 的抑制效应, 从而使αENaC mRNA 合成增加。本研究结果证实:在肺泡上皮细胞中,FOXO1 亦是通过磷酸化途径发挥胞核穿梭效应,从而对αENaC 转录水平进行有效调控。本研究结果是对前期研究的补充,诠释了激活PI3K/AKT 信号通路从基因水平上调αENaC 的分子机制。
综上所述,在肺泡上皮细胞中,PI3K/AKT 信号促使FOXO1 发生磷酸化并由胞核穿梭至胞质内,继而与αENaC 启动子解离,失去对αENaC 转录抑制作用, 从而激活转录, 上调αENaC 水平,促进肺泡AFC,从而改善ARDS 的预后。FOXO1通过介导PI3K/AKT 信号调控αENaC mRNA 的表达。
