犬1 型腺病毒E1B-55K 蛋白的结构预测及分析
2020-12-15郑伟刘晓颖廉士珍张蕾张海玲吕爽李亚丽王中英闫喜军朱言柱
郑伟,刘晓颖,廉士珍,张蕾,张海玲,吕爽,李亚丽,王中英,闫喜军,朱言柱※
(1.中国农业科学院特产研究所,吉林 长春 130112;2.吉林农业大学中药材学院,吉林 长春 130117;3.吉林大学第一医院,吉林 长春 130021;4.华威特科技有限责任公司,江苏 泰州 100085)
犬1 型腺病毒(CAdV-1)和犬2 型腺病毒(CAdV-2)属于犬腺病毒(canine adenovirus,CAV)科。其中CAdV-1 的基因组与其它腺病毒有相似的基因结构,即单分子、线状和双股DNA,长30~31kb,且DNA两侧的末端有反向重复序列,5’端有末端蛋白。CAdV-1基因组包含E1-E4 基因和L1-L5 基因,病毒直径约为80 nm。CAdV-1 的E1 区包括E1A、E1B-55K 和E1B-19K。其中E1B-55K 可延缓细胞过早凋亡,并协助mRNA 的翻译。CAdV-1 无囊膜,有衣壳结构,且为20 面立体对称,其纤突长度在45~ 47 nm 范围内,特异性抗原位于纤突的基部,细胞受体可与顶端的knob发生特异性结合[1]。CAdV-1 不仅引起狐狸和犬发病,还可引起狼、黑熊和臭鼬等发病。犬、狼表现为肝炎变化,狐狸和黑熊表现为脑炎,前者引发肝皮质和实质细胞长时间出血,后者临床症状为发烧、腹泻、精神高度兴奋,严重时还伴随便血、共济失调和意识障碍等[2-4]。CAdV-1 与巴氏肺炎杆菌共同感染幼犬[5],对病死幼犬进行尸检,组织病理学显示肝、脾和淋巴结肿大,心内膜和脑膜有出血点。
生物信息学融合了计算机科学和生命科学,主要进行生物信息的采集、存储和结果解释等,基因组学和蛋白质组学是其研究的重点,尤其是药物设计,蛋白质比对和分子进化等。米春娟[6]通过生物信息学方法探索不同的运动对心脏蛋白质组的影响,结果发现运动对机体组织器官和血液的蛋白质组有重塑作用,促进对心血管疾病的治疗。马素珍[7]等以人的HNRNPA1基因为实验材料,采用生物信息学方法预测其性质,发现HNRNPA1 主要存在于细胞核中,调控RNA 的成熟。金琦芳[8]采用生物信息学方法分析了CsANS 基因氨基酸,预测CsANS 的相应理化性质,并结合荧光定量PCR 技术,证实光照强弱调控CsANS 基因的表达。郭慧[9]通过生物信息学方法分析了甘蓝AP2/ERF-B3的亚基因序列BoAP2/ERF1 和BoAP2/ERF2,结果发现AP2/ERF 具有信号转导的功能。
因此,通过以上分析,我们发现E1B-55K 在延缓细胞过早凋亡和协助mRNA 的翻译过程中发挥重要作用,为更进一步利用E1B-55K,我们采用生物信息学分析方法对其蛋白的结构进行预测,为其下一步应用奠定基础。
1 材料与方法
1.1 材料
犬1 型腺病毒E1B-55K 蛋白的DNA 序列:TGGAGCAGGATTCAGATCTGGAGTCAGGCCGCG CGACTAATCAACGACCTCCCAGAGTCCGTGTTC GAGGGGCAGGGGTCCGTGGTAGAGGAAGAGTG CGGAGAAGAGCACTTAGCGAGGGACAGCGAC GATCCCTTTTTCGACTAGACGATCTGCAGCT TCCAGATTCCCTGTATGTTACGCGAGCTCTGCA ACGGGACCATGCTTTGGAAATGCCTAGAGGGC AGGTAGATTTTAGCTTGATTGAGGCTGAGGAG AGGAGGGCCGGTCCTACGGACGAGTGGTAT TTTGAATCTGTTAAAACTTACAGGGCTAAGCCG GGGGATGATCTCCAGACCTTAATCAAAAATTAT GCCAAGATTTCTCTGGAATGTGGGGCTGTGTAT GAAATAAACTCTAAGATTGTGGTGACGGGGG CTTGTTATATAATTGGTAATTGTGCTGTACTTAGG GCTAACCTGCCGGTAGGGACTGCAATGTTTGAG GTTTTGAATGTAGATGTTATTCCGTCAATTGGTT TTATGGAAAGGATAGTGTTTTCAAATATTCTTTT TGATTGCAGGAGTACCACAGCTGTAGTGTGTTG CATTAGTGAAAGAAATACGCTCTTTCACAAT TGTGTCTTTTCCGGTCCACACATGCTGTGCTTG GATATTAGGGCGGGGGCCGAAGTGAGGGGATG TCATTTTGTGGGTGCGGTGTGTGCTCTGCGTA GCAAGGGTTTGTATAGTGTTAGAGTGAGAAATA GCATCTTTGAAAAATGTGCTTTTGGGGTAGTGA GCGGCTCCAAGGCTTCCATTAGCCACAGTATGT TTAAAGACTGTGCTTGCTGTATTATGTTTGGGG GACAGGGCACTATCGCACATAGTCATTTTA TGGCGACCACTTGTACTGATACACCTATGAACC TGCAATTATGTACTTGTGAGGGGAATGGAAGTC ATGTGGTTCCTCTGGGAAATATTCACTTTGCT TCTAATCGGGAAGCCCCGTGGCCTACATTTAAC GCGAACGTTTTGGTTCGGGTACGTTTATACATG GGCCGGCGCCGGGGAGTGTTTCATCCTAAGCAG TCAACATTTTCTATGTGTGTCATTGCCGCTCCA AGAGGGGTTGTGCAAAGAATCTATCTGTTCA GTGTGTATGATGCAACCTGCGCCATTTTGCAACT GGGCGAAGCAGGTGATGCTGCTACCGAAAGA CTGTGTACCTGCGGTATGAGGCATAACACCCCTT CTTTGAGGGCTGCTTATGTTACTGACACGAGGA TTGATCGGGAAATAAATTCCCAAGACACGGCG GAGTTTTTTAGCAGTGATGAAGATAACTTATAA。
1.2 方法
1.2.1 E1B-55K 理化性质在线预测 采用SnapGene软件将E1B-55K 翻译为相应的氨基酸序列,并通过Protparam(网站https://web.expasy.org/protparam/)分析E1B-55K 的等电点、氨基酸组成和稳定系数等。
1.2.2 E1B-55K 磷酸化和糖基化位点在线预测 采用NetPhos 3.1 Server(网站http://www.cbs.dtu.dk/services/NetPhos)预测E1B-55K 的磷酸化潜在位点。利用NetOGlyc 1.0 Server 预测E1B-55K的潜在糖基化位点。
1.2.3 E1B-55K 亲疏水性与跨膜区结构在线预测 采用ProtScale(网站https://web expasy org/protscale/)分析E1B-55K 亲疏水性。利用TMHMM Server 2.0(网址http://www.cbs.dtu.dk/services/TMHMM)预测E1B-55K 的跨膜区结构。
1.2.4 E1B-55K 信号肽在线预测 采用德泰生物推出的测评软件(网站www.detaibio.com/tools/signal-peptide.html)预测信号肽,可精确到具体的氨基酸位点。
1.2.5 E1B-55K 二级结构在线预测 通过网站https://npsa-prabi.ibcp.fr/NPSA/npsa_sopma.html 预测E1B-55K的二级结构,并可知 折叠、螺旋和无规卷曲各含有的氨基酸数目。
1.2.6 E1B-55K 三级结构在线预测 采用phyre2(网站http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)预测E1B-55K 的三级结构,并分析此蛋白的空间结构、可信度和覆盖率等。
1.2.7 E1B-55K 抗原表位在线预测 采用Predicting Anti-genic Peptides(网站http://imed.med.ucm.es/Tools/antigenic.pl)预测E1B-55K 的抗原决定簇。通过ABCpred(网站https://webs.iiitd.edu.in/raghava/abcpred/ABC_submission.html)预测E1B-55K 的B 细胞抗原表位。
2 实验结果
2.1 E1B-55K 的氨基酸序列和理化性质预测
E1B-55K 蛋白通过SnapGene 软件翻译的氨基酸序列为:WSRIQIWSQAARLINDLPESVFEGQGSVVEEE CGEEHLARDSDDPFFD*TICSFQIPCMLRELCNGT MLWKCLEGR*ILA*LRLRRGGPVLRTSGILNLLK LTGLSRGMISRP*SKIMPRFLWNVGLCMK*T LRLW*RGLVI*LVIVLYLGLTCR*GLQCLRF*M*M LFRQLVLWKG*CFQIFFLIAGVPQL*CVALVK EIRSFTIVSFPVHTCCAWILGRGPK*GDVILWVRC VLCVARVCIVLE*EIASLKNVLLG**AAPRLPLATV CLKTVLAVLCLGDRALSHIVILWRPLVLIHL*TCN YVLVRGMEVMWFLWEIFTLLLIGKPRGLHLTRTF WFGYVYTWAGAGECFILSSQHFLCVSLPLQEGLC KESICSVCMMQPAPFCNWAKQVMLLPKDCVPAV*GITPLL*GLLMLLTRGLIGK*IPKTRRSFLAVM KITY。氨基酸数量为424,但密码子共有444个,结果见表1。其中碳(C)、氢(H)、氮(N)、氧(O)和硫(S)分别为2199、3535、575、538 和39,共6886个原子即C2199H3535N575O538S39。有25个负电残基和46个正电残基。分子量为47887.13,理论等电点为9.29。失稳指数(II)为42.53(42.53 即为不稳定指数),我们将此蛋白归类为不稳定的蛋白。
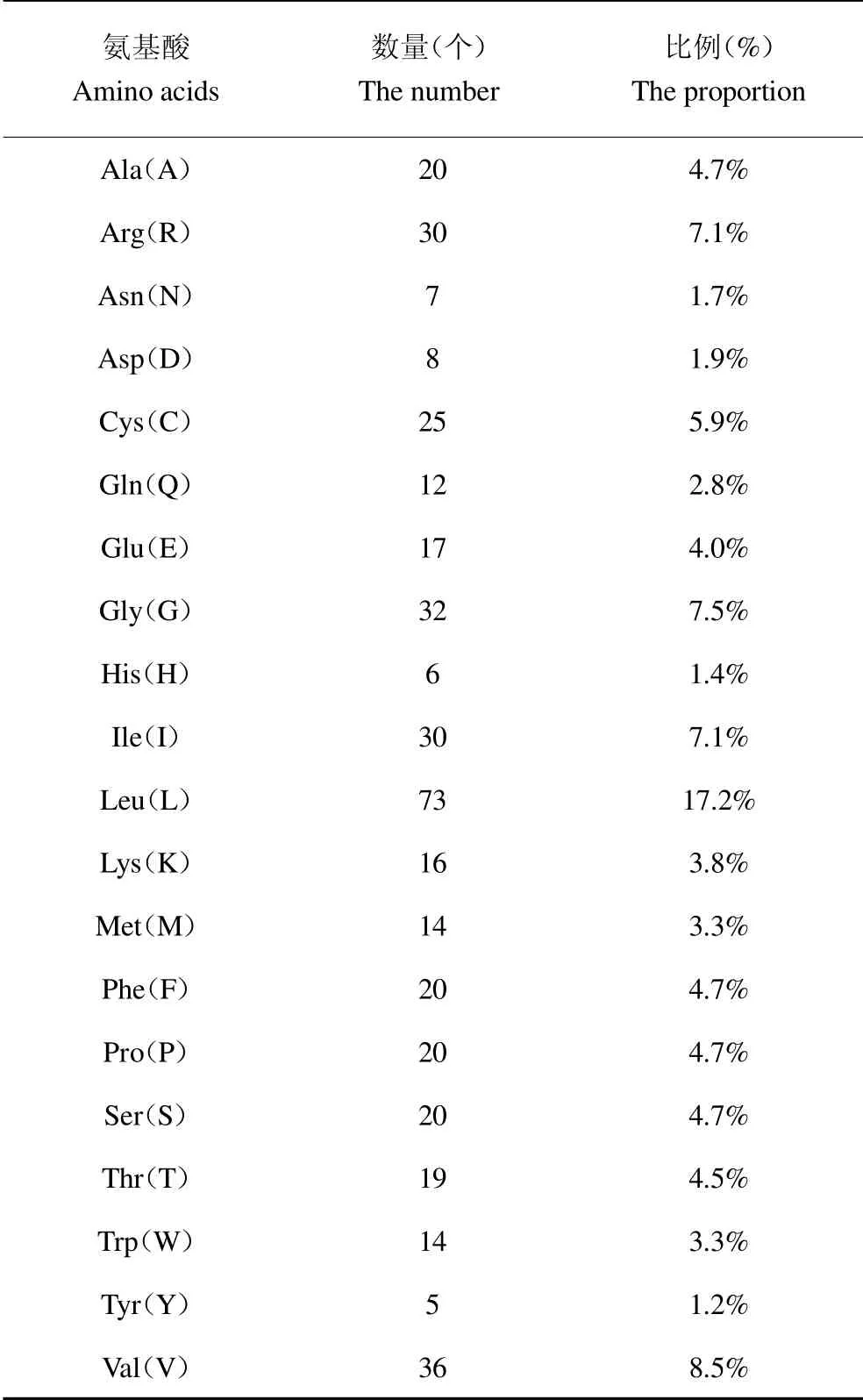
表1 E1B-55K 氨基酸组成表Table 1 Amino acid composition of E1B-55K
2.2 E1B-55K 磷酸化和糖基化位点的预测结果
使用NetPhos 3.1 Server 进行E1B-55K 的磷酸化潜在位点的预测,见图1,发现E1B-55K 有13个丝氨酸位点(8、20、27、42、91、103、111、196、271、341、348、359 和415),9个苏氨酸位点(49、90、146、193、253、258、329、392 和412),在第326 位有1个酪氨酸潜在位点。通过NetOGlyc 1.0 Server 预测E1B-55K 的糖基化潜在位点,见图2,发现潜在的糖基化位点存在于第64 位且只有1个。
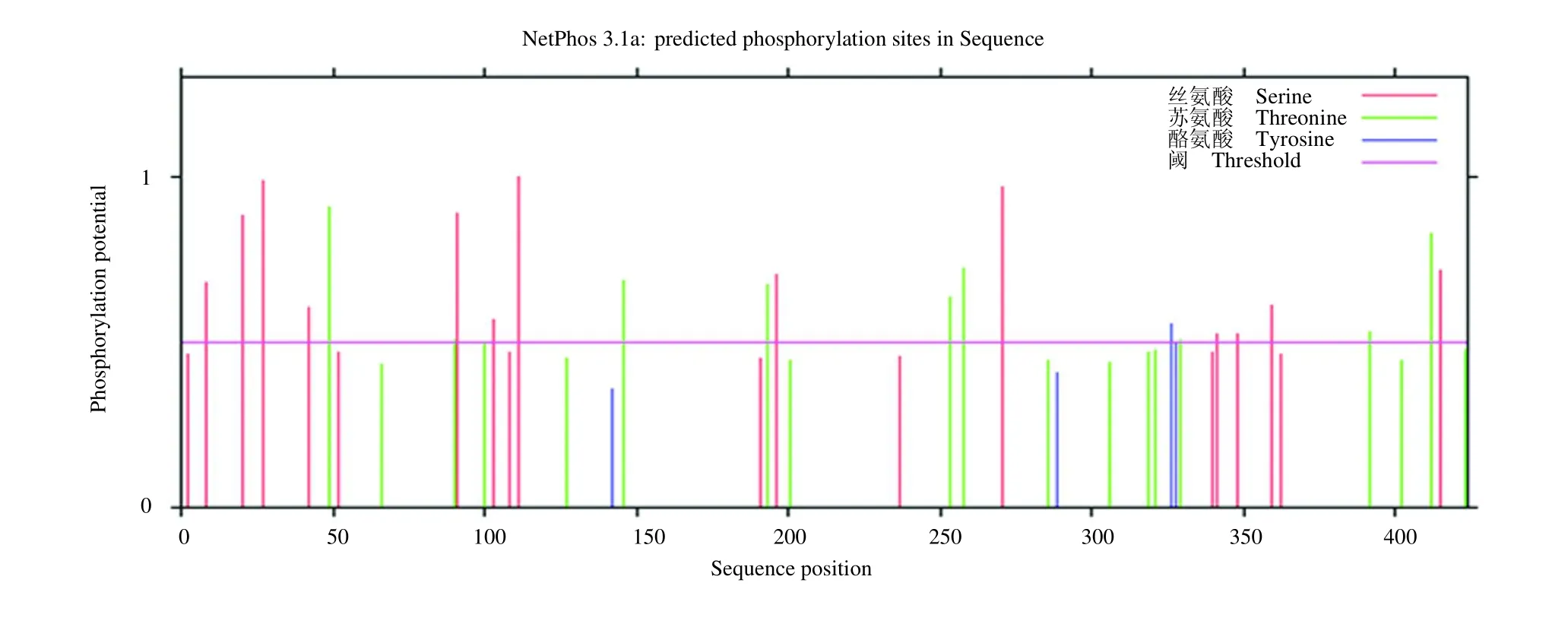
图1 E1B-55K 磷酸化位点的预测Fig.1 E1B-55K phosphorylation site prediction
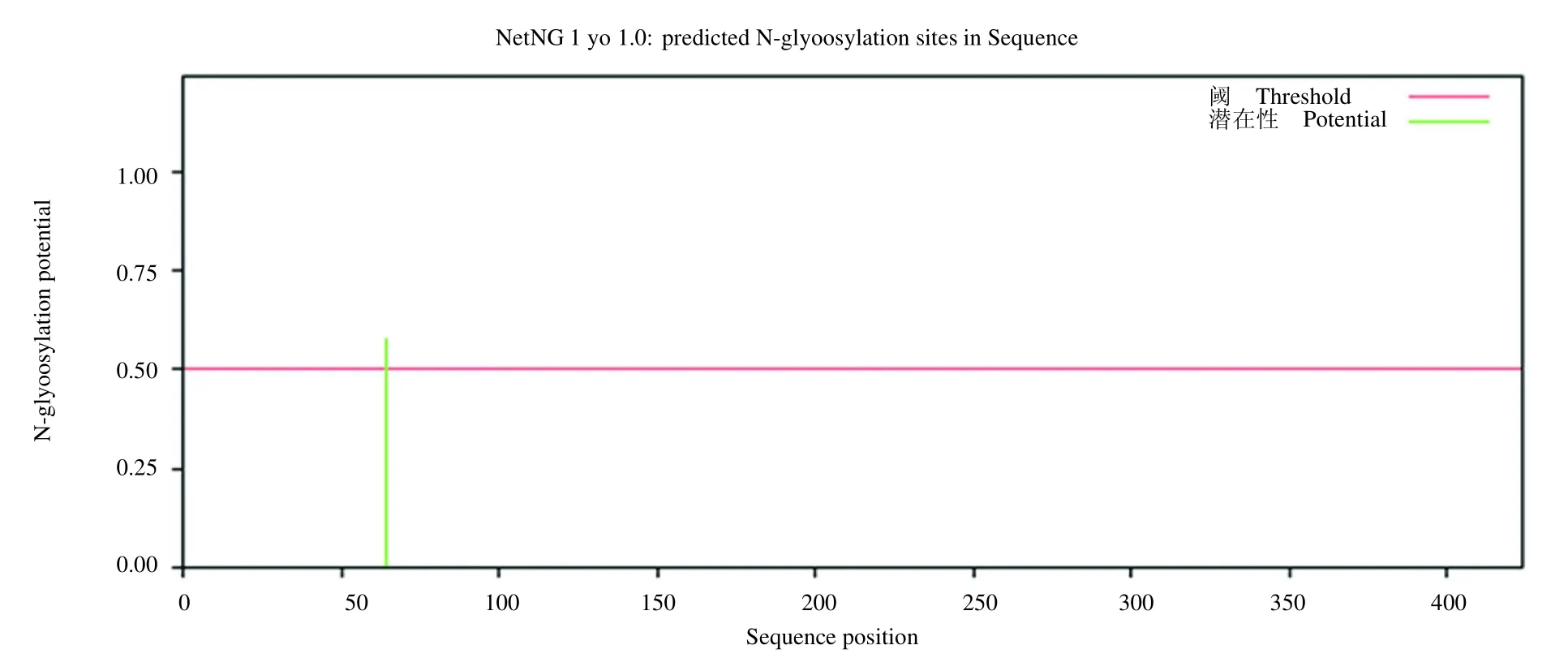
图2 E1B-55K 糖基化位点的预测图Fig. 2 Prediction of the glycosylation site of E1B-55K
2.3 E1B-55K 亲疏水性与跨膜区结构的预测结果
通过ProtScale 预测E1B-55K 的亲疏水性,发现E1B-55K 蛋白是平均亲水系数为0.662 的疏水蛋白,见图3。利用TMHMM Server 2.0 预测E1B-55K 的跨膜区结构,见图4,结果显示E1B-55K 形成跨膜结构。
2.4 E1B-55K信号肽的预测结果
利用德泰生物推出的测评软件预测信号肽,见图5,结果发现E1B-55K 蛋白无信号肽。
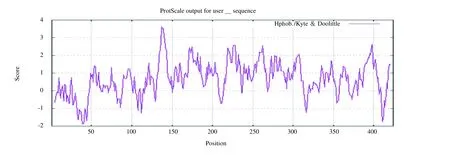
图3 E1B-55K 亲疏水性形成图Fig. 3 Hydrophilic and hydrophobic formation of E1B-55K

图4 E1B-55K 跨膜区形成图Fig. 4 Formation of E1B-55K transmembrane region
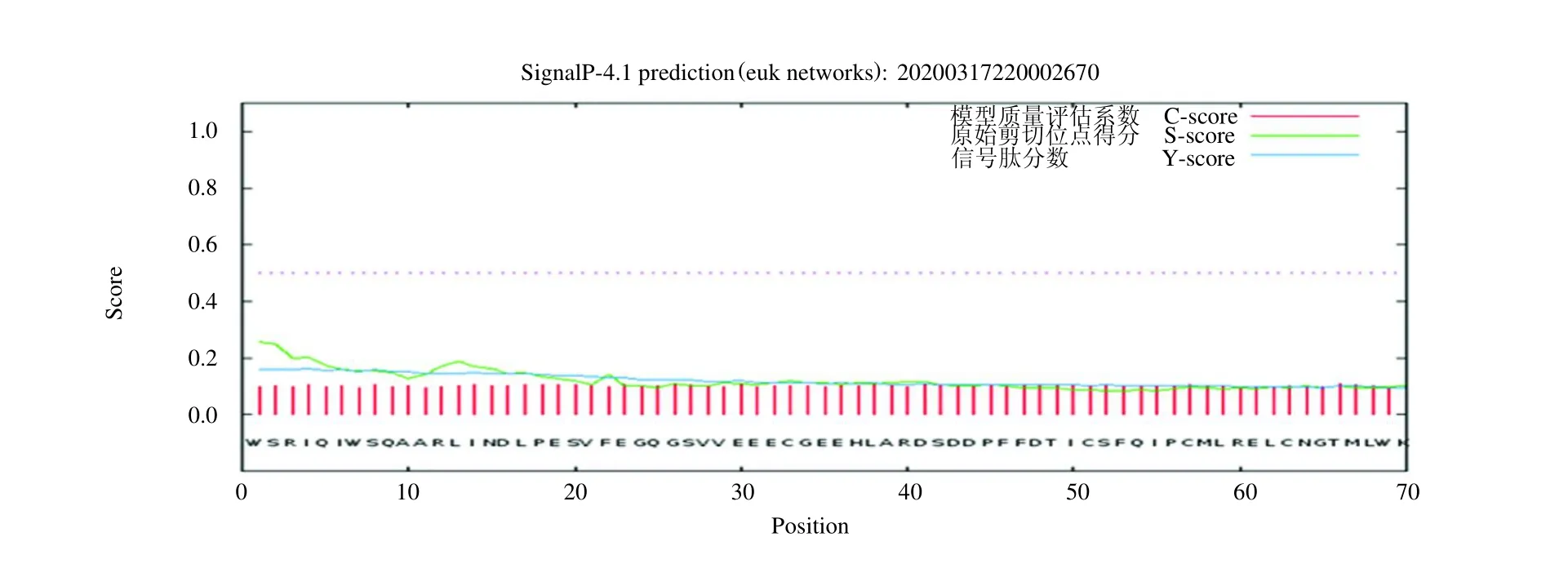
图5 E1B-55K 信号肽预测图Fig 5 Prediction diagram of E1B-55K signal peptide
2.5 E1B-55K二级结构的预测结果
通过网站 https://npsa-prabi.ibcp.fr/NPSA/npsa_sopma.html 预测E1B-55K 的二级结构,见图6,结果发现53个氨基酸(12.50%)参与 折叠的形成,164个氨基酸(38.68%)参与 螺旋的形成,有100个氨基酸(23.58%)和107个氨基酸(25.24%)分别构成了无规卷曲和延伸链。
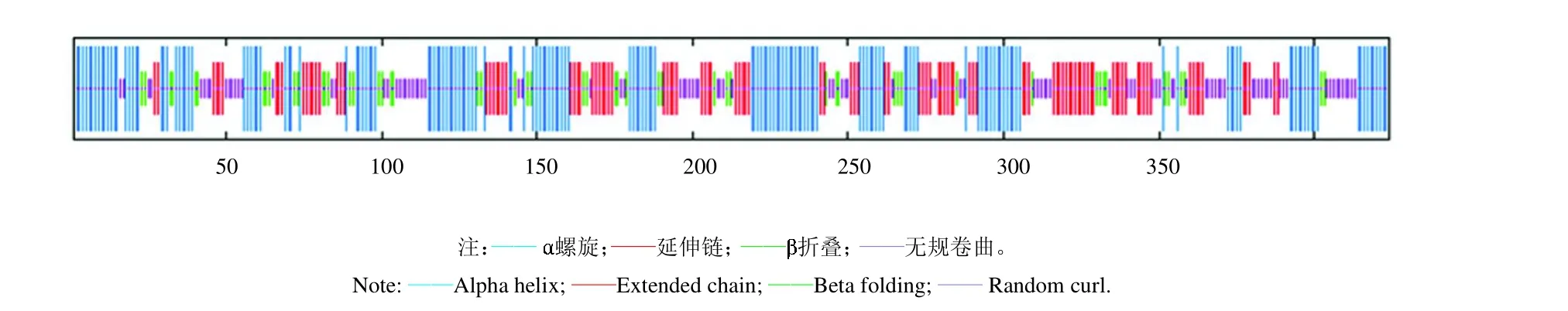
图6 E1B-55K 二级结构预测图Fig. 6 Secondary structure prediction diagram of E1B-55K
2.6 E1B-55K三级结构的预测结果
采用phyre2 预测E1B-55K 蛋白的三级结构,见图7,结果发现E1B-55K 蛋白的可信度和覆盖率分别为38.6%和2%。
2.7 E1B-55K抗原表位的预测结果
采用Predicting Anti-genic Peptides 预测E1B-55K蛋白抗原决定簇,见表2,结果发现,E1B-55K 蛋白有17个抗原决定簇。通过ABCpred 预测E1B-55K 的B细胞抗原,见表3,结果发现45个优势的B 细胞抗原表位存在于E1B-55K 蛋白中。

图7 E1B-55K 三级结构的测定生成图Fig. 7 Generated diagram of determination of E1B-55K tertiary structure

表2 E1B-55K 抗原表位的预测表Table 2 Prediction table of antigen epitope of E1B-55K
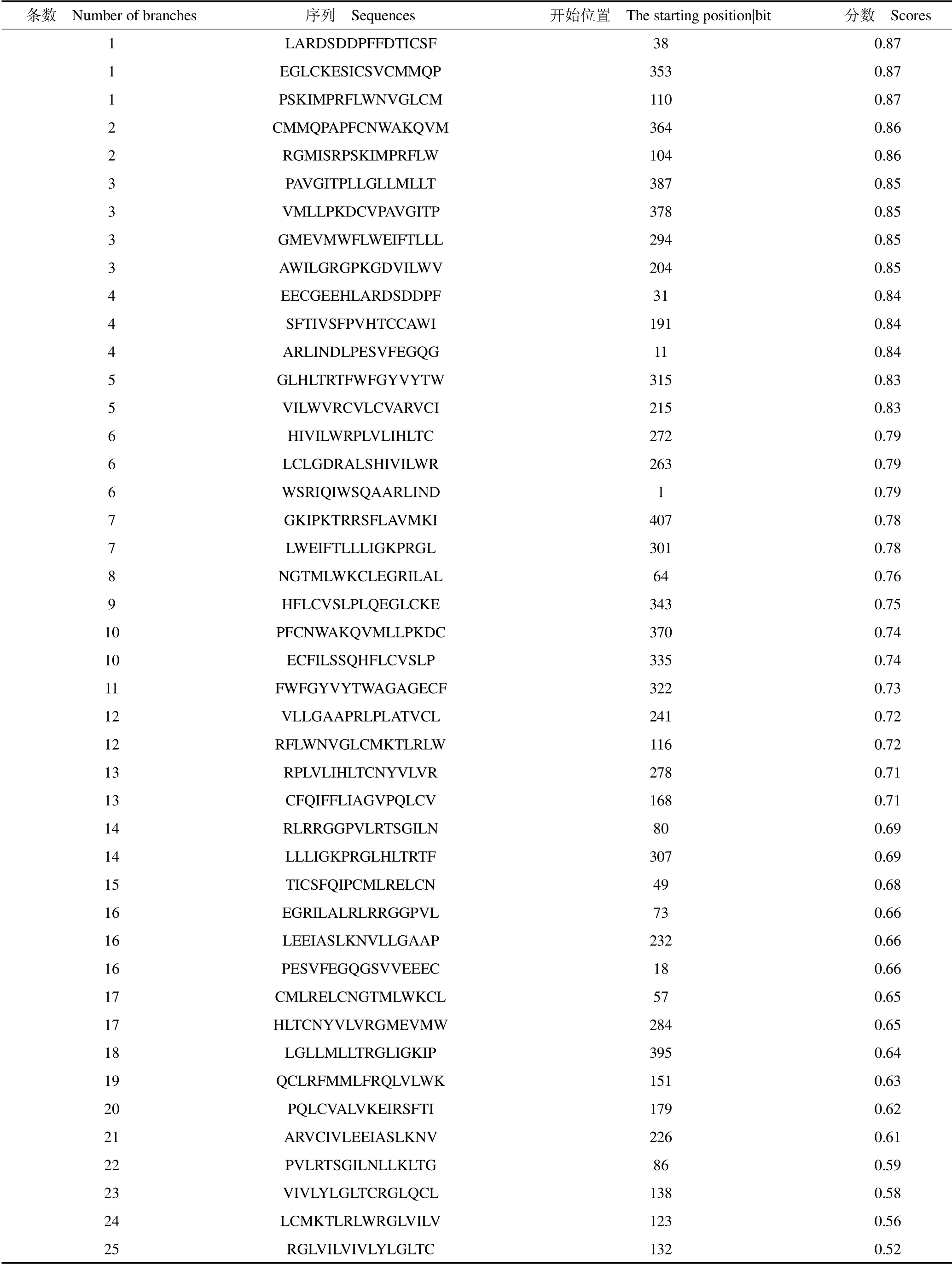
表3 E1B-55K 的B 细胞抗原的预测Table 3 Prediction of B cell antigen of E1B-55K
3 讨论
CAdV-1 的E1区包括E1A、E1B-55K 和E1B-19K。其中E1B-55K 可延缓细胞过早凋亡,并协助mRNA的翻译。使用生物信息学方法预测E1B-55K 蛋白的理化性质、亲疏水性、跨膜区结构、二级和三级结构、磷酸化及糖基化位点和抗原表位,并分析其功能和结构。结果发现E1B -55K 有424个氨基酸。原子组成为C2199H3535N575O538S39,分子量为47887.13,带负电与正电的氨基酸残基数分别为25 和46,不稳定指数为42.53。E1B-55K 蛋白有23个磷酸化位点。只有1个糖基化位点位于第64 位。E1B-55K 是平均亲水系数为0.662 的疏水蛋白,无信号肽和跨膜区结构。二级结构中 折叠占12.5%、螺旋占38.68%、无规卷曲和延伸链分别为23.58%和25.24%。在三级结构预测时,获得E1B-55K 蛋白的可信度和覆盖率分别为38.6%和2%。有17个抗原决定簇和45个优势的B 细胞抗原表位存在于E1B-55K 蛋白中。预测E1B-55K 的性质、结构和功能有助于E1B-55K 蛋白的表达和纯化。
预测E1B-55K 理化性质与一级结构后,可利用E1B-55K 的亲水胶体性质,使用透析的方法达到纯化E1B-55K 蛋白的目的;根据获得的等电点,可利用电泳法分离纯化E1B-55K;利用蛋白质的变性失活实现消毒灭菌;了解E1B-55K 蛋白的相关性质有利于目的蛋白的分离,可促进下一步反应的进行。
蛋白的磷酸化是调节和控制蛋白功能和细胞信号传递最重要的反应机制之一。酪氨酸与丝氨酸位点不仅能进行蛋白的磷酸化反应,还可激活蛋白活力。多蛋白复合体是酪氨酸与其他蛋白作用形成的,多蛋白复合体使细胞分裂和DNA 复制加速,并促进蛋白磷酸化的循环。2017年,钱海[10]等人将胃癌细胞EGFR 介导的蛋白进行磷酸化,并联合双向电泳和质谱分析技术,发现Ⅱ型cGMP 依赖性蛋白激酶抑制EGFR 蛋白转导通路的激活,进而影响胃癌细胞的活动。激发蛋白酪氨酸磷酸化的酶是酪氨酸激酶,此酶有助于进行抗肿瘤药物的研制与开发。刘顺利[11]以结合蛋白(FSCB)为实验材料利用蛋白激酶A(PKA)进行体外磷酸化实验,将产物进行电泳,用抗磷酸化PKA 底物抗体和抗磷酸化酪氨酸抗体进行免疫印迹试验,结果发现FSCB可促进精子获能,PKA磷酸化和酪氨酸磷酸化均有发生。E1B-55K 蛋白有23个磷酸化位点,其中丝氨酸、苏氨酸和酪氨酸分别为13个、9个和1个。E1B-55K 蛋白的磷酸化反应促进机体进行共价修饰,降低DNA 相互结合的几率,使DNA 解螺旋进而调控细胞周期。
蛋白质糖基化可提高蛋白的稳定性,促进蛋白构象的正确折叠,有利于蛋白定位等[12]。蛋白糖基化之后对热变形有一定的抗性,糖蛋白是蛋白质经糖基化作用形成的,调节蛋白的功能。蛋白糖基化主要通过调节蛋白表面的糖链,调控蛋白的半衰期、溶解度和活性。通过与蛋白相适应的载体进行糖基化反应,可显著提高蛋白的治疗效果并减小毒副作用,促进人体对药物的消化吸收[13]。大多数参与机体固有免疫和适应性免疫的关键分子都是糖蛋白,其影响了病毒对机体的繁殖与侵袭,比如艾滋病,其受体为CD4,当CD4 的4个N-糖基化位点全部表达时,CD4 形成正确折叠导致艾滋病[14]。采用生物信息学软件预测E1B-55K 蛋白,发现在第64 位存在1个糖基化位点,E1B-55K 蛋白糖基化对蛋白质的翻译和信号的传递具有重要作用,并促进内质网折叠成正确的多肽。
蛋白的亲疏水性决定 螺旋的形成,与蛋白的稳定性有关。蛋白的亲疏水性是形成二级结构、三级结构和结构域等的基础。CAdV-1 中的E1B-55K 蛋白为疏水蛋白,采用疏水作图法,分析E1B-55K 蛋白多肽链中不同肽段的疏水性,预测其抗原决定簇,为分析抗原决定簇奠定基础,同时也促进机体蛋白折叠成更加复杂的高级结构,发挥生物学功能。
蛋白质跨膜区是含有20~25个氨基酸残基的 螺旋结构,但绝大多数都是疏水氨基酸。吕丽珊[15]采用RT-PCR 技术将流感病毒HA 跨膜区基因克隆到pFast Dual 载体,将获得的质粒进行转化,结果发现流感病毒HA 跨膜区能增加IBV 的交叉免疫性。E1B-55K 蛋白形成的跨膜结构,有利于E1B-55K 蛋白在生物体的定位,协助膜蛋白与细胞膜的黏附,为分析E1B-55K 的功能和表达方式提供帮助。
疏水氨基酸是构成蛋白信号肽的主要元件,在N和C末端分别有正电氨基酸和极性氨基酸。将蛋白引导到细胞各种亚细胞器内是由信号肽完成的。徐栋生[16]采用PCR 技术用不同类型信号肽代替肝细胞生长因子的信号肽,并载入中国仓鼠卵巢细胞,以此来挑选适合其生长的最佳信号肽,促进中国仓鼠卵巢细胞分泌外源蛋白。齐安生[17]利用PCR 方法将带有和不带有信号肽序列的溶血素基因分别转载到大肠杆菌中,进行溶血和免疫印迹试验,结果表明带有信号肽序列的溶血素基因有利于大肠杆菌的跨膜转运。通过分析发现CAdV-1 中的E1B-55K 蛋白无信号肽,说明E1B-55K不是分泌型蛋白。
掌握蛋白的二级结构和三级结构有利于研制亚单位疫苗。张德峰[18]采用生物信息学方法预测结核分枝杆菌CarD 蛋白的结构,结果发现CarD 可与RNA 聚合酶结合,控制转录方向,并且CarD 的C 和N 末端结构域稳定,可作为特异性抗结核的新靶标。白皓等[19]首先采用实时荧光定量PCR 技术研究小鼠CYP2J5基因的差异表达,随之利用在线软件预测CYP2J5 基因结构,结果发现该基因蛋白的二、三级结构在性激素的合成、脂代谢及脂肪酸代谢中发挥重要作用。
蛋白的抗原表位可人工合成,刺激机体产生抗体反应,增强机体免疫原性。程凯慧等[20]利用基因合成技术合成牛冠状病毒(BCoV)S 蛋白抗原表位的基因串联体,进行基因重组,转载到大肠杆菌中并获得了BCoV抗血清,促进BCoV多表位疫苗的研究。于天飞[21]以抗原表位C 的编码核酸为实验材料,以串联方式进行重组蛋白的表达,结果发现重组蛋白的抗原性增强,有利于进行猪的传染性胃肠炎的血清学诊断。E1B-55K蛋白有17个抗原决定簇和45个优势的B 细胞抗原表位,促进E1B-55K 与其他蛋白的结合,增强生物体细胞免疫和体液免疫。
因此,预测E1B-55K 蛋白的二和三级结构有利于进行蛋白的生物合成与临床用药的研究。预测E1B-55K 蛋白的抗原表位,有助于筛选相应的抗原决定簇和靶向目标分子,可进一步利用其研发疫苗。虽然本实验预测了E1B-55K 的理化性质和结构特征,为其应用奠定基础,但是仍需开展实验进行证实。
