甲钴胺联合谷胱甘肽预防卵巢癌患者紫杉醇化疗所致外周神经毒性的研究
2020-12-14钟丽萍潘月芬沈俊俊齐全廖海红姜亦珍韩书文
钟丽萍 潘月芬 沈俊俊 齐全 廖海红 姜亦珍 韩书文
[摘要] 目的 觀察甲钴胺联合谷胱甘肽对卵巢癌患者紫杉醇化疗所致外周神经毒性的预防作用。方法 选取2015年6月~2018年6月我院收治的使用紫杉醇化疗的卵巢癌患者共106例,随机分为观察组53例和对照组53例。两组患者均给予TC方案(紫杉醇+卡铂)化疗,对照组给予甲钴胺预防神经毒性。观察组给予甲钴胺联合谷胱甘肽预防神经毒性。在治疗3周期后、治疗6周期后、化疗结束6个月后,分别对两组的外周神经毒性进行评价。化疗期间,密切观察并记录两组患者出现外周神经毒性症状的时间及出现外周神经毒性症状时紫杉醇使用量。比较两组患者化疗前后一般生活状况评分(KPS评分)。 结果 治疗3周期后、治疗6周期后及化疗结束6个月后,观察组外周神经毒性发生率分别为37.74%、47.17%、33.96%,均明显低于对照组(P<0.05)。治疗期间,观察组患者出现外周神经毒性的时间为(15.25±1.78)周,晚于对照组的(10.32±1.51)周(P<0.05),紫杉醇使用量为(431.78±42.32) mg/m2明显大于对照组的(327.12±31.71) mg/m2(P<0.05)。治疗后,观察组的KPS评分(75.33±7.42)分高于对照组的(70.36±7.62)分(P<0.05)。 结论 甲钴胺联合谷胱甘肽能有效预防紫杉醇所致卵巢癌患者外周神经毒性,值得临床参考并进一步推广应用。
[关键词] 甲钴胺;谷胱甘肽;卵巢癌;紫杉醇;外周神经毒性
[中图分类号] R730.53 [文献标识码] B [文章编号] 1673-9701(2020)28-0117-04
Study on mecobalamine combined with Glutathione to prevent paclitaxel chemotherapy-induced peripheral neurotoxicity in patients with ovarian cancer
ZHONG Liping PAN Yuefen SHEN Junjun QI Quan LIAO Haihong JIANG Yizhen HAN Shuwen
Department of Medical Oncology, Huzhou Central Hospital in Zhejiang Province, the Affiliated Central Hospital Huzhou University in Zhejiang Province, Huzhou 313000, China
[Abstract] Objective To observe the preventive effect of mecobalamin combined with glutathione on peripheral neurotoxicity induced by paclitaxel chemotherapy in patients with ovarian cancer. Methods A total of 106 patients with ovarian cancer who were admitted and treated with paclitaxel chemotherapy in our hospital from June 2015 to June 2018 were selected and randomly divided into the observation group (53 cases) and the control group (53 cases). Both groups of patients were given TC regimen (paclitaxel+carboplatin) for chemotherapy. The control group was given mecobalamin to prevent neurotoxicity. The observation group was given mecobalamin combined with glutathione to prevent neurotoxicity. After 3 cycles of treatment, 6 cycles of treatment, and 6 months after the end of chemotherapy, the peripheral neurotoxicity of the two groups were evaluated. During chemotherapy, the onset time of peripheral neurotoxicity symptoms and the dosage of paclitaxel at the onset of peripheral neurotoxicity symptoms were closely observed and recorded. The general living condition score(KPS score) before and after chemotherapy was compared between the two groups. Results After 3 cycles of treatment, 6 cycles of treatment, and 6 months after the end of chemotherapy, the incidence rate of peripheral neurotoxicity in the observation group was 37.74%, 47.17% and 33.96% respectively, which were significantly lower than those in the control group(P<0.05). During treatment, the time of peripheral neurotoxicity in the observation group was(15.25±1.78) weeks was later than that in the control group of(10.32±1.51) weeks(P<0.05). The dosage of paclitaxel was(431.78±42.32) mg/m2 was significantly greater than that in the control group(327.12±31.71) mg/m2(P<0.05). After treatment, the KPS score in the observation group of(75.33±7.42) points was higher than that in the control group(70.36±7.62) points (P<0.05). Conclusion Mecobalamin combined with glutathione can effectively prevent paclitaxel-induced peripheral neurotoxicity in the patients with ovarian cancer, which is worthy of clinical reference and further popularization and application.
[Key words] Mecobalamin; Glutathione; Ovary cancer; Paclitaxel; Peripheral neurotoxicity
卵巢癌是女性生殖系统最常见的恶性肿瘤之一,其发病率高,病情进展迅速,且预后较差,死亡人数约占总体癌症死亡人数的5%,是妇科癌症致死的主要原因之一[1-2]。卵巢癌可分为六个主要亚型,即浆液性癌、黏液性癌、子宫内膜样癌、移行细胞癌、透明细胞癌和鳞状细胞癌[3]。手术和化疗是卵巢癌最主要的治疗手段。紫杉醇是治疗卵巢癌的最常用化疗药物之一,该药物在延长患者生存时间、提高治疗效果等方面均具有重要意义,但在临床治疗过程中,紫杉醇可引起感觉障碍、手足麻木等剂量依赖性的外周神经毒性,导致患者生活质量下降,同时降低患者对化疗的依从性,引起后续化疗周期的药物减量甚至治疗终止,影响预后[4]。然而目前对紫杉醇化疗所致的周围神经毒性无确切的治疗及预防方法,本研究运用甲钴胺联合谷胱甘肽预防卵巢癌患者紫杉醇化疗所致外周神经毒性,取得了一定的效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年6月~2018年6月我院收治的使用紫杉醇化疗的卵巢癌患者共106例,采用随机数字法将上述对象分为观察组和对照组,每组各53例,均为女性患者。观察组年龄35~78岁,平均(56.5±5.6)岁,其中高级别浆液性癌36例、子宫内膜样癌7例、透明细胞癌5例、黏液性癌4例,低级别浆液性癌1例,KPS评分(Karnofsky)(78.31±6.67)分。对照组年龄33~76岁,平均(55.5±5.9)岁,其中高级别浆液性癌37例、子宫内膜样癌6例、透明细胞癌6例、黏液性癌3例,低级别浆液性癌1例,KPS评分(77.85±6.33)分。两组患者在年龄、肿瘤病理类型及KPS评分比较,差异无统计学意义(P>0.05),具有可比性。
入选标准[5]:①入院后影像学和病理学检查确诊为卵巢癌,并采用紫杉醇联合卡铂方案化疗的初治患者;②无严重心、肾、肝、肺或造血系统功能损害的患者;③预计生存时间≥12个月,且KPS评分≥70分的患者,均无化疗禁忌证;④年龄18~80岁;⑤本研究方案经医院医学伦理委员会批准,入选患者均签署知情同意书。
排除标准[6]:①既往接受奥沙利铂、长春新碱、顺铂和紫杉醇等能引起神经毒性药物的患者;②合并糖尿病及脑血管疾病等引起的周围神经病变者;③因肿瘤脑转移或脊髓压迫出现神经症状者;④存在认知障碍或精神疾病,无法进行语言沟通的患者。
1.2 方法
观察组和对照组患者均采用TC方案化療,具体为:紫杉醇注射液(江苏扬子江药业集团有限公司,国药准字:H20053001,批号:18070211,规格:30 mg/支)175 mg/m2,静脉滴注3 h,第1天,随后卡铂注射液(山东齐鲁制药有限公司,国药准字:H20020180,批号:6060061DA,规格:100 mg/支)AUC 5,静脉滴注1 h,第1天;21 d为一个周期,共6个周期。两组患者接受化疗的方法、剂量均无统计学差异。对照组在此基础上给予甲钴胺片(卫材中国药业有限公司,国药准字:H20143107,批号:030263,规格:0.5mg×20片),用法:化疗前1周开始直至6周期化疗全部结束,0.5 mg/次,饭后服用,3次/d。观察组予甲钴胺片+还原型谷胱甘肽针(山东绿叶制药有限公司,国药准字:H20030001,批号:17706090,规格:600 mg/支),用法:化疗第1天,于化疗前15 min内将注射用还原型谷胱甘肽1.5 g/m2溶于100 mL生理盐水中,15 min内静脉滴注;化疗第2~5天,肌内注射还原型谷胱甘肽针600 mg,共6个周期;甲钴胺片给药方式与对照组一致。
1.3 观察指标
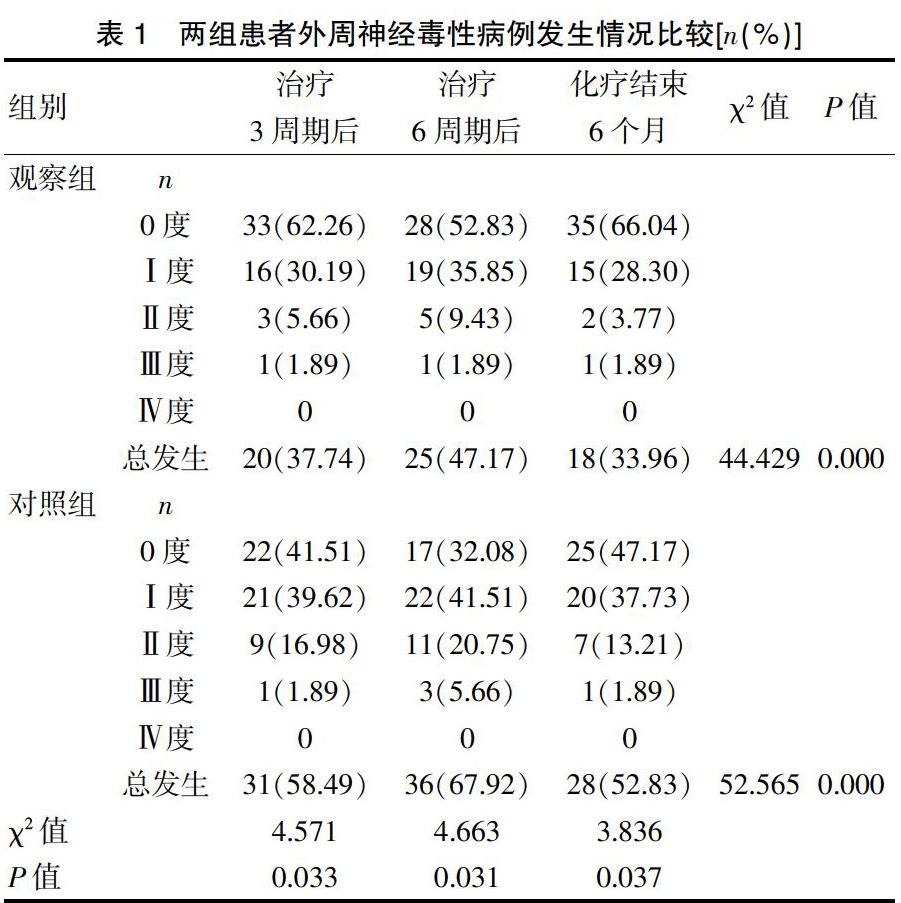
①TC方案治疗3周期后、治疗6周期后及化疗结束6个月后,对两组患者的外周神经毒性进行评价,并统计两组外周神经毒性的发生率。总发生率=(Ⅰ度例数+Ⅱ度例数+Ⅲ度例数+Ⅳ度例数)/总例数×100%。②化疗期间密切观察并记录两组患者出现外周神经毒性症状时的紫杉醇使用剂量及出现外周神经毒性症状的时间。③评估化疗前及6周期化疗结束后的一般状况。
神经毒性评价标准:参照WHO抗癌药物CIPN分度标准[7]进行严重程度分级。0度:正常。Ⅰ度:感觉异常或(和)腱反射减弱。Ⅱ度:严重感觉异常或(和)轻度无力。Ⅲ度:不能耐受的感觉异常或(和)显著运动障碍。Ⅳ度:瘫痪。
一般生活状况评定:按照KPS评分标准[8]:①正常,无症状及体征(100分);②有轻微症状及体征,能进行正常活动(90分);③有一些症状或体征,勉强进行正常活动(80分);④不能维持正常生活或工作,但生活可自理(70分);⑤偶尔需要别人的帮助,生活基本可以自理(60分);⑥常需要人照料(50分);⑦需要特别照顾和帮助,生活不能自理(40分);⑧生活严重不能自理(30分);⑨病情较重,需要支持治疗(20分);⑩垂危,临近死亡(10分)。
1.4 统计学方法
采用SPSS 22.0统计学软件对数据进行统计分析,计数资料以率(%)表示,采用χ2检验;计量资料以均数±标准差(x±s)表示,采用t检验;P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者外周神经毒性症状发生情况比较
TC方案治疗3周期后、治疗6周期后、化疗结束6个月后,观察组外周神经毒性发生率分别为37.74%、47.17%、33.96%,均明显低于对照组,差异有统计学意义(P<0.05)。见表1。
2.2 两组患者出现外周神经毒性症状时间及紫杉醇使用剂量比较
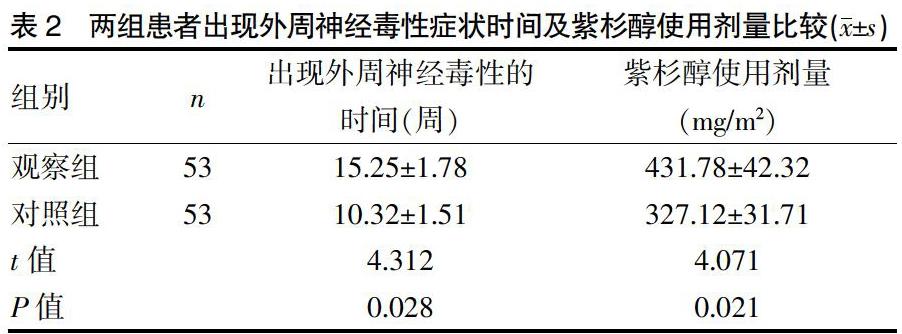
治疗期间,对照组出现外周神经毒性症状时间为(10.32±1.51)周;发生外周神经毒性症状时紫杉醇的用剂量为(327.12±31.71) mg/m2。观察组发生外周神经毒性症状时间为(15.25±1.78)周;发生外周神经毒性症状时紫杉醇的用剂量为(431.78±42.32) mg/m2。观察组出现外周神经毒性症状的时间晚于对照组(t=4.312,P=0.028),发生外周神经毒性症状时紫杉醇用剂量大于对照组,差异均有统计学意义(t=4.071,P=0.021)。见表2。
2.3两组患者生活质量KPS评分比较
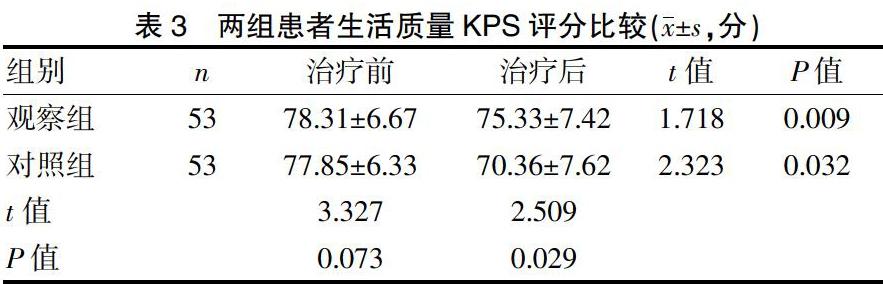
因化疗作用,观察组及对照组的生活质量均较化疗前下降,KPS评分均降低,两组差异均有统计学意义(观察组:t=1.718,P=0.009,对照组:t=2.323,P=0.032)。治疗后,观察组的KPS评分为(75.33±7.42)分高于对照组的(70.36±7.62)分,差异有统计学意义(t=2.509,P=0.029)。见表3。
3 讨论
化疗致外周神经毒性(Chemotherapy-induced peripheral neuropathy,CIPN)是化疗药物直接损伤周围神经系统而导致的一种神经毒性病变,是肿瘤患者化疗期间常见的药物剂量限制性不良反应[9]。其临床表现主要有感觉和运动异常,如四肢麻木、刺痛、冷痛觉过敏,烧灼感,手套样或袜套样异常感及步态和平衡障碍,严重者可出现肢体功能丧失及自主神经功能紊乱等,这些症状可持续数月甚至数年[10]。据统计,约30%~40%化疗患者会发生CIPN,尤其多见于应用铂类、紫杉醇类、长春新碱类等化疗药物者[11]。CIPN的出现会导致化疗强度降低、化疗时间推迟、甚至终止化疗,而这将直接影响肿瘤治疗的远期效果,降低肿瘤患者的生活质量,增加病死率[12]。紫杉醇为细胞周期特异性化疗药,其作用机制是促进微管聚合,抑制纺锤体的功能,从而抑制细胞的有丝分裂,临床广泛应用于乳腺癌、卵巢癌、胃癌等的治疗[13]。CIPN是紫杉醇常见的不良反应,也是紫杉醇剂量限制的主要因素,通常发生于累积剂量超过300 mg/m2,且累积剂量越高,CIPN的发生率越高。紫杉醇引起CIPN的确切机制尚不清楚,越来越多的证据表明,轴突转运障碍和神经元氧化应激可能是导致紫杉醇引起CIPN的主要因素[14]。由于缺少有效的预防和缓解紫杉醇所致CIPN的方法,因此目前对于其防治仍然是十分棘手的难题[15]。
甲钴胺是维生素B12的一种辅酶,可促进神经组织中核酸、蛋白质和脂类的代谢。此外,甲钴胺刺激卵磷脂的合成,修复受损的髓磷脂,从而提高神经传导速度[16]。李海金等[17]对于72例接受化疗(奥沙利铂或紫杉醇或长春新碱)的患者予以单药甲钴胺预防性用药,神经毒性发生率为75%。周海辉等[18]对34例接受奥沙利铂化疗的结直肠癌患者给予单药甲钴胺预防性用药,化疗3周期后及化疗6周期后神经毒性发生率分别为47.1%和61.8%,本研究对照组单用甲钴胺片,化疗3周期后、化疗6周期后及化疗结束6个月,神经毒性发生率分别为58.49%、67.92%、52.83%,与国内报道相一致。
谷胱甘肽是一种三肽的非必需氨基酸,具有抗氧化、保护细胞不受自由基损害的作用,从而改善紫杉醇化疗所致神经毒性[19]。李岩磊[20]对40例接受奥沙利铂方案化疗的患者给予谷胱甘肽治疗后,CIPN的发生率明显低于未使用谷胱甘肽组。同时谷胱甘肽其丰富的硫醇基团是促进甲钴胺中烷基转移作用的重要亲核剂[21],因此两者联合应用还可增强甲钴胺、谷胱甘肽转移酶超家族催化烷基转移酶的活性,理论上可增加甲钴胺的神经保护作用,从而更有效地防治紫杉醇引起的神经毒性。
本研究中,联合应用甲钴胺和谷胱甘肽预防卵巢癌患者紫杉醇化疗所致外周神经毒性,化疗3周期后,6周期后及化疗结束6个月后神经毒性发生率分别为37.74%、47.17%、33.96%,明显低于甲钴胺单药预防组,且联合应用甲钴胺和谷胱甘肽组CIPN的發生时间显著短于对照组,出现神经毒性时紫杉醇使用量明显高于对照组,说明甲钴胺和谷胱甘肽联合用药能有效减轻紫杉醇化疗所致外周神经毒性,并将紫杉醇抗肿瘤作用发挥极致。另外,本研究发现对照组患者化疗后PFS评分较观察组降低明显,进一步说明甲钴胺联合谷胱甘肽能改善化疗患者的生活质量。
综上所述,甲钴胺联合谷胱甘肽可降低紫杉醇化疗所致外周神经毒性的发生率,两者具有协同叠加作用,其效果能在单纯运用甲钴胺的基础上得到大大的提高,且能改善紫杉醇化疗患者的生活质量,值得临床参考并推广应用。但本研究样本量较小,后续需扩大样本量进行前瞻性的研究。
[参考文献]
[1] Feng RM,Zong YN,Cao SM,et al. Current cancer situation in China:Good or bad news from the 2018 global cancer statistics[J]. Cancer Commun(Lond),2019,39(1):22.
[2] Torre LA,Trabert B,DeSantis CE,et al. Ovarian cancer statistics,2018[J]. CA Cancer J Clin,2018,68(4):284.
[3] Soong TR,Dinulescu DM,Xian W,et al. Frontiers in the pathology and pathogenesis of ovarian cancer:Cancer precursors and "precursor Escape"[J]. Hematol Oncol Clin North Am,2018,32(6):915-928.
[4] 张洪琼. 吉西他滨联合顺铂方案与多西他赛联合奈达铂方案对晚期肺鳞癌的疗效比较[J]. 实用癌症杂志,2017,(7):1156.
[5] Cong J,Liu R,Hou J,et al. Therapeutic effect of bevacizumab combined with paclitaxel and carboplatin on recurrent ovarian cancer[J]. J BUON,2019,24(3):1003-1008.
[6] Hanai A. Effects of cryotherapy on chemotherapy-induced peripheral neuropathy:Self-controlled clinical trial[J]. Nihon Yakurigaku Zasshi,2019,154(5):245-248.
[7] 宋婷婷,熊绍权,陈盼,等. 参附注射液防治奥沙利铂、紫杉醇化疗所致外周神经毒性回顾性研究[J]. 中国中西医结合杂志,2019,39(1):28.
[8] Mor V,Laliberte L,Morris JN,et al. The karnofsky performance status scale. An examination of its reliability and validity in a research setting[J]. Cancer,1984,53(9):2002-2007.
[9] Wu BY,Liu CT,Su YL,et al. A review of complementary therapies with medicinal plants for chemotherapy-induced peripheral neuropathy[J]. Complement Ther Med,2019,42:226.
[10] Grisold W,Cavaletti G,Windebank AJ. Peripheral neuropathies from chemotherapeutics and targeted agents: diagnosis,treatment,and prevention[J]. Neuro Oncol,2012, 14 (l 4):45.
[11] Staff NP,Grisold A,Grisold W,et al. Chemotherapy-induced peripheral neuropathy:A current review[J]. Ann Neurol,2017,81(6):772.
[12] Magnowska M,Izycka N,Kapo?覥a-Czyz J,et al. Effectiveness of gabapentin pharmacotherapy in chemotherapy-induced peripheral neuropathy[J].Ginekol Pol,2018,89(4):200.
[13] Ewertz M,Qvortrup C,Eckhoff L. Chemotherapy-induced peripheral neuropathy in patients treated with taxanes and platinum derivatives[J]. Acta Oncol,2015,54(5):587.
[14] Banach M,Juranek JK,Zygulska AL. Chemotherapy-induced neuropathies-a growing problem for patients and health care providers[J].Brain Behav,2017,7(1):558.
[15] Kim PY,Johnson CE. Chemotherapy-induced peripheral neuropathy:a review of recent findings[J]. Curr Opin Anaesthesiol,2017,30(5):570.
[16] Han X,Wang L,Shi H,et al. Acupuncture combined with methylcobalamin for the treatment of chemotherapy-induced peripheral neuropathy in patients with multiple myeloma[J]. BMC Cancer,2017,17(1):40.
[17] 李海金,陳亚男,董良,等. 中药熏洗联合甲钴胺治疗化疗致周围神经病变临床观察[J]. 浙江中西医结合杂志,2019,29(4):298.
[18] 周海辉,张海霞,葛卫红,等. 甲钴胺联合维生素B6预防奥沙利铂所致神经毒性疗效观察[J]. 中国药师,2019, 22(1):84.
[19] Coriat R,Alexandre J,Nicco C,et al. Treatment of oxaliplatin-induced peripheral neuropathy by intravenous mangafodipir[J]. J Clin Invest,2014,124(1):262.
[20] 李岩磊. 谷胱甘肽预防奥沙利铂所致神经毒性的临床效果观察[J]. 中国现代药物应用,2014,8(19):143.
[21] 张振. 甲钴胺联合谷胱甘肽对草酸铂化疗致神经毒性的预防效果[J]. 海军医学杂志,2018,39(5):413.
(收稿日期:2020-04-02)
