基于适配体杂交链式反应检测郫县豆瓣中黄曲霉毒素B1
2020-12-13黄玉坤王力均车振明陈祥贵
黄玉坤,陶 璇,邵 坤,王 冲,王力均,车振明,陈祥贵,
(1.西华大学食品与生物工程学院,四川 成都 610039;2.宜宾西华大学研究院食品非热加工重点实验室,食品非热加工工程技术研究中心,四川 宜宾 644004)
黄曲霉毒素是一类化学结构相似的化合物,为二氢呋喃香豆素衍生物,其热稳定性非常强[1]。在1993年被世界卫生组织癌症研究机构划定为一类天然存在的致癌物,是毒性极强的剧毒物质[2],其中黄曲霉毒素B1(aflatoxin B1,AFB1)的毒性最强[3]。黄曲霉毒素中毒的最主要途径是食物中毒,世界各国相继出台了食品中黄曲霉毒素限量标准。中国与美国对淀粉类制品(饼干、面包、蛋糕)、发酵食品(酱油、醋、豆豉、酱)、粮食产品(麦粉、面粉)等的AFB1限量为不超过5 μg/kg[4],欧盟则规定不得检出。郫县豆瓣作为川菜发酵调味品,在发酵过程中起主要作用的微生物是曲霉属。由于传统生产工艺仍然比较粗放,在发酵过程监控不够严格和标准化的情况下,产品极易被黄曲霉污染而产生黄曲霉毒素[5-6]。因此,AFB1污染情况已作为郫县豆瓣地理标志产品标准(把豆瓣地理标准列在这里)中的质量合格要求之一进行监测。但是,由于豆瓣富含蛋白质、氨基酸、酶、色素、脂类等成分,检测基质非常复杂,实现对豆瓣中AFB1有效检测面临较大挑战。因此,研究建立一种准确、稳定、高效、快速、低成本的针对郫县豆瓣中AFB1的检测方法变得非常必要。
核酸适配体是由一般不超过100 个碱基组成的单链脱氧核糖核苷酸(ssDNA)或核糖核苷酸(RNA),能特异性结合靶标物质[7]。近年来,适配体逐渐被应用到食品安全检测领域[8-9]。目前,基于AFB1适配体的检测方法有比色传感检测法[10]、竞争性酶联适配体检测法[11]、电化学检测法[12]、毛细管电泳检测法[13]等。杂交链式反应(hybridization chain reaction,HCR)无需酶的参与,其原理是利用一条单链DNA引发2 条探针之间发生杂交反应,形成超长双链[14-15]。该反应通过对单链核苷酸进行扩增或自组装以扩大信号,提高检测方法的灵敏度[16]。操作简单、条件温和,因此广泛用于食品安全检测[17-18]。Xu Yangyang等[19]以适配体为引发剂,构建了基于HCR荧光信号放大的检测方法,用于检测葡萄球菌肠毒素B;Yu Shuang等[20]建立了基于适配体的HCR,并用于检测沙门氏菌;Wang Bin等[21]应用HCR技术研制了检测赭曲霉毒素A的超灵敏适配体传感器;Zhang Zhen等[22]将Hg2+介导的适配体与HCR信号放大反应结合,建立了谷胱甘肽的荧光检测方法,但鲜见该反应用于AFB1高灵敏快速检测方法的建立。
本研究基于适配体识别作用构建郫县豆瓣中AFB1的HCR检测体系。该体系主要由AFB1适配体、互补链(cDNA)、氧化石墨烯(graphene oxide,GO)、FAM标记的发夹1(HP1)和发夹2(HP2)组成。在此体系中,无AFB1存在时,HP1荧光被淬灭;AFB1存在时,HP1荧光恢复。在一定范围内,荧光强度与样品中AFB1的含量呈线性关系。最后将该方法用于多种郫县豆瓣样品中AFB1的测定,旨在为复杂基质的样品中AFB1的检测提供新的方法。
1 材料与方法
1.1 材料与试剂
AFB1标准储备液(1 mg/mL)、黄曲霉毒素B2(aflatoxin B2,AFB2)标准储备液(1 mg/mL)、赭曲霉毒素A、赭曲霉毒素B、玉米赤霉烯酮、伏马毒素 上海源叶生物科技有限公司;AFB1试剂盒 江苏苏微微生物研究有限公司;琼脂糖、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)(99.5%) 阿达玛斯试剂公司;GO 南京先丰纳米材料科技有限公司;DNA Marker(100~600 bp和100~1 200 bp) 北京天根生化科技有限公司;不同品牌(大弘润、川堰、品乐、真的老、丹丹、鑫宏丹、蜀味源、丽通、蜀城、鹏胜、川溪、鹃城)的郫县豆瓣购于本地超市;缓冲液(10 mmol/L Tris、5 mmol/L KCl、20 mmol/L CaCl2、120 mmol/L NaCl,pH 7.2)。
AFB1的适配体序列[23]及相关序列设计方法参考Chen Lu等[24]的报道。所有DNA序列经生工生物工程(上海)股份有限公司合成和高效液相色谱纯化。合成DNA的序列见表1。

表1 本实验所用的DNA序列Table 1 DNA sequence used in this study
1.2 仪器与设备
恒温混匀仪 杭州奥盛仪器有限公司;琼脂糖水平电泳仪 北京东南仪诚有限公司;VILBER FUSION SL4化学发光及多色荧光成像系统 锘海生物有限公司;Fluoromax-4荧光光谱仪 美国HORIBA集团公司。
1.3 方法
1.3.1 琼脂糖凝胶电泳
使用前将HP1和HP2在95 ℃变性10 min,然后缓慢冷却至室温。在缓冲液存在下,1 μmol/L cDNA;1 μmol/L HP1;1 μmol/L HP2;1 μmol/L HP1和HP2;1 μmol/L HP1、1 μmol/L HP2和不同浓度的cDNA,分别在37 ℃振荡孵育1 h。DNA产物通过琼脂糖凝胶电泳进行表征。用1×TAE缓冲液(40 mmol/L Tris-乙酸盐,1 mmol/L EDTA和20 mmol/L乙酸)制备2%琼脂糖凝胶,110 V电压下电泳40 min,并在荧光成像仪紫外光下成像。
1.3.2 基于适配体的HCR体系检测AFB1方法建立
使用前将HP1与HP2在95 ℃变性10 min,然后缓慢冷却至室温。将不同浓度的AFB1标准溶液与40 nmol/L适配体溶液混合,在37 ℃振荡孵育30 min;加入50 nmol/L cDNA溶液,继续振荡孵育30 min;再加入60 nmol/L HP1和HP2,孵育1 h。最后加入50 μg/mL GO溶液。加入缓冲液至总体积为500 μL,在37 ℃振荡孵育30 min后测定荧光强度。荧光光谱仪测定条件:激发波长为480 nm,发射波长的范围为500~600 nm。
1.3.3 基于适配体的HCR体系检测AFB1方法的特异性评价
选择5 种常见的真菌毒素(AFB2、赭曲霉毒素A、赭曲霉毒素B、玉米赤霉烯酮、伏马毒素)作为干扰物质,质量浓度均为50 ng/mL。采用1.3.2节检测方法进行特异性检测。
1.3.4 豆瓣样品中AFB1的检测应用
称取10.0 g豆瓣样品,粉碎后加入50 mL 50%甲醇溶液和20 mL正己烷,振荡15 min后转入分液漏斗中待分层。收集下层溶液10 mL旋转蒸发浓缩后,加入10 mL 10%甲醇-Tris-HCl复溶。然后将不同浓度的AFB1标准溶液添加到1 mL样品液中。对每个样品进行3 次标准添加和回收实验,计算回收率。HCR方法与GB 5009.22—2016《食品中黄曲霉毒素B族和G族的测定》中的酶联免疫吸附法[25]试剂盒同时测定12 种不同品牌的郫县豆瓣中AFB1的含量。
1.4 数据分析
利用Excel处理数据,用Origin 8.0软件作图。用Duncan多重比较进行显著性分析,P<0.05,差异显著。
2 结果与分析
2.1 基于核酸适配体的HCR体系的传感策略设计原理
本实验基于核酸适配体的HCR体系检测AFB1的原理如图1所示。该传感器主要由AFB1适配体、cDNA、HP1和HP2组成。cDNA与AFB1适配体可通过氢键作用部分杂交配对[19],HP1和HP2与cDNA完全互补配对并可自身部分互补形成“发夹”结构的探针。HP1的5’末端(a链)修饰荧光分子FAM,3’端(b链)有6 个未配对的碱基作为黏性末端。cDNA通过与HP1的b链配对引发a与b解链。发夹结构HP1中被暴露出的a链与HP2中的a’链互补配对而引发HP2的b’与a’解链。HP2解链后的b’链会再次与HP1杂交,如此反复自组装,发生HCR,形成超长双链DNA,该双链DNA上有多个有机荧光素FAM。GO对单链DNA具有很强的吸附性能。HP1的黏性末端通过π-π堆积作用被吸附到GO表面,其末端的荧光基团FAM与GO发生荧光共振能量转移,荧光被淬灭[26-28]。GO对双链DNA的吸附能力弱,因此发生HCR反应后的超长双链中FAM的荧光被淬灭的程度显著降低[29]。当不存在靶标AFB1时,cDNA不能触发HCR的HP1与HP2结合,HP1关闭,荧光信号较低。当存在靶标AFB1时,适配体-AFB1的亲和力高于适配体-cDNA,cDNA触发HP1与HP2互补配对,HP1被打开并恢复荧光信号,从而实现对AFB1的定量分析。
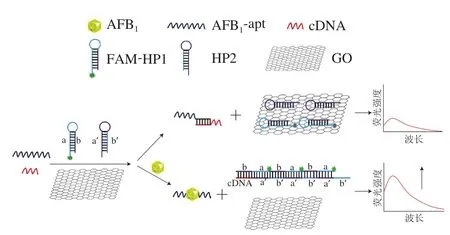
图1 基于适配体的CR体系检测原理图Fig. 1 Schematic illustration of the principle of hybridization chain reaction based on aptamer
2.2 序列设计
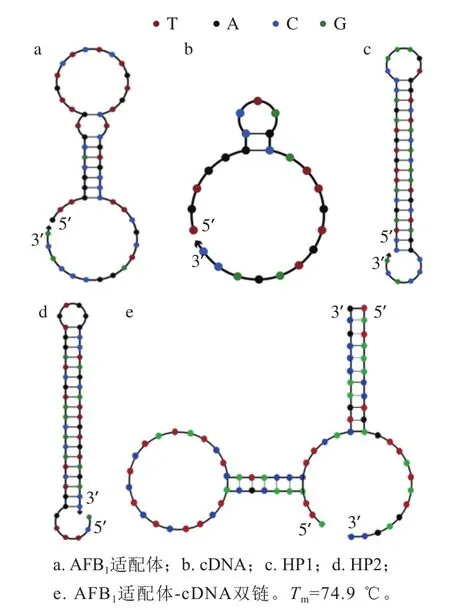
图2 单链DNA的二级结构图Fig. 2 Secondary structures of single-stranded DNA
本实验中的HP1、HP2、cDNA通过NUPACK软件设计得到,通过Mfold软件模拟序列的二级结构如图2所示,HP1和HP2为发夹结构,cDNA为与AFB1部分互补的短链。该预测结果与实验设计的理想结构相符。
2.3 基于适配体的HCR检测体系的验证
琼脂糖凝胶(质量分数2%)用于表征和验证HCR扩增和基于适配体的HCR系统。由图3可知,当不存在cDNA时,只有一条清晰的条带(泳道e),HP1和HP2未发生杂交,没有高分子质量DNA产物生成。加入不同浓度的cDNA时,泳道f~i有高分子质量的DNA生成,这表明cDNA的存在引发了HCR,并且随cDNA浓度的降低呈现平均分子质量增加的趋势[30]。
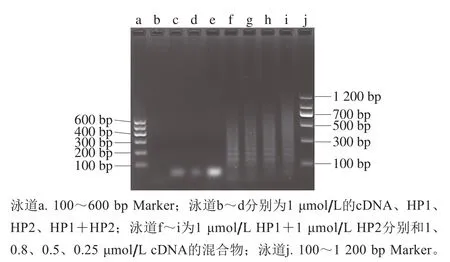
图3 HCR产物的琼脂糖凝胶电泳图Fig. 3 Agarose gel electrophoresis images of nucleic acids in HCR products
由图4a可知,FAM在480 nm波长处受到激发后在波长516 nm左右具有最高的荧光强度。由图4b可知,GO在500~700 nm波长范围内都具有光吸收特性,与FAM标记发生荧光共振能量转移,进而引起荧光淬灭。
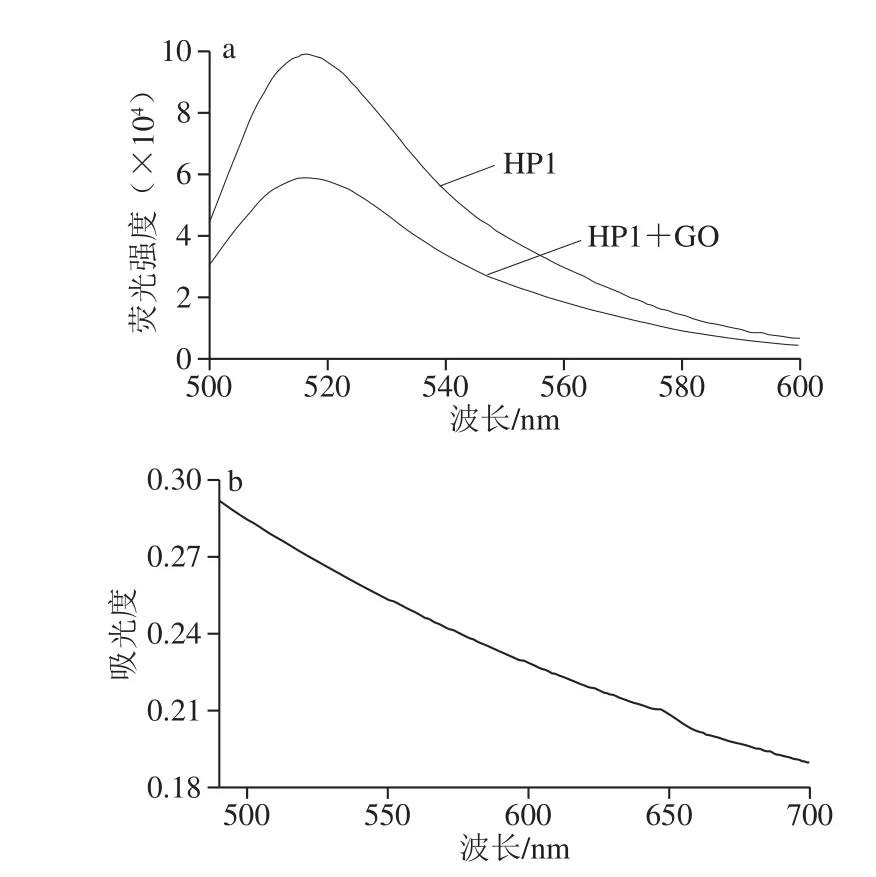
图4 FAM被GO淬灭前后的荧光光谱(a)和GO的紫外-可见吸收光谱图(b)Fig. 4 Fluorescence spectra of FAM before and after quenching by GO (a) and UV-visible absorption spectrum of GO (b)
图5 进一步验证了基于适配体的HCR系统(AFB1适配体、cDNA、HP1、HP2、GO、AFB1的浓度分别为20 nmol/L、20 nmol/L、60 nmol/L、60 nmol/L、20 ng/mL、20 ng/mL)。未加入GO时,FAM的荧光不被淬灭,荧光强度较高(图5a)。加入GO后,HP1和HP2被吸附到GO表面,FAM荧光被淬灭,荧光强度明显降低(图5b)。加入cDNA时,cDNA引发了HP1和HP2之间的HCR,发夹探针的荧光得到恢复(图5c)。当靶标AFB1存在时,适配体与AFB1结合使得更多的cDNA引发HCR,生成多个聚合双螺旋DNA,荧光强度显著增强(图5d)。由此证明了该方法的可行性。

图5 不同反应体系的荧光响应Fig. 5 Fluorescence responses of different reaction systems
2.4 HCR实验条件优化
2.4.1 互补短链cDNA的浓度优化
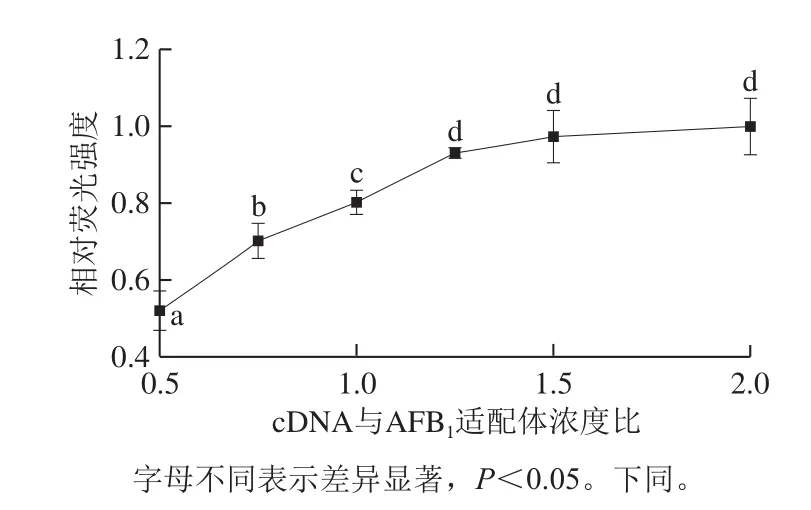
图6 引发探针cDNA与适配体的浓度对荧光信号的影响Fig. 6 Effect of concentration of cDNA and aptamer on fluorescence signal
cDNA作为HCR的引发链,其浓度对双链DNA产物的形成和荧光信号的强弱有着直接影响,本实验中固定适配体为40 nmol/L,优化了cDNA的浓度。如图6所示,随着cDNA的浓度增大,荧光强度显著升高。当cDNA与AFB1适配体浓度比达到1.25后,荧光强度缓慢升高,这表明cDNA引发HP1和HP2杂交产生的双链产物几乎达到了饱和状态。因此,选用浓度比为1.25时的cDNA浓度(50 nmol/L)为最佳反应浓度。
2.4.2 HP1和HP2浓度优化
在HCR体系中,HP1与HP2之间进行互补错位杂交,因此将HP1和HP2以1∶1的浓度比混合参与反应。如图7所示,荧光强度随着反应体系中HP1与HP2的浓度增大而增强。当HP1与HP2浓度达到60 nmol/L时反应体系的荧光强度最强,当HP1与HP2浓度继续增大,荧光强度降低。荧光强度降低可能是核酸浓度太高产生了空间位阻,导致杂交链的形成受到影响[19,31]。因此选择60 nmol/L的浓度作为最佳反应浓度。

图7 发夹探针P1/P2的浓度对荧光强度的影响Fig. 7 Effect of concentration of hairpin probe HP1/HP2 on fluorescence intensity
2.4.3 杂交孵育时间优化
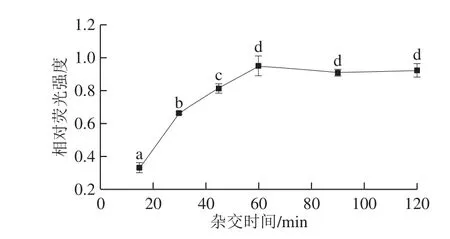
图8 cDNA与P1/P2杂交时间对荧光强度的影响Fig. 8 Effect of hybridization time on fluorescence intensity
由图8可知,荧光强度随着孵育时间的延长而增强。当孵育时间达到60 min后,荧光强度降低,说明孵育时间在60 min左右HCR已经几乎达到饱和状态,因此选择60 min作为最佳杂交孵育时间。
2.4.4 GO质量浓度优化
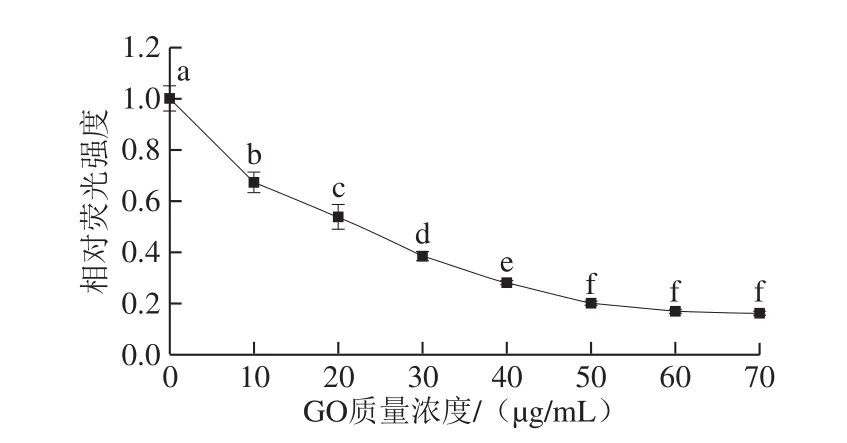
图9 GO质量浓度对荧光强度的影响Fig. 9 Effect of GO concentration on fluorescence intensity
如图9所示,当GO质量浓度小于50 μg/mL时,荧光信号逐渐降低;当质量浓度超过50 μg/mL时,荧光信号基本不再变化。因此GO的最佳质量浓度为50 μg/mL。
2.5 荧光信号响应与校准曲线
在上述最佳的实验条件下研究了校准曲线和灵敏度。如图10a所示,随着一系列AFB1浓度的增加,荧光强度增加。图10b显示构建的基于AFB1适配体的HCR检测系统的荧光强度与AFB1质量浓度之间的线性关系。结果显示,AFB1在2~60 ng/mL范围内具有良好的线性关系,相关系数R2=0.971,线性回归方程为Y=755.28X+49 448.17,检测限为1.84 ng/mL。如表2所示,与其他快速检测方法相比,本实验具有较高的灵敏度。
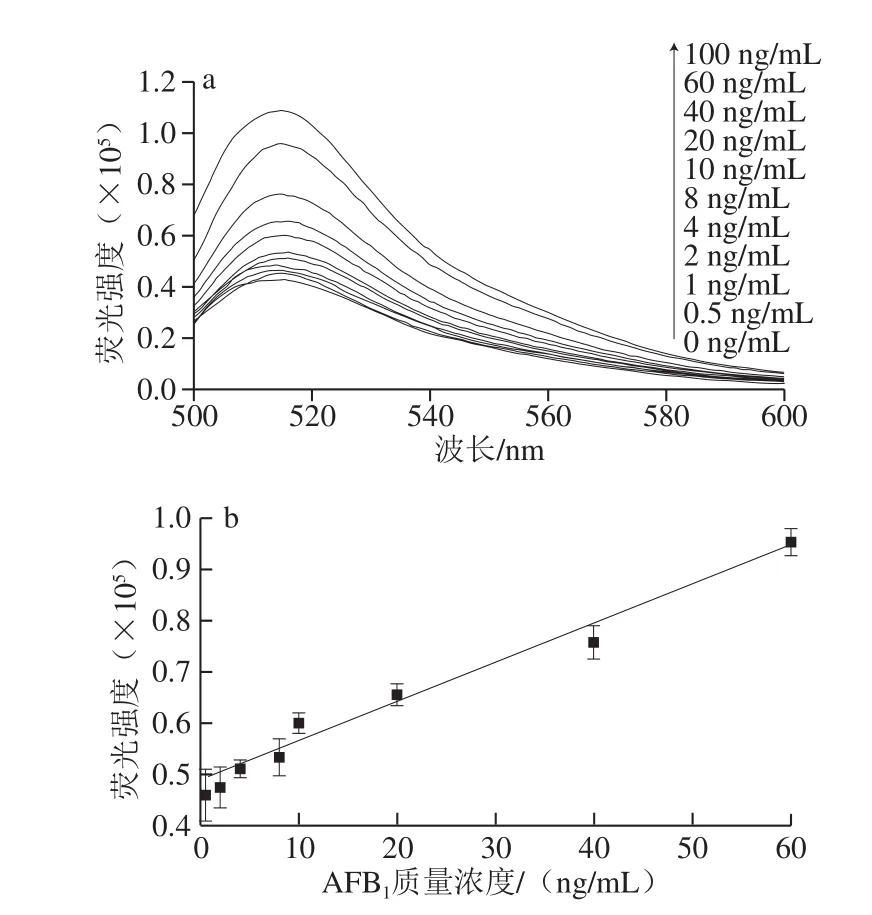
图10 不同质量浓度AFB1存在下CR的荧光强度(a)及其线性关系(b)Fig. 10 Fluorescence spectra of hybrid chain reaction at different concentrations of AFB1 (a) and linear relationship (b) between fluorescence intensity and AFB1 concentration

表2 现有检测AFB1方法的灵敏度比较Table 2 Comparison of the sensitivity of currently available methods for the detection of AFB1
2.6 方法特异性实验
如图11所示,由于AFB1和AFB2分子结构具有较高相似性,该检测方法基于构象识别的原理表现为对AFB2存在18.92%的交叉反应率,与其他真菌毒素无显著交叉反应,表明方法的特异性强,可用于检测AFB1。
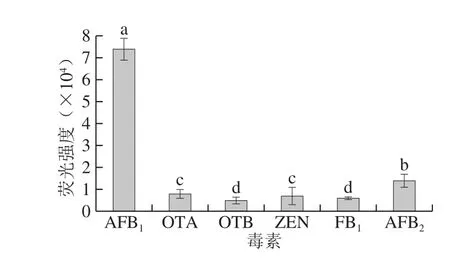
图11 CR检测体系的特异性评价Fig. 11 Specificity evaluation of the HCR detection system
2.7 基于HCR的荧光检测法检测郫县豆瓣样品中的AFB1
通过向某个豆瓣样品中添加AFB1标准溶液,使最终加标质量浓度分别为4、15、30 ng/mL,采用本实验所建立的HCR法进行检测,每个样品做3 次平行实验。如表3所示,本方法的加标回收率在85.73%~94.25%之间,相对标准偏差在3.24%~6.05%之间,表明该方法具有较好的准确度,可用于豆瓣样品中AFB1的检测。
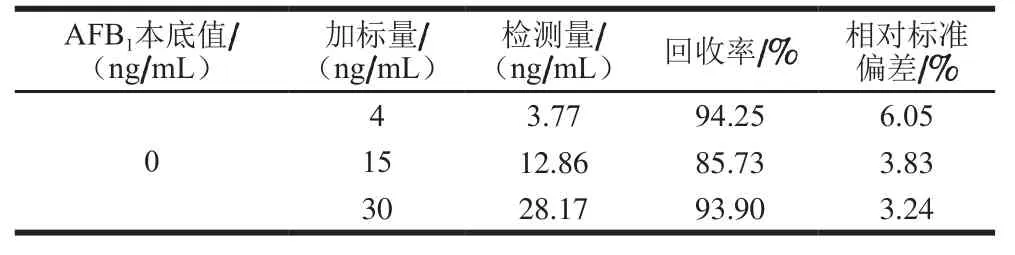
表3 加标回收率(n=3)Table 3 Recoveries of AFB1in spiked samples (n= 3)
对购买于本地超市的12 种不同品牌的郫县豆瓣样品进行实际样品的检测分析,结果见表4。10 个样品检测出AFB1,平均污染水平为3.42 μg/kg,最高污染水平为4.50 μg/kg,与GB 5009.22—2016酶联免疫吸附法相比,二者测定结果无显著差异(P>0.05)。所有样品的检测均未超出国标限量(5 μg/kg),说明这12 种来自不同品牌的郫县豆瓣AFB1污染程度较小。

表4 郫县豆瓣中AFB1测定(n=3)Table 4 AFB1contents in Pixian broad-bean paste determined by the developed method and the national standard method (n= 3)
3 结 论
本研究建立了基于AFB1核酸适配体的HCR荧光检测方法。通过优化实验条件,最终确定cDNA浓度50 nmol/L;HP1和HP2浓度60 nmol/L;孵育时间60 min;GO质量浓度50 μg/mL。该方法的检测限为1.84 ng/mL,线性范围为2~60 ng/mL,R2=0.971。 该方法在实际样品郫县豆瓣中的加标回收率为85.73%~94.25%。该方法用于12 种不同品牌的郫县豆瓣的检测,10 个样品检测出AFB1,平均污染水平为3.42 μg/kg,最高污染水平为4.50 μg/kg,与GB 5009.22—2016酶联免疫吸附法试剂盒检测结果无显著差异。本研究建立的检测方法操作简单,选择性强,无需标记AFB1核酸适配体,不影响核酸适配体的结构变化,不干扰其与AFB1的结合。同时,采用HCR体系扩大信号,提高了检测方法的灵敏度,为复杂基质样品中AFB1的检测提供了新的检测方法。
