重症肌无力患者血清胱抑素C水平与临床特征的相关性研究
2020-12-11黄晓曦李立恒高鑫鑫刘洪波
黄晓曦,刘 举,李 慧,李立恒,高鑫鑫,刘洪波
重症肌无力(myasthenia gravis,MG)是一种罕见的神经系统自身免疫性疾病,抗乙酰胆碱受体(acetylcholine receptor,AChR)抗体的产生是临床上最常见的导致MG的病因,可导致波动性不耐疲劳和骨骼肌无力[1,2]。虽然自身免疫性抗体的产生通常被认为是MG发病的直接因素,但研究表明细胞免疫及多种细胞因子同样在发病中扮演着重要角色。胱抑素C(Cystain C,Cys C)是一种半胱氨酸蛋白酶(cathepsins,Cat)抑制剂,也称半胱氨酸蛋白酶抑制剂C,由于其生成速度恒定,受饮食、年龄、性别等影响较小,临床上最常应用于肾功能的检测[3],但一直以来,它在免疫调节方面广泛的生物学作用同样备受关注。近年来,Cys C在自身免疫性疾病,尤其是神经系统自身免疫性疾病如多发性硬化(multiple sclerosis,MS)、视神经脊髓炎谱系疾病(neuromyelitis optica spectrum disorder,NMOSD)等疾病中的作用逐渐被人所认识[4],但迄今为止还没有关于重症肌无力患者血清Cys C水平变化的研究,本研究通过分析MG组和对照组人群血清Cys C水平的差异及MG患者血清Cys C水平与Osserman临床分型、QMG评分、AChR抗体滴度的关系,从而探讨Cys C在重症肌无力疾病发生发展中的免疫作用,为关于MG疾病机制和免疫学治疗的研究提供新的思路。
1 对象和方法
1.1 对象 回顾性收集2018年6月至2019年8月就诊于我院并且有空腹血清Cys C检测结果的70例急性期MG患者及42例健康体检者或无器质性疾病的神经官能症患者的临床资料。所有入组对象均有空腹血清Cys C、肾小球滤过率(glomerular filtration rate,GFR)、肌酐化验结果,MG患者均有胸部增强CT和AChR抗体监测结果。MG组和对照组临床特征详见表1。纳入标准:伴或不伴有胸腺瘤的临床确诊MG的患者;排除标准:存在其他病因相关的神经系统症状和体征;伴发血液疾病、甲状腺功能异常、肝肾功能障碍和除胸腺瘤之外其他部位肿瘤的患者。
1.2 方法
1.2.1 神经功能缺损评分 详细采集病史及体格检查,采用定量重症肌无力(Quantitative myasthenia gravis,QMG)评分评价MG组患者的神经功能缺损程度。
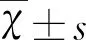
2 结 果
2.1 临床特点 MG组患者根据是否合并胸腺瘤分为2组,其中合并胸腺瘤者32例,胸腺瘤主要根据影像学结果诊断,其中21例患者有术中病理活检结果证实;胸腺正常或在早年已切除者38例。所有MG患者采用改良Osserman临床分型分为眼肌型组(I型)和全身型组(II-V型),其中眼肌型患者25例,全身型患者45例;AChR抗体阳性者56例,阴性者14例;另选择作者医院同一时期健康体检者42例作为对照组。MG组所有患者均常规行空腹血清Cys C检测、AChR抗体水平监测、胸腺增强CT扫描,采用Osserman分型方法分型,根据QMG评分对其神经功能缺损程度进行评价。经比较,合并及不合并胸腺瘤的MG组及对照组人员性别、年龄、血清GFR及肌酐水平无统计学差异(P>0.05)(见表1)。
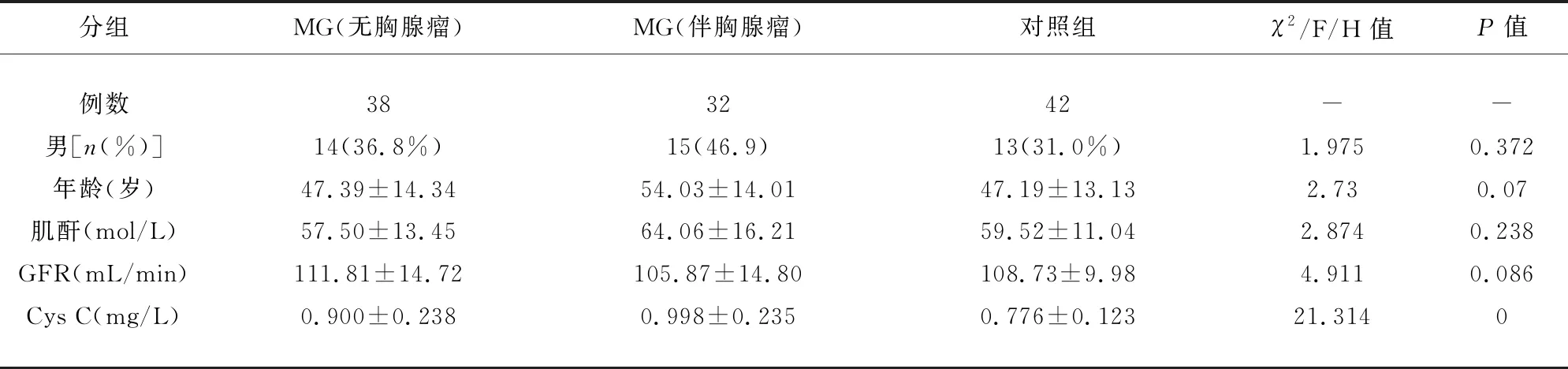
表1 MG组和对照组临床资料比较
2.2 血清Cys C水平比较 Kruskal-Wallis方法分析结果显示3组人员血清Cys C水平有显著差异(H=21.34,P=0.000)。经Bonferroni法进行两两比较后发现,未合并胸腺瘤MG组患者血清Cys C水平显著高于对照组[(0.900±0.238,0.776±0.123)mg/L,P=0.022],合并胸腺瘤MG组患者血清Cys C水平显著高于对照组[(0.998±0.235,0.776±0.123)mg/L,P=0.000],未合并胸腺瘤MG组和合并胸腺瘤MG组患者的血清Cys C水平无明显差异[(0.900±0.238,0.998±0.235)mg/L,P=0.131](见图1A)。
2.3 MG组患者血清与QMG评分及临床分型的关系 Pearson相关分析结果显示MG组患者血清CysC水平与QMG评分呈正相关(r=0.482,P=<0.0001)(见图1B),但眼肌型与全身型MG患者血清Cys C水平无统计学差异(t=0.366,P=0.716)(见图1C)。
2.4 MG组患者血清CysC水平与AChR抗体水平的关系 Pearson相关分析结果显示MG组患者血清CysC水平与AChR抗体水平无明显相关性(r=0.008,P=0.457)(见图1D)。
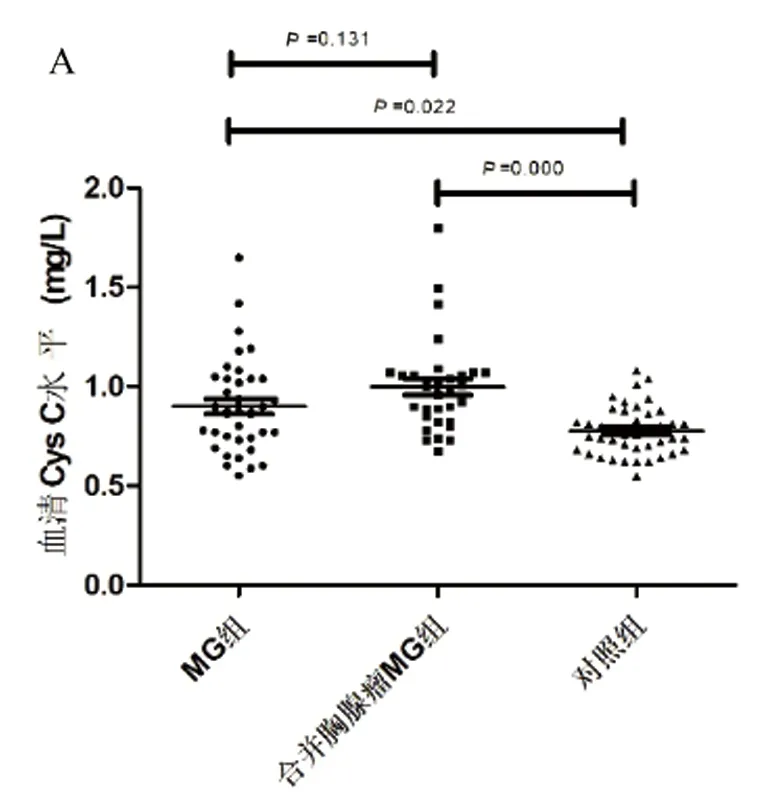

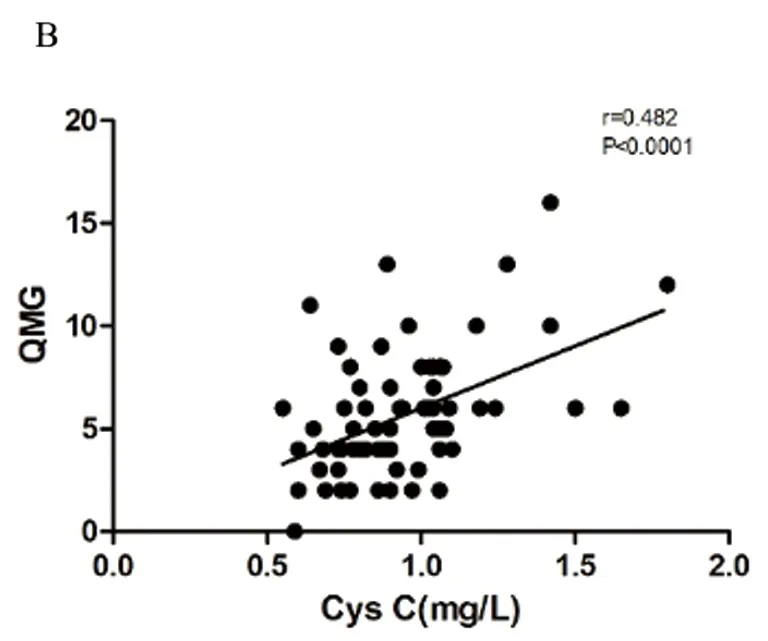

A:各组血清Cys C水平比较 Bonferroni法进行组间两两比较,结果显示无论是否合并胸腺瘤,MG患者血清Cys C水平均高于对照组,且两组MG患者的血清Cys C水平无明显差异;B:MG组患者血清Cys C水平与临床QMG评分的关系;C:眼肌型和全身型MG患者血清Cys C水平比较;D:MG组患者血清Cys C水平与AChR抗体水平的关系。MG 重症肌无力;GFR 肾小球滤过率;Cys C 胱抑素C;QMG:定量重症肌无力评分
3 讨 论
重症肌无力是一种罕见、以神经肌肉传递障碍为特征的自身免疫性疾病。在血清AChR抗体为阳性的MG患者中,患者骨骼肌细胞突触后膜的AChR抗体与自身免疫性抗体特异性结合,使乙酰胆碱无法正常行使信息传递的作用,从而导致骨骼肌不耐疲劳。虽然MG的发生与体液免疫紧密相关,但T细胞、巨噬细胞等细胞及干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)、白介素(IL)4、IL-5、IL-10、IL-17等细胞因子均被证明与MG的发病相关[5]。胱抑素C可通过直接或间接的方式调节T细胞的增殖、分化及其相关分子的表达,近年来被发现参与多种自身免疫疾病的发生发展。迄今为止,CysC被发现与MS、NMOSD、甲状腺功能亢进(hyperthyroidism)、格林巴利综合征、系统性红斑狼疮等多种疾病相关[6~9],但目前还没有关于MG患者血清Cys C水平变化的研究。本文旨在通过回顾性分析,探讨Cys C在MG疾病发生发展中的免疫作用。
Cys C的编码基因位于20号染色体短臂,属于“管家基因”,能以恒定速度表达于几乎全部的有核细胞中,广泛存在于外周血、脑脊液、尿液等多处体液,血清浓度受饮食、性别、年龄、肌肉质量、药物等因素影响较小,肾脏是其唯一代谢途径[10,11]。Cys C对髓鞘基质蛋白有降解作用,导致Cys C水平在MS、NMOSD、GBS患者体液,尤其是脑脊液中因过度消耗而呈现下降趋势,而在SLE、甲状腺功能亢进患者血液中则由于其主要通过对Cat的调节机制发挥作用,而表现为升高趋势。虽然外周血Cys C水平在类风湿关节炎(rheumatoid arthritis,RA)患者中呈下降趋势,但它和Cat B在RA患者滑膜组织中被检测到高表达[12]。除了自身免疫性疾病,Cys C水平异常还可作为骨髓瘤、乳腺癌、结肠癌、非霍奇金b细胞淋巴瘤以及肾细胞癌的诊断和预后指标,血清Cys C升高明显多与预后不良相关[13~18]。
本研究旨在观察探讨急性期MG患者血清Cys C的水平变化及其与临床特征的关系,目前尚未发现国内外有类似研究。在本研究中,两组病例组和对照组的肌酐、GFR无统计学差异,排除了肾功能对Cys C的影响。本研究结果显示,未合并胸腺瘤MG组和合并胸腺瘤MG组血清Cys C水平均显著高于对照组[(0.900±0.238,0.998±0.235,0.776±0.123)mg/L,P=0.000]。血清Cys C水平与临床QMG评分呈正相关(r=0.482,P<0.0001),但与Osserman分型、AChR抗体滴度无明显相关(P>0.05)。合并与不合并胸腺瘤的两个亚组MG患者的外周血Cys C水平无统计学差异,表明胸腺并非影响MG患者血清Cys C水平的因素。
Cys C在自身免疫性疾病中的作用机制通常被认为与其靶酶的作用有关。Cat是溶酶体内的一种蛋白水解酶,在蛋白质转换、调节先天免疫细胞吞噬、主要组织相容性复合体- II(MHC-II)介导的抗原表达及凋亡等多个生物过程中起到重要作用[19,20]。它们可以控制溶酶体的生物发生和自噬通量,从而影响先天免疫细胞的生存和极化,还可调节细胞外部和细胞骨架之间的双向通信,从而影响细胞相互作用、形态和运动。Cat通过控制抗原递呈,促进适应性免疫细胞的启动,并参与细胞毒性颗粒介导的杀伤细胞毒性T淋巴细胞和自然杀伤细胞的功能活动。它的异常活性可以通过其内源性抑制剂——半胱氨酸蛋白酶抑制剂来预防[18]。作为Cat抑制剂之一,越来越多的证据表明Cys C在病理情况下如果控制不当,最终会导致炎性自身免疫性疾病或肿瘤的发展[21]。Cys C受复杂的炎症因子调节,同时也反过来影响炎症及其介导的免疫反应。然而,虽然其免疫调节功能和它对Cat的调控作用息息相关,但它重症肌无力的发病中的作用还可能涉及其他机制。
如前所述,MG的发病与B细胞、T细胞、巨噬细胞等及多种细胞因子均相关。在实验性自身免疫性重症肌无力(EAMG)大鼠肌肉组织内存在大量巨噬细胞的浸润[22]。动物实验证实Th1细胞与巨噬细胞等分泌的IFY-γ、TNF-α等细胞因子与AChR抗体的产生及表达水平的升高相有关[23,24],而Th2细胞分泌的IL-4可能对抗AChR抗体免疫具有保护作用[25]。Cys C则与IFN-γ、TNF-α信号转导通路、T细胞的分化等均有关,并可通过直接或间接的方式调节T细胞的增殖、分化及其相关分子的表达[26~28]。结合本次实验结果,我们推测因MG患者体内存在免疫环境的紊乱,B细胞、T细胞、巨噬细胞、IFN-γ等免疫细胞和细胞因子的免疫平衡被打破,一方面,Cat的表达发生变化,使Cys C含量随之改变,调控Cat的生物学活动,另一方面直接受紊乱的免疫细胞和细胞因子的作用,促进Th2样细胞向Th1样细胞的分化,并增强IFN-γ等细胞因子的促炎作用,这些复杂的机制最终表现为血清Cys C水平的升高,并与MG患者的病情严重程度表现出一定的相关性。研究结果显示血清Cys C与MG患者Osserman临床分型无关但与QMG评分呈正相关关系,提示血清Cys C或可作为病情严重程度或疾病活动的标志。
本研究尚存在不足之处。首先,本研究纳入的患者均为急性期MG患者,缺乏缓解期的对照;其次,如果我们能够将抗骨骼肌特异性酪氨酸激酶型MG(Musk-MG)等类型患者一并纳入,并将MG患者急性期、缓解期的血清Cys C水平与对照组进行比较,结论将更加全面和具有说服力。除此之外,受条件所限,本研究也缺乏对预后的分析。但我们的工作扩充了对Cys C在神经系统自身免疫性疾病中作用的研究,也为Cys C在自身免疫紊乱中扮演重要角色这一结论提供了MG疾病方面的证据,对进一步了解Cys C在免疫紊乱中的作用、认识MG发病后的免疫紊乱表现及进行有针对性的免疫治疗等方面具有一定的启发意义。
