行走不稳伴叶酸缺乏患者病变特征研究
2020-12-11余爱勇赵迎春潘晓春娄晓丽孙建军赵玉武
余爱勇,赵迎春,陈 晟,张 瑜,潘晓春,彭 亮,娄晓丽,孙建军,赵玉武
叶酸不光光是胎儿阶段,是所有年龄段神经系统活动的重要元素[1]。叶酸是维生素B家族的成员,对于生产和维持新细胞,核苷酸合成以及半胱氨酸的再甲基化至关重要[1,2]。已经有研究从基因多态性角度证实,叶酸的降低与脑梗死的发生密切相关[3]。叶酸缺乏的情况下,在出现巨红细胞增多症之前,还可能会出现其他严重的神经和精神障碍。神经科医生应保持警惕无法解释的神经系统疾病患者中叶酸缺乏的可能性。本研究搜集了一组以行走不稳为主要表现的,排除其他所有疾病,唯一的发现是合并低叶酸血症,总结这部分患者的临床特征,以提高警惕。
1 资料与方法
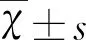
所有患者排除周围神经病变、脊髓后索性病变、前庭迷路性病变、小脑病变、副肿瘤综合征、糖尿病周围神经病、脊髓痨、遗传性共济失调等导致的行走不稳。
1.2 方法
1.2.1 临床资料记录 将行走不稳首发表现叶酸缺乏组患者的年龄、性别、症状、合并疾病、叶酸水平、同型半胱氨酸、维生素B12、血糖水平和头颅MRI+MRA结果登记。
1.2.2 代谢指标评估 测定两组患者的随机血糖、糖化血红蛋白、总胆固醇、甘油三酯、高密度脂蛋白、低密度脂蛋白、同型半胱氨酸、fT3、fT4、TSH等指标。应用罗氏e602免疫分析仪,采用电化学发光法,测定叶酸水平。在我院检验科完成上述化验,结果由医院HIS系统导出。数据由双人独立录入。
1.2.3 影像学检查 头颅MRI和MRA。1.5T双梯度磁共振,横断面SE序列T1WI,FRFSE序列T2WI、FRFSE序列T2FLAIR及DWI成像,层厚7 mm、间隔1 mm,矢状面FRFSE序列T1WI成像,层厚6 mm,间隔1 mm,3D-TOF MIP/VR重建。
1.3 统计学方法 运用SPSS 22.0统计软件进行分析,基线资料中计数资料,采用两独立样本t检验,计量资料计算百分比,列交叉表格,采用卡方检验,P<0.05为有统计学意义。将行走不稳首发表现叶酸缺乏组赋值为1,对照组赋值为0,分组作为因变量,其他多项因素设为自变量,进行多因素分析,采用二元logistic回归分析。
2 结 果
2.1 54例患者的临床资料记录 共搜集到叶酸缺乏症者54例,年龄在54~89岁之间,平均(77.11±9.97)岁,80~89岁共36例,70~79岁6例(11.11%),69~69岁6例(11.11%),50~59岁6例(11.11%)。男性36例,女性18例,男女发病率比为2:1。病程2~30 d,平均(7.56±8.78) d,其中2~4 d 33例(61.11%),7~14 d 15例(27.78%),30 d 6例(11.11%)。叶酸水平处于0~1 ng/ml极重度降低0例,1~2 ng/ml重度降低15例,2~2.8 ng/ml中度降低24例,2.8~3.1 ng/ml轻度降低15例。伴同型半胱氨酸升高者40例。
空腹血糖<6.1 mmol/L者39例,6.1~7.0 mmol/L之间者9例,>7.0 mmol/L者3例。既往史中既往有卒中史14例,合并高血压者45例,合并糖尿病者8例,合并帕金森病者6例,合并冠心病和(或)心律失常者15例,合并精神疾病者7例。合并脑萎缩者53例。合并颅内动脉闭塞3例,广泛脑动脉硬化者10例。合并维生素B12缺乏者3例,有2例因长期服用甲钴胺而导致维生素B12显著升高(部分病例资料见表1)。

表1 选取18例患者资料记录
2.2 行走不稳首发表现叶酸缺乏组和对照组基线资料和实验室资料比较 行走不稳首发表现叶酸缺乏组发病时间为(7.56±8.78) d,高于叶酸缺乏合并脑血管病对照组(5.19±6.87) d,t=4.586,P=0.001。行走不稳首发表现叶酸缺乏组发病年龄为(77.11±9.97)岁,高于叶酸缺乏合并脑血管病对照组(73.30±12.42)岁,t=2.906,P=0.022。行走不稳首发表现叶酸缺乏组女性比例33.33%,高于叶酸缺乏合并脑血管病对照组18.60%,χ2=12.269,P=0.015。行走不稳首发表现叶酸缺乏组嗜酒比例16.67%,低于叶酸缺乏合并脑血管病对照组20.15%,χ2=14.728,P=0.005。行走不稳首发表现叶酸缺乏组血小板(180.35±62.06),低于叶酸缺乏合并脑血管病对照组(202.63±60.80),t=2.771,P=0.028。行走不稳首发表现叶酸缺乏组同型半胱氨酸(19.88±9.00),低于叶酸缺乏合并脑血管病对照组(30.38±59.77),t=2.938,P=0.021(见表2)。
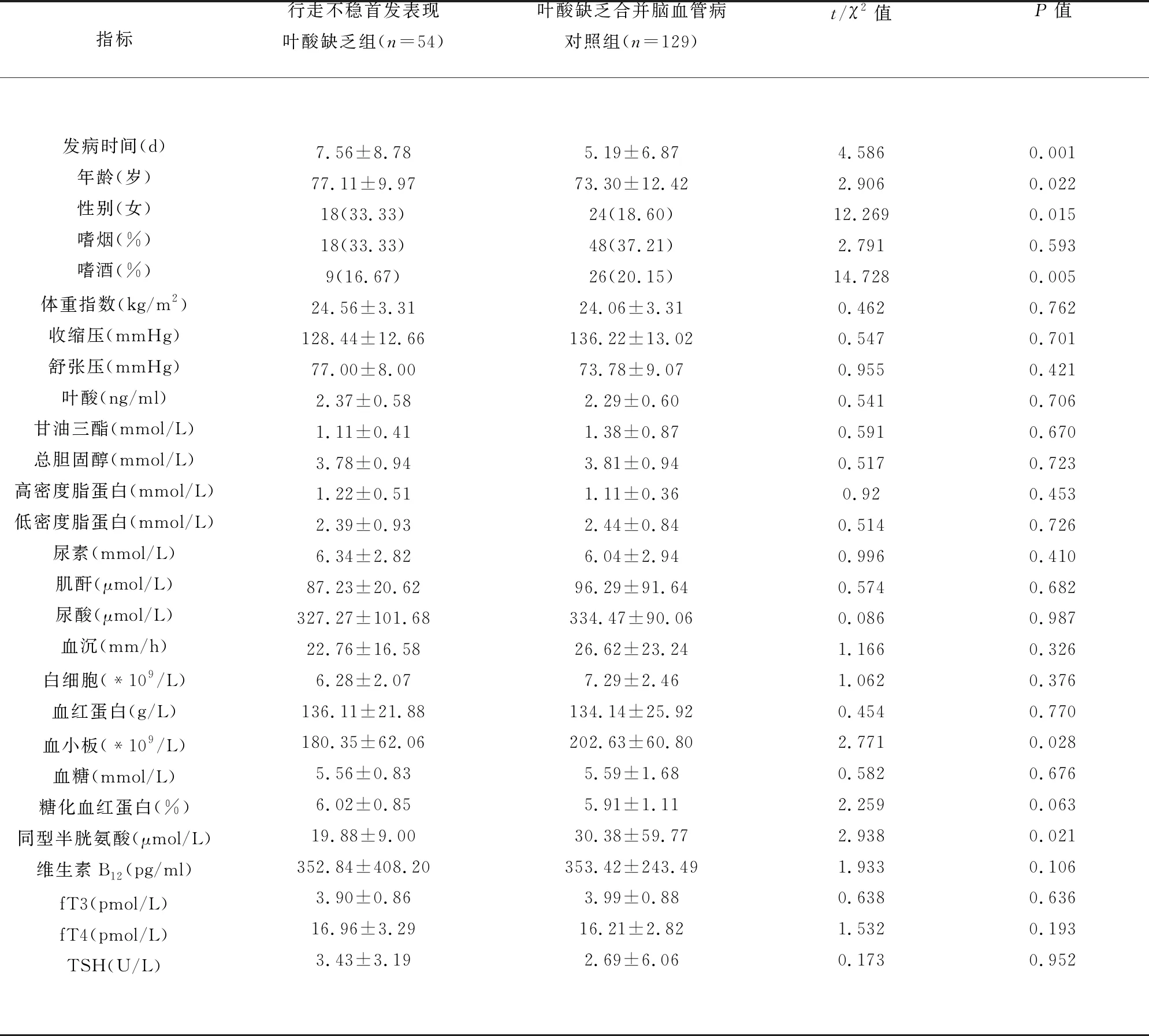
表2 行走不稳首发表现叶酸缺乏组和对照组基线资料和实验室资料比较
2.3 行走不稳首发表现叶酸缺乏组和对照组患者MRI缺血灶的数量特征 行走不稳首发表现叶酸缺乏组脑叶缺血灶(41.67%)高于对照组(33.72%),χ2=6.254,P=0.012。行走不稳首发表现叶酸缺乏组总的缺血灶数量(23.96%)高于对照组(19.53%),χ2=7.157,P=0.007(见表3)。
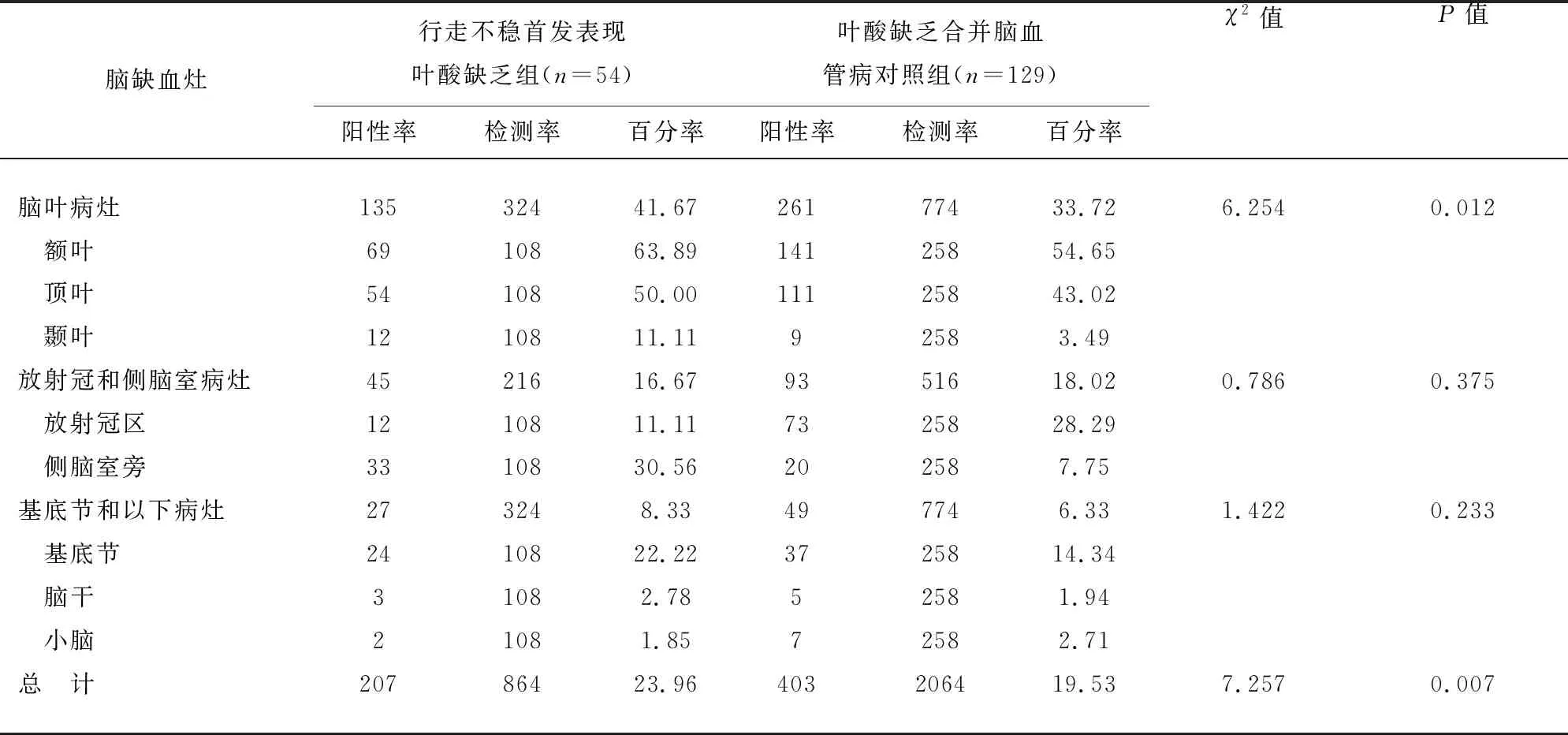
表3 行走不稳首发表现叶酸缺乏组和对照组患者MRI缺血灶结果对比
2.4 行走不稳首发表现叶酸缺乏组和对照组患者大脑半球MRI影像学特征 见图1。



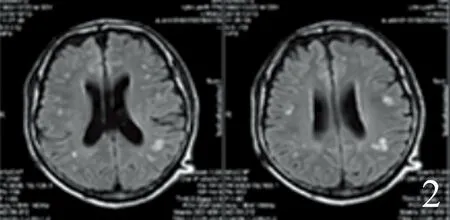


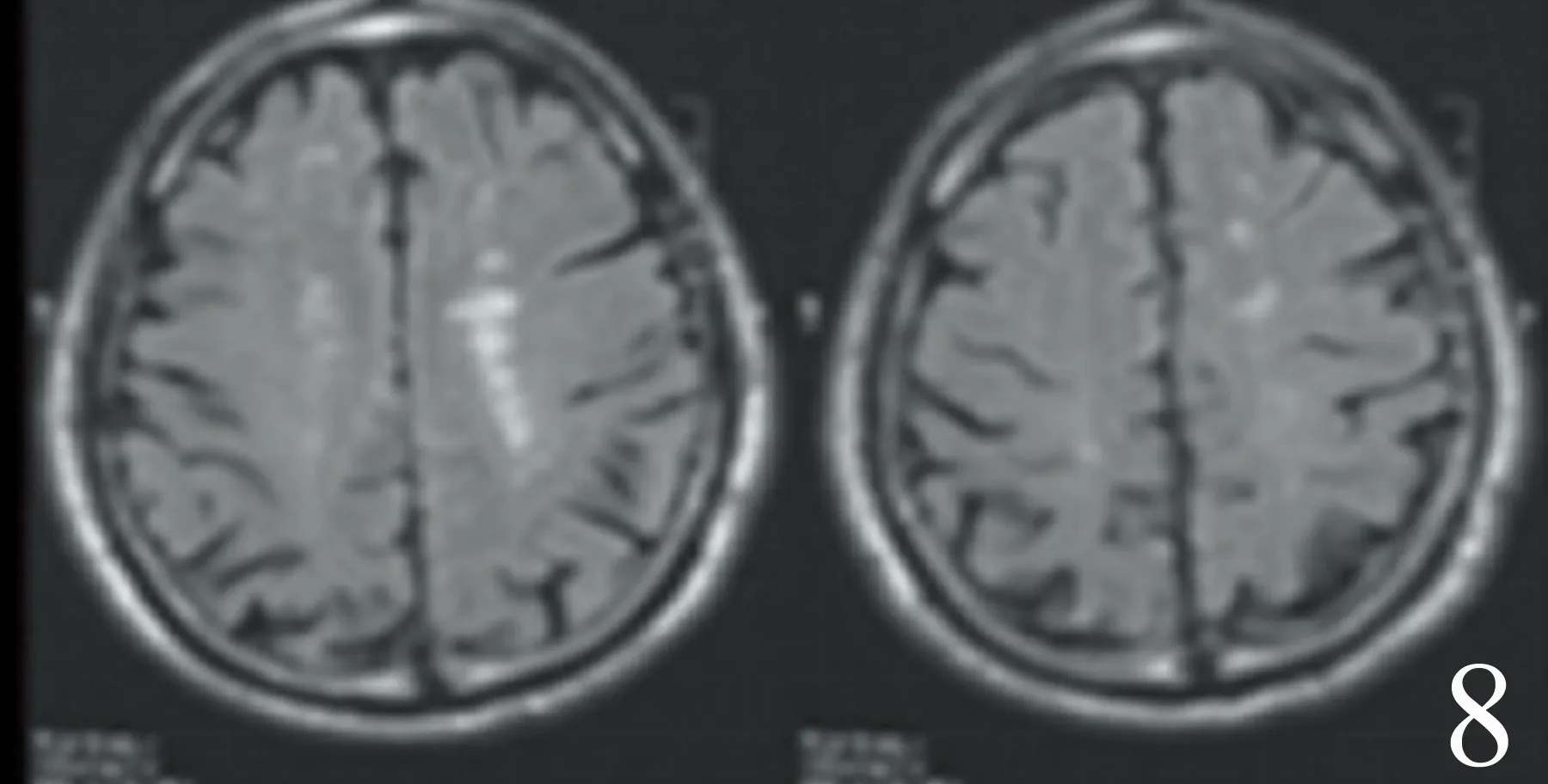
1~4:行走不稳首发表现叶酸缺乏组,大脑半球的缺血灶大多数呈点状独立分布;5~8:叶酸缺乏合并脑血管病对照组,大脑半球缺血灶大多数融合成条线状、条带状,边界模糊不清的病灶
2.5 行走不稳首发表现叶酸缺乏组的多因素分析 行走不稳首发表现的叶酸缺乏组赋值为1,对照组赋值为0,作为因变量,将年龄、性别、嗜酒、血糖、甘油三酯、总胆固醇、同型半胱氨酸、脑叶缺血灶作为自变量,进行二元logistic多因素回归分析,提示脑叶缺血灶的OR=2.311,95%CI1.174~4.569,P=0.025。
3 讨 论
叶酸是一种必需的微量营养素,是一碳代谢中的关键辅助因子。哺乳动物无法合成叶酸,只能依靠补充来维持正常水平。在西方,酗酒是导致叶酸缺乏的最常见原因,叶酸缺乏驱动人类FRAXA基因座的有丝分裂[5]。已知叶酸缺乏与脑血管病密切相关。叶酸确定为脑梗死的潜在生物标志物[6]。血浆和尿液中检测到叶酸缺乏和高同型半胱氨酸血症,高度准确地预测脑梗死的存在[7]。减少的叶酸载体1多态性是缺血性中风的危险因素[3]。目前叶酸缺乏引起的非脑血管病的研究较少。
本研究从3840例检测叶酸水平住院患者发现有291例为叶酸水平降低,其发生率为7.58%。其检出率较低,故在临床中往往被忽略。在291例叶酸缺乏的患者中,合并有脑血管病者129例,合并非脑血管病者162例,占55.67%。162例非脑血管病的叶酸缺乏患者中,以行走不稳为主要表现的有54例,占33.33%。
本研究发现,以行走不稳为主要表现的叶酸缺乏患者,发病时间一般在1 w左右,较脑血管病合并低叶酸者起病较慢;发病平均年龄在77岁左右,较脑血管病合并低叶酸者年龄高。本组患者均排除周围神经病导致的行走不稳可能。叶酸可有效治疗与周围神经病变相关的神经性疼痛[8]。研究表明,叶酸可以保护糖尿病大鼠免于糖尿病周围神经病变,其潜在机制可能与改善神经生长因子的表达和降低丙二醛水平有关[9]。
以行走不稳首发表现叶酸缺乏组颅内总的缺血灶数量较多,主要集中在大脑半球的缺血灶数量较多,尤其是额叶、顶叶、颞叶的缺血灶数量增多;放射冠、侧脑室、基底节以及以下部位的缺血灶数量无变化。从形态上来说,行走不稳首发表现叶酸缺乏组,大脑半球的缺血灶大多数呈点状独立分布;而叶酸缺乏合并脑血管病对照组,大脑半球缺血灶大多数融合成条线状、条带状,边界模糊不清的病灶。大脑额叶,颞叶,顶叶,枕叶,胼胝体等部位病变如出血,缺血,炎症,肿瘤等,均会引起行走不稳。暴露于叶酸缺乏饮食3 m可使血浆同型半胱氨酸水平比正常饮食高6~10倍。叶酸降低,同型半胱氨酸升高,同型半胱氨酸是一种内皮毒素,参与动脉粥样硬化进程,促进血栓形成,导致颅内缺血灶的形成。叶酸缺乏的129/SV野生型小鼠的大脑病变量和大脑中动脉闭塞72 h再灌注后的神经功能缺损比对照组增加了2.1倍[10]。叶酸缺乏对大脑皮质有显著影响。免疫组织化学和形态计量学研究显示,叶酸对阿斯巴甜诱导的大鼠大脑皮质损伤具有明显的保护作用[11]。叶酸能够在慢性轻度压力或母体剥夺大鼠的大脑中发挥抗氧化作用,增加大鼠大脑超氧化物歧化酶和过氧化氢酶活性,降低大鼠脑中蛋白质羰基化和脂质过氧化的水平,降低髓过氧化物酶活性[12]。292例妊娠者暴露于叶酸强化的谷类产品,可以强化与皮质发育改变之间联系[13]。叶酸,甜菜碱和这些补充剂的联合疗法可减少与产前饮酒有关的新生大鼠大脑皮质组织中神经细胞凋亡[14]。
