七氟菊酯和溴氰菊酯对棉铃虫肠道菌群的影响
2020-12-11姜笑维关丹阳李清亚HongmeiLIBYARLAY贺秉军
姜笑维,关丹阳,李清亚,刘 晓,Hongmei LI-BYARLAY,贺秉军,*
(1.南开大学生命科学学院,生物活性材料教育部重点实验室,天津 300071; 2.Central State University,Wilberforce,OH 45384,USA)
肠道是生物体中最大、最复杂的生态系统,被认为是生物的“微生物器官”(Possemiersetal.,2011;Byndloss and Bäumler,2018)。昆虫肠道内栖息着大量微生物,它们与宿主相互影响,协同进化,形成了复杂而动态平衡的微生物区系(Dillon and Chamley,2002;王四宝和曲爽,2017)。肠道微生物及其代谢产物参与宿主的营养代谢和免疫调节等生理活动,同时能够降低宿主被病原微生物感染的机率(Dillon and Chamley,2002;Lietal.,2016)。有研究表明一些昆虫肠道中的Gilliamella、乳酸杆菌Lactobacillus和双歧杆菌Bifidobacterium参与合成果胶降解酶、糖苷水解酶和多糖水解酶等,从而帮助宿主消化吸收食物中的营养成分(Engel and Moran,2012),而肠道菌群紊乱则会引起宿主的免疫反应失调、肠屏障破坏、对病原体的清除率降低,以及存活能力下降等病态现象(Round and Mazmanian,2009;徐兴伟等,2017)。Cox-Forster等(2007)利用高通量测序发现,感染蜂群衰竭失调病症(colony collapse disorder,CCD)与未感染CCD蜂群的肠道优势菌群存在差异。也有学者发现,肠道菌群与宿主抗药性相关,如肠球菌能介导小菜蛾Plutellaxylostella对毒死蜱的抗性,沙门菌可以降低小菜蛾对毒死蜱的抗性(Xiaetal.,2018);椿象共生菌可介导宿主对杀螟松的抗性(Kikuchietal.,2012)。肠道菌群的结构和相对丰度一定程度上可反映昆虫的健康状况及其对体内外不良环境的抵抗效力,因此对杀虫剂等不利因子存在条件下肠道菌群变化的检测与分析可一定程度上揭示昆虫对这些因子的适应机制。
棉铃虫Helicoverpaarmigera是一种世界性农业害虫,食性广,生活周期短,危害大。拟除虫菊酯类杀虫剂是防治此类害虫的常用杀虫剂,根据其化学结构及作用后的症状,可分为Ⅰ型拟除虫菊酯和Ⅱ型拟除虫菊酯两大类。Ⅰ型拟除虫菊酯不含α-氰基,如七氟菊酯(tefluthrin),主要引发T综合征(tremor-syndrome),表现为不安、麻痹、过度兴奋及身体震颤的症状;Ⅱ型拟除虫菊酯含有α-氰基,如溴氰菊酯(deltamethrin),主要引发CS综合征(choreoathetosis-salivation-syndrome),表现为动作失调、身体扭曲、抽搐、流涎等症状。目前,棉铃虫已对拟除虫菊酯类杀虫剂产生了严重抗药性。基于前述昆虫肠道菌群与宿主抗药性相关的重要线索,检测分析拟除虫菊酯类杀虫剂作用前后棉铃虫肠道微生物结构和代谢的变化,对拟菊酯类杀虫剂作用机理以及棉铃虫抗药性机理分析具有重要意义。目前尚未见相关报道。
本研究通过16S rDNA测序及Biolog-Eco分别分析饲喂普通人工饲料、含2%七氟菊酯(Ⅰ型拟除虫菊酯)粉剂饲料和含2.5%溴氰菊酯(Ⅱ型拟除虫菊酯)乳油饲料的棉铃虫幼虫肠道微生物结构以及肠道微生物对31种碳源代谢的变化,探究溴氰菊酯和七氟菊酯对棉铃虫肠道菌群的结构和代谢功能的影响,分析拟除虫菊酯杀虫剂的作用机理。
1 材料与方法
1.1 试虫的饲养
实验所用棉铃虫为拟除虫菊酯敏感品系,购自中国农业科学院植物保护研究所。饲养条件为:温度25~28℃,相对湿度60%~80%,光周期14L∶10D。棉铃虫普通人工饲料配方参考卓乐姒等(1981)。
1.2 添加杀虫剂饲料的配制和试虫分组处理
分别配制2%七氟菊酯(Ⅰ型拟除虫菊酯)粉剂和2.5%溴氰菊酯(Ⅱ型拟除虫菊酯)乳油(有效成分25 g/L)的亚致死浓度(8 mg/L),将普通人工饲料切成边长为1 cm的小块分别浸泡在药液中,5 min后将饲料取出,晾至半干。棉铃虫2和3龄幼虫分别饲喂普通人工饲料(对照组,SS)、含2%七氟菊酯粉剂饲料(七氟菊酯处理组,Te)和含2.5%溴氰菊酯乳油饲料(溴氰菊酯处理组,DM),36 h后进行后续操作。
1.3 棉铃虫肠道基因组DNA的提取
随机选取体型大小一致、生长健康的SS,Te和DM组3龄幼虫各150头,饥饿处理后将幼虫置于75%的酒精中30秒进行体表消毒,然后用0.8%的生理盐水漂洗3次,无菌条件下解剖取出肠道,放在1 mL玻璃匀浆器中,加入少许0.8%的生理盐水,立即进行匀浆,使用Magen Hipure Soil DNA Kit提取肠道基因组DNA备用。每个样品50根肠道,每组设置3个重复。
1.4 棉铃虫肠道细菌16S rDNA扩增、建库和测序
使用金唯智设计的扩增原核生物16S rDNA V3-V4区的引物,正向引物:5′-CCTACGGRRBGCA SCAGKVRVGAAT-3′;反向引物:5′-GGACTAC NVGGGTWTCTAATCC-3′。反应体系(25 μL):TransStart Buffer 2.5 μL,dNTPs 2 μL,正反向引物(10 mmol/L)各1 μL,TransStart Taq DNA 0.5 μL,模板DNA 20 ng,补ddH2O至25 μL。PCR反应参数:94℃预变性3 min;94℃变性5 s,57℃退火90 s,72℃延伸10 s,最终72℃延伸 5 min,24个循环。PCR扩增产物使用1%琼脂糖凝胶电泳检验。
通过PCR向16S rDNA的PCR产物末端加上带有Index的接头,以便进行NGS测序。使用Agilent 2100生物分析仪(Agilent Technologies,Palo Alto,CA,美国)检测文库质量,并通过Qubit 2.0 Fluorometer (Invitrogen,Carlsbad,CA)检测文库浓度。DNA文库混合后,按Illumina MiSeq(Illumina,San Diego,CA,美国)使用说明书进行PE250/300双端测序,由MiSeq自带的MiSeq Control Software(MCS)读取序列信息(苏州金唯智生物科技有限公司)。
1.5 qPCR验证棉铃虫肠道细菌
利用qPCR验证SS,DM和Te棉铃虫肠道中变形菌门(Proteobacteria)和厚壁菌门(Firmicutes)高通量测序结果。并用棉铃虫肠道总细菌量对这两个菌门进行相对定量。qPCR引物设计在16S rDNA的保守区域内,引物序列参照夏晓峰(2014),总细菌定量引物:正向引物:5′-CGGCAACGAGCGCAA CCC-3′;反向引物:5′-CCATTGTAGCACGTGTGTGTA GCC-3′。变形菌门定量引物:正向引物:5′-TCGTCA GCTCGTGTYGTGA-3′;反向引物:5′-CGTAAGGG CCATGATG-3′。厚壁菌门定量引物:正向引物:5′-GGAGYATGTGGTTTAATTCGAAGCA-3′;反向引物:5′-AGCTGACGACAACCATGCAC-3′。qPCR反应体系(25 μL):SYBR Premix Ex Taq Ⅱ(TakaRa) 12.5 μL,20 ng肠道细菌总DNA模板,正反向引物(10 mmol/L)各1 μL,其余用ddH2O补足。三步法qPCR扩增程序:95℃预变性30 s;95℃ 3 s,40次循环;60℃ 30 s,95℃ 15 s,60℃ 1 min,95℃ 15 s。qPCR在Eppendorf 实时荧光定量PCR仪Realplex2上进行。qPCR产物相对丰富度用2-ΔΔCT法计算(Livak and Schmittgen,2001)。
1.6 Biolog-Eco检测棉铃虫幼虫肠道菌群代谢活性
Biolog-Eco技术可以用于分析微生物对Eco板上31种碳源的利用情况。Biolog-Eco板的每孔平均颜色变化率(average well color development,AWCD)是反映环境微生物代谢活性,即利用单一碳源能力的重要指标。Biolog-Eco板的碳源有31种单一碳源和空白对照,每种碳源和空白对照有3个平行。31种碳源按照化学基团的性质分成6类,即胺/氨基化合物、氨基酸类、糖类、羧酸类、双亲化合物类和聚合物(孔滨和杨秀娟,2011)。分别取对照组(SS)、溴氰菊酯处理组(DM)和七氟菊酯处理组(Te)棉铃虫2龄和3龄幼虫各35头,在无菌条件下解剖取出肠道,放在1 mL玻璃匀浆器中,加入少许0.8%的生理盐水,立即进行匀浆,用0.8%生理盐水定容至12.5 mL。无菌条件下将肠道样品悬浮液加样到Biolog-Eco微孔板中,每孔120 μL,将加样后的Biolog-Eco板置于30℃恒温箱中培养,1 h后用酶标仪读取吸光度值,此次读数设为初始值,之后每隔24 h读数1次,连续7~10次。
棉铃虫肠道微生物代谢活性用每孔平均颜色变化率(AWCD)表示,计算公式:AWCD=[∑(Ai-ACK)]/n(李文红等,2018)。
其中,Ai为i孔碳源590 nm下的吸光度值减去750 nm下的吸光度值,OD590与OD750的差值大于0.2的为可利用的碳源;ACK为对照孔的吸光度值。n为碳源总数。
利用各样品培养 96 h 的数据,利用下列公式计算棉铃虫3组样品微生物群落多样性的 Shannon指数(H)(Braunetal.,2006)和McIntosh指数(U)(Xietal.,2003):
H=-∑Pi×lnPi;
其中,Pi为第i孔的相对吸光值与整个平板相对吸光值总和的比值;ni是第i孔的相对吸光值。
采用 Microsoft Excel 2010软件和SPSS软件进行数据处理和分析,Origin 8.0软件和Adobe Illustrator CS6软件作图。
1.7 数据分析
对1.4节测序原始数据进行过滤处理,去除嵌合体,得到优化序列,在97%的相似度下将其聚类为物种分类的OTU(operational taxonomic units),OTU Venn图分析不同样品中共有及特有的OTU数目。运用Mothur v.1.30.1软件,采用α多样性指数(Shannon,Simpson,Coverage,Chao1,Sobs,Ace)分析样品的丰富度、均匀度及覆盖度等;选用T检验,即在样本方差相等时,分析样本的均值是否存在显著性差异,群落组成图在不同分类水平分析物种的组成及相对丰度,组间差异性检验分析不同组间物种是否差异显著。
2 结果
2.1 棉铃虫肠道细菌测序信息分析
SS,DM和Te组9个棉铃虫肠道样品共得到有效序列571 002条,平均每个样品63 445条,有效序列平均长度为450 bp。为了研究肠道细菌的物种组成多样性,在97%相似度下将其聚类为用于物种分类的OTU。随着测序深度增加,物种稀释曲线趋于平缓,说明本实验对样品的处理已达到了一定的深度和广度,完全满足后续实验分析。此外,全部样本的Coverage指数都在99.5%以上(表1),说明测序量能够覆盖样本中的绝大部分物种。
SS,DM和Te组肠道样品共有的OTU数目为209个,SS与Te共有的OTU数目为230个,SS与DM共有的OTU数目为219个,DM与Te共有的OTU数目为220个。SS特有的OTU为9个,Te特有的OTU数目为22个,DM特有的OTU数目为14个。这些数据说明SS,DM和Te之间有相同的菌群,但也有差异(图1)。
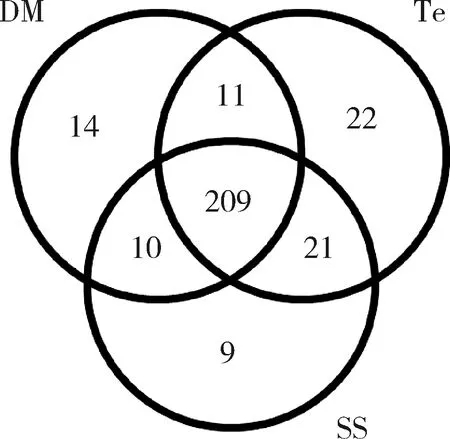
图1 棉铃虫3龄幼虫肠道细菌OTUs Venn图Fig.1 Venn diagram of gut bacteria in the 3rd instar larvae of Helicoverpa armigeraDM:饲喂2.5%溴氰菊酯乳油饲料的处理组Treatment group fed with the diet containing 2.5% deltamethrin emulsifiable concentrate;SS:饲喂普通人工饲料的对照组Control group fed with the normal artificial diet;Te:饲喂2%七氟菊酯粉剂饲料的处理组Treatment group fed with the diet containing 2% tefluthrin powder.下同The same below.
2.2 棉铃虫肠道细菌物种组成
对肠道菌群测序的OUT进行物种注释,在门(phylum)水平主要有厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、蓝藻菌门(Cyanobacteria)、放线菌门(Actinobacteria)和异常球菌-栖热菌门(Deinococcus-Thermus)。其中,厚壁菌门、变形菌门、拟杆菌门和蓝藻菌门占90%以上,属于优势菌门。SS组中第1优势菌门为拟杆菌门(50.2%),第2优势菌门是厚壁菌门(38.1%),第3优势菌是变形菌门(7.3%),蓝藻菌门占1.6%。DM组中第1优势菌门是厚壁菌门(50.6%),第2优势菌门是变形菌门(26.1%),第3优势菌门是蓝藻菌门和拟杆菌门(分别占10.8%和6.5%)。七氟菊酯组(Te)中第1优势菌门是厚壁菌门(51.3%),第2优势菌门是变形菌门(29.1%),第3优势菌门是拟杆菌门(13.5%),蓝细菌门占2.9%(图2:A)。与SS相比,DM和Te的厚壁菌门和蓝藻菌门相对丰度升高,拟杆菌门相对丰度下降,但差异不显著(P>0.05)(图3:A)。qPCR检测结果如图4所示,溴氰菊酯处理组和七氟菊酯处理组棉铃虫3龄幼虫肠道细菌中厚壁菌门占比大于对照组的,此结果与16S rDNA测序分析结果相似。

图2 棉铃虫3龄幼虫肠道细菌在门(A)和属(B)水平的组成Fig.2 Proportional composition of gut bacteria in the 3rd instar larvae of Helicoverpa armigera at the phylum (A) and genus (B) levels
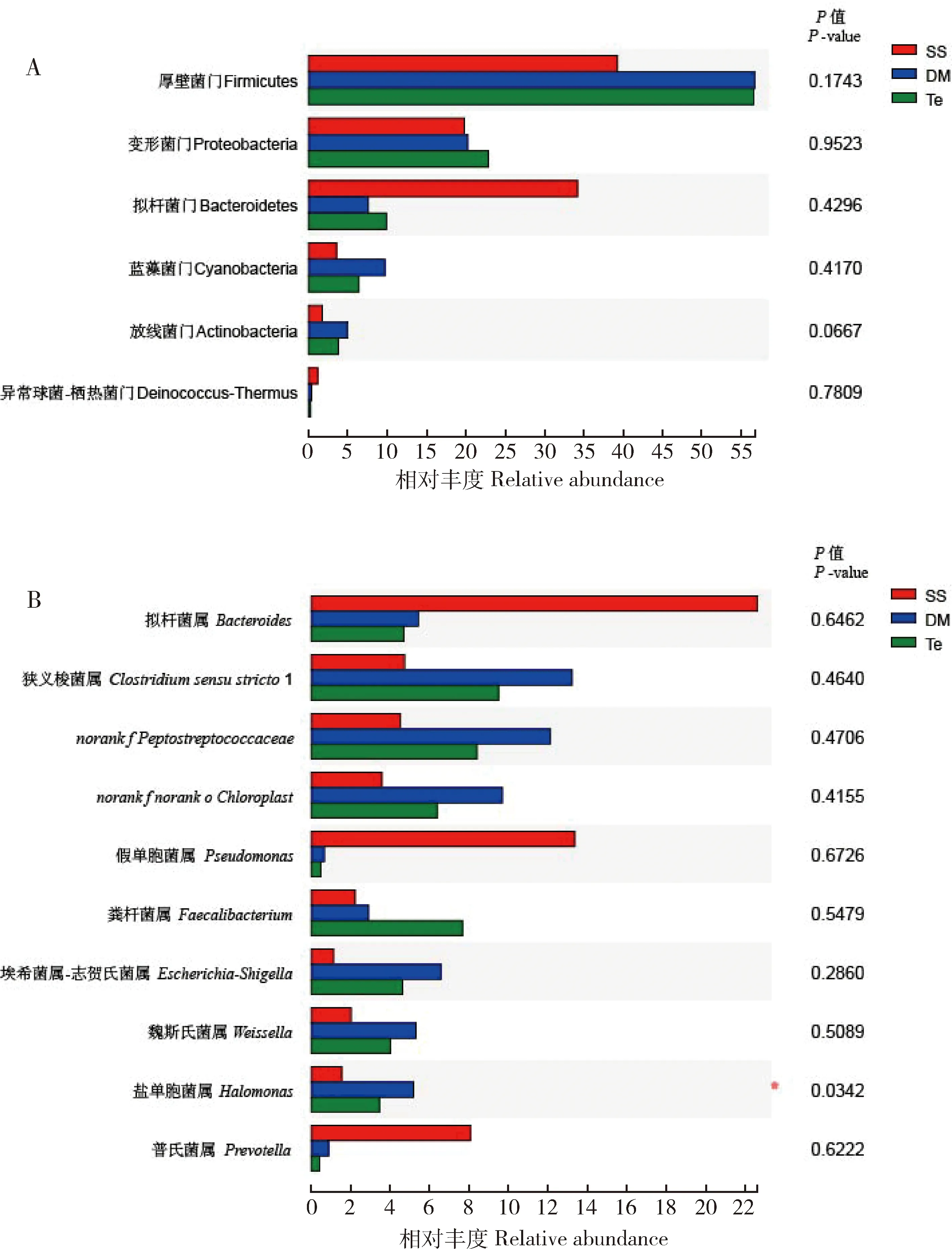
图3 棉铃虫3龄幼虫肠道细菌门(A)和属(B)水平的相对丰度差异图Fig.3 Relative abundance differences at the phylum (A) and genus (B) levels of gut bacteria in the 3rd instar larvae of Helicoverpa armigera图中数据为平均值±标准差,星号示差异显著(P<0.05,单因素方差分析,95%置信区间)。Data in the figure are mean±SD,and the asterisk indicates significant difference (P<0.05,one-way ANOVA analysis,95% confidence interval).
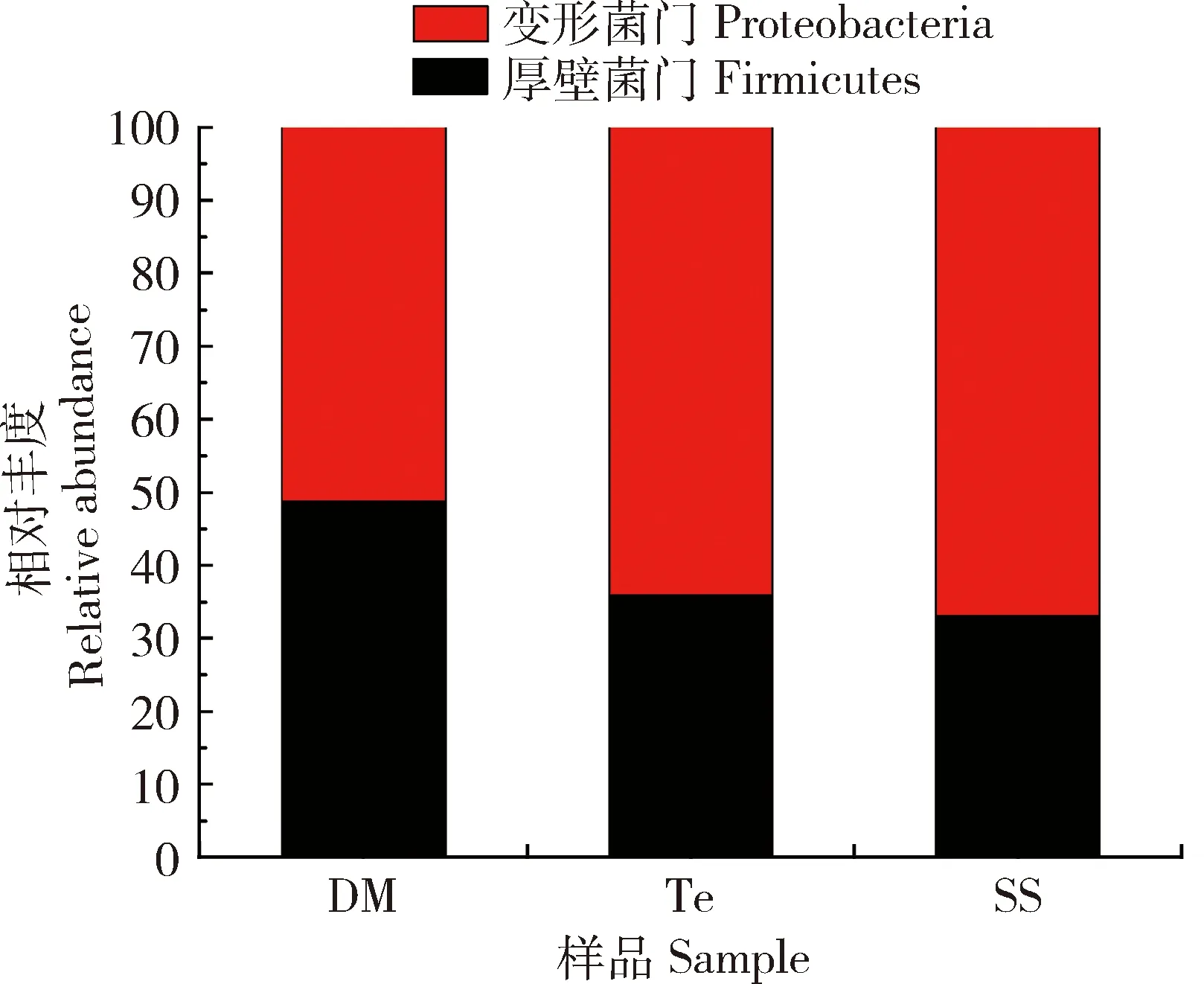
图4 qPCR检测棉铃虫3龄幼虫肠道细菌门水平相对丰度Fig.4 Relative abundance of gut bacteria at the phylum level in the 3rd instar larvae of Helicoverpa armigera by qPCR
在属水平(图2:B),与SS相比,DM和Te的拟杆菌属Bacteroides、假单胞菌属Pseudomonas和普氏菌属Prevotella相对丰度下降。狭义梭菌属Clostridiumsensustricto1、norankfPeptostreptococcaceae、魏斯氏菌属Weissella、埃希菌属-志贺氏菌属Escherichia-Shigella、盐单胞菌属Halomonas的相对丰度上升。其中,盐单胞菌属Halomonas的相对丰度显著升高(P<0.05)(图3:B)。
2.3 棉铃虫肠道细菌多样性
基于16S rDNA测序对DM,SS和Te 3组样品中细菌α多样性进行分析,结果如表1所示,3组样品的α多样性指数均无显著性差异(P>0.05)。基于Biolog-Eco实验的细菌多样性指数分析结果如表2所示,2龄幼虫期各组的Shannon指数和McIntosh指数没有显著性差异(P>0.05)。3龄幼虫期DM组McIntosh指数有显著(P<0.05)降低。2龄幼虫期各组的Shannon指数和McIntosh指数均大于3龄期的。
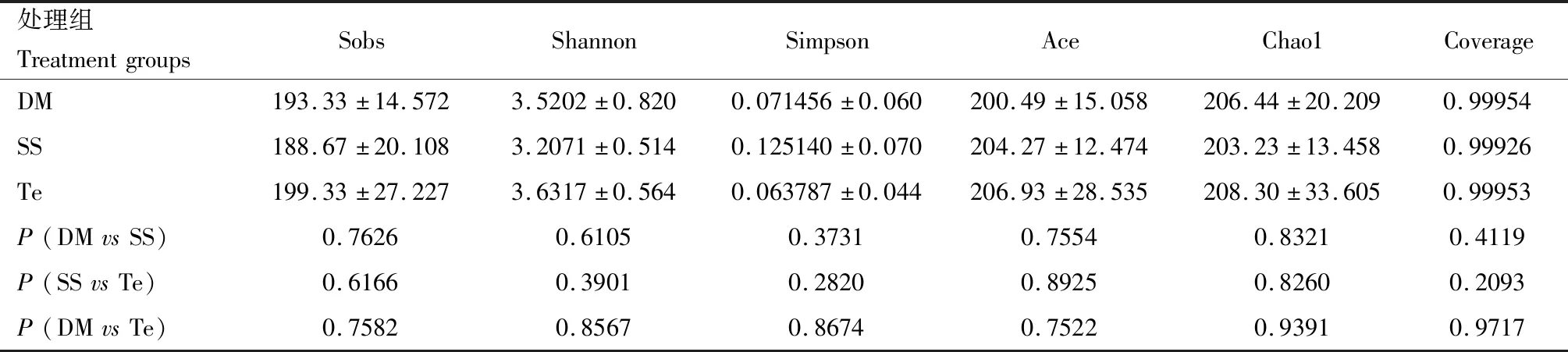
表1 基于16S rDNA测序的棉铃虫3龄幼虫肠道细菌α多样性指数Table 1 Alpha diversity indices of gut bacteria in the 3rd instar larvae of Helicoverpa armigera based on 16S rDNA sequencing
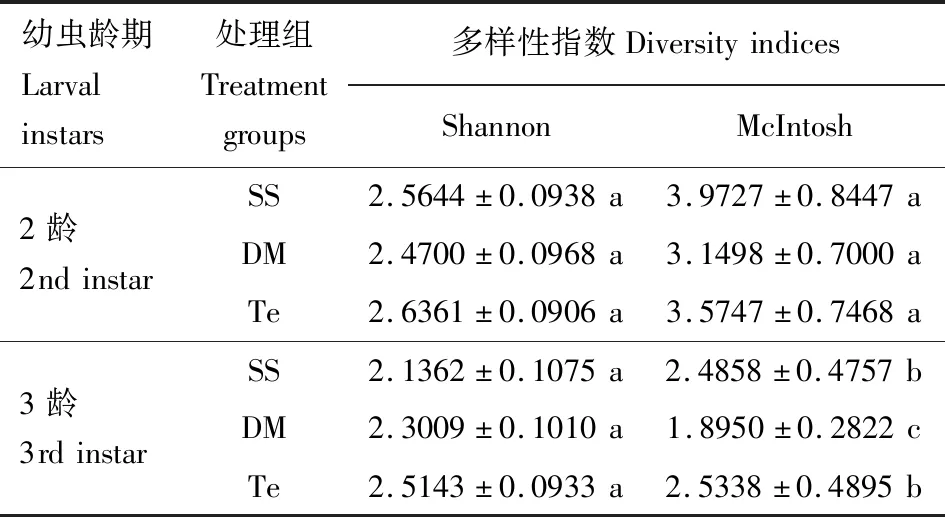
表2 基于Biolog-Eco实验的棉铃虫幼虫肠道细菌多样性指数Table 2 Diversity indices of larval gut bacteria of Helicoverpa armigera based on Biolog-Eco assay
2.4 棉铃虫幼虫肠道菌群代谢活性
根据 AWCD计算公式,本研究中SS,DM和Te组棉铃虫幼虫肠道样品中细菌利用31种碳源的AWCD变化曲线如图5所示,随着培养时间的延长,AWCD值基本持续升高,说明肠道细菌对碳源的利用力呈逐渐增加的趋势。不同组中2龄幼虫的AWCD值均大于3龄幼虫的(图5:A-C),说明2龄幼虫的代谢要高于3龄幼虫的。2龄幼虫肠道样品中,SS,Te和DM组的AWCD值相似,Te的稍高(图5:D);3龄幼虫肠道样品中,Te的AWCD稍高,DM的AWCD值最低(图5:E)。
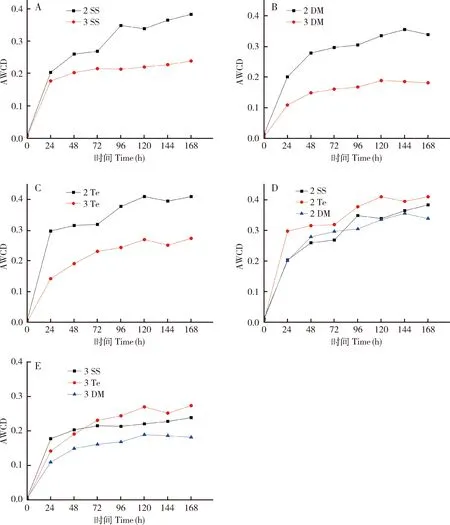
图5 Biolog-Eco检测棉铃虫幼虫肠道细菌AWCD随培养时间的变化Fig.5 Changes in AWCD of larval gut bacteria of Helicoverpa armigera with culturing time detected by Biolog-EcoA,B,C:分别为SS (A),DM (B)和Te (C)组2和3龄幼虫在1-168 h内肠道细菌的AWCD随时间变化情况AWCD change in the gut bacteria of the 2nd and 3rd instar larvae in SS (A),DM (B) and Te (C) groups,respectively,within 1-168 h.D,E:分别为SS,DM和Te组2龄(D)和3龄(E)幼虫在1-168 h内肠道细菌的AWCD随时间变化情况AWCD change in the gut bacteria of the 2nd instar (D) and 3rd instar (E) larvae in SS,DM and Te groups,respectively,within 1-168 h.AWCD:平均颜色变化率,反映环境微生物代谢活性Average well color development,reflecting the metabolic activity of environmental microorganisms.2 SS,3 SS:分别为SS组的2和3龄幼虫2nd and 3rd instar larvae in SS group,respectively;2 DM,3 DM:分别为DM组的2和3龄幼虫2nd and 3rd instar larvae in DM group,respectively;2 Te,3 Te:分别为Te组的2和3龄幼虫2nd and 3rd instar larvae in Te group,respectively.
为分析棉铃虫肠道细菌对不同类型碳源的利用情况,调查1-168 h各肠道样品在Biolog-Eco板上的读数,结果如表3所示,SS,Te和DM组都能代谢的碳源:α-环式糊精、D-纤维二糖、α-D-乳糖、β-甲基-D-葡萄糖苷、D-木糖、D-甘露醇和N-乙酰-D-葡萄糖胺7种,其中α-环式糊精是聚合物,其他是糖类;都不能利用的碳源:D-葡萄糖胺酸、D-半乳糖酸内酯、2-羟基苯甲酸、γ-羟基丁酸、L-苏氨酸和腐胺6种。
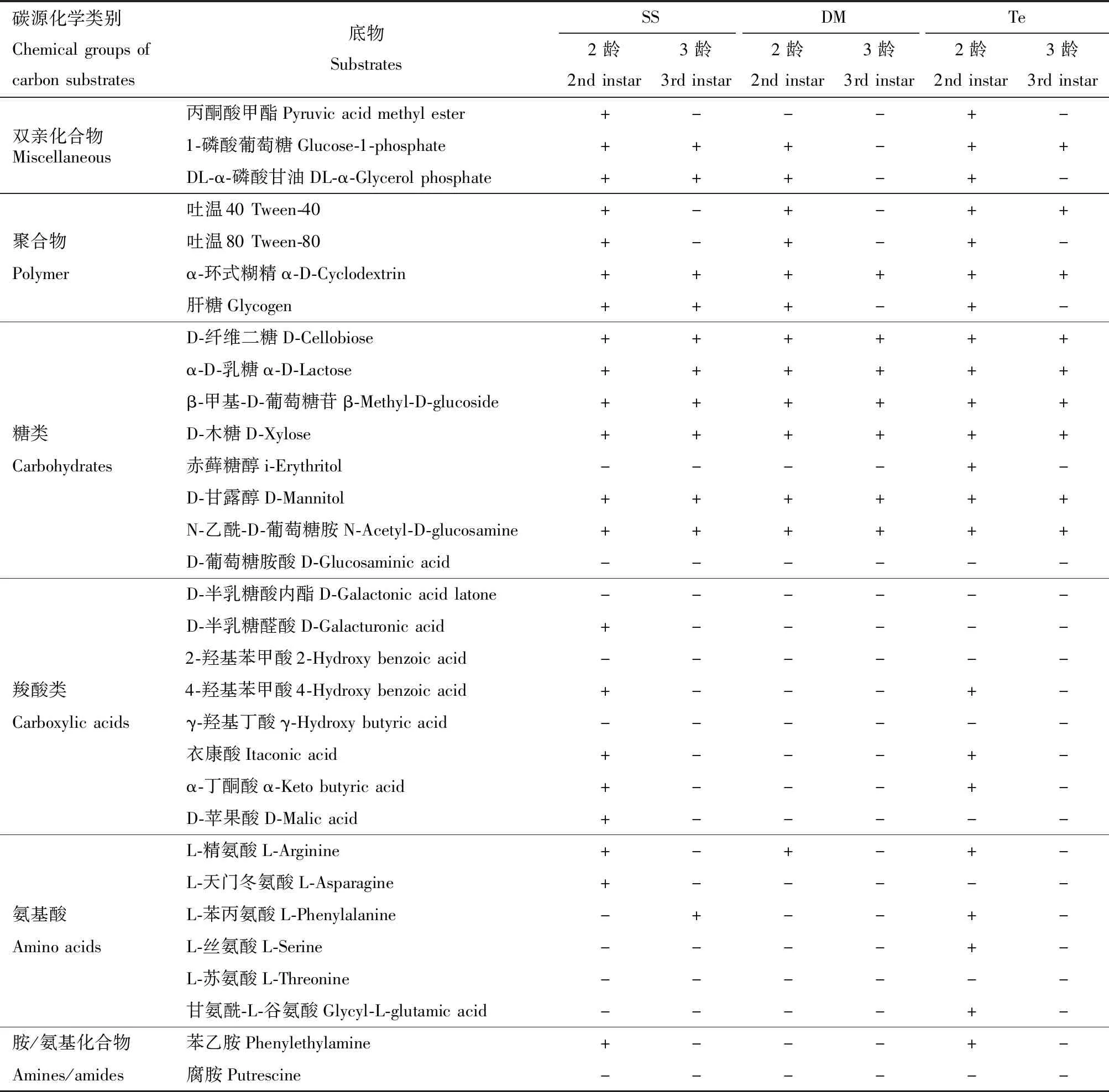
表3 棉铃虫幼虫肠道细菌对Biolog-Eco板上碳源的利用情况Table 3 Use of carbon substrates on Biolog-Eco plate by larval gut bacteria of Helicoverpa armigera
DM组2龄幼虫肠道细菌对丙酮酸甲酯、4-羟基苯甲酸、衣康酸、D-苹果酸、α-丁酮酸、苯乙胺、L-天门冬氨酸和D-半乳糖醛酸的代谢能力降低;Te组2龄幼虫肠道细菌对L-苯丙氨酸、L-丝氨酸、甘氨酰-L-谷氨酸和赤藓糖醇的代谢增强,对L-天门冬氨酸、D-苹果酸和D-半乳糖醛酸的代谢能力下降。DM组3龄幼虫肠道细菌对1-磷酸葡萄糖、DL-α-磷酸甘油、肝糖和L-苯丙氨酸的代谢能力下降;Te组3龄幼虫肠道细菌对DL-α-磷酸甘油、肝糖和L-苯丙氨酸的代谢能力下降。
3 讨论
昆虫肠道菌群与昆虫的健康状况密切相关,与昆虫的抗药性也有一定关系(李文红等,2018;Xiaetal.,2018),因此,研究溴氰菊酯和七氟菊酯作用后棉铃虫肠道菌群的结构和代谢变化,一定程度上有助于分析肠道菌群与棉铃虫抗药性的联系,从不同角度阐明拟除虫菊酯类杀虫剂的作用机理。
16S rDNA测序结果表明棉铃虫肠道菌群主要属于6个菌门,分别是厚壁菌门、变形菌门、拟杆菌门、蓝藻菌门、放线菌门和异常球菌-栖热菌门(图2:A)。其中厚壁菌门、变形菌门、拟杆菌门和蓝藻菌门占90%以上,属于优势菌门。对照组、溴氰菊酯处理组和七氟菊酯处理组棉铃虫肠道菌群的菌门种类基本一致,比例有所不同,溴氰菊酯处理组和七氟菊酯处理组的厚壁菌门相对丰度比对照组高12%,拟杆菌相对丰度比对照组分别低44.7%和36.7%,蓝藻菌门分别是对照组的3和2倍(图3:A)。与对照组相比,溴氰菊酯处理组和七氟菊酯处理组棉铃虫肠道菌群的拟杆菌属Bacteroides、假单胞菌属Pseudomonas和普氏菌属Prevotella的相对丰度降低。盐单胞菌属Halomonas、狭义梭菌属Clostridiumsensustricto1、norankfPeptostreptococcaceae、魏斯氏菌属Weissella、埃希菌属-志贺氏菌属Escherichia-Shigella、盐单胞菌属Halomonas的相对丰度升高。其中,盐单胞菌属Halomonas的相对丰度显著(P<0.05)升高(图3:B)。
拟杆菌属Bacteroides和普氏菌属Prevotella对于加固肠上皮、维持肠道功能具有重要意义,特别是拟杆菌属对肠道的保护作用尤为重要(郑艺等,2014);此外,拟杆菌属Bacteroides对糖代谢起到调节作用(Tao,2014)。假单胞菌属Pseudomonas对昆虫病原真菌的拮抗作用(Indiragandhietal.,2008)等。饲喂含溴氰菊酯和七氟菊酯的饲料后,棉铃虫肠道中拟杆菌门(Bacteroides)、假单胞菌属Pseudomonas和普氏菌属Prevotella的相对丰度下降,可能会导致棉铃虫肠道保护作用下降,免疫力降低,使棉铃虫更易死亡。本研究中相对丰度升高的菌中有些是动物致病菌,如狭义梭菌属Clostridiumsensustricto1能够引起食物中毒和坏死性肠炎等疾病(Bryant and Stevens,2010;Kiyonobuetal.,2019),破坏宿主的免疫反应(Ellemoretal.,1999;Bryantetal.,2000),引起肠毒素血症,破坏血脑屏障等(Lindenetal.,2019)。
Biolog-Eco实验发现,随着培养时间的延长,AWCD值基本持续升高(图5),说明棉铃虫幼虫肠道细菌对碳源的利用呈逐渐增加的趋势,2龄幼虫对碳源的利用高于3龄幼虫。溴氰菊酯处理组能够利用的碳源种类最少。溴氰菊酯处理组2龄幼虫肠道细菌对羧酸类碳源的代谢能力下降,七氟菊酯处理组对氨基酸类代谢能力增强,七氟菊酯处理组和溴氰菊酯处理组3龄幼虫肠道细菌对DL-α-磷酸甘油、肝糖和L-苯丙氨酸等碳源的利用能力下降(表3)。但是多样性分析发现,各组肠道菌群多样性和丰富度没有形成明显差异(表1)。棉铃虫2龄幼虫肠道菌群的多样性和丰富度比3龄幼虫的有优势(表2)。七氟菊酯和溴氰菊酯处理的棉铃虫的幼虫肠道细菌的代谢功能不同,可能与七氟菊酯和溴氰菊酯的化学结构不同有关,七氟菊酯是Ⅰ型拟除虫菊酯,不含有α-氰基,而溴氰菊酯是Ⅱ型拟除虫菊酯,含有α-氰基。有研究表明Ⅰ型拟除虫菊酯和Ⅱ型拟除虫菊酯的作用机制可能有很大区别(Breckenridgeetal.,2009),这两种拟除虫菊酯的结构差异可能是导致棉铃虫的肠道菌群结构和功能差异的原因之一。
本研究检测了七氟菊酯和溴氰菊酯对棉铃虫肠道菌群结构和代谢的影响,结果显示拟除虫菊酯可改变棉铃虫肠道菌群的结构,主要是使益生菌的相对丰度降低,致病菌的相对丰度升高。研究结果对开展肠道微生物的功能研究有重要参考价值,为拟除虫菊酯类杀虫剂对棉铃虫作用机制分析提供了参考,也为通过肠道菌群调控治理棉铃虫的抗药性提供了新思路。
致谢本实验使用了美吉生物云平台进行数据分析,在此表示感谢。
