昆虫着色及体表黑色斑纹和斑点形成机制研究进展
2020-12-11梁燕婷留怡勤徐豫松王华兵
高 云,梁燕婷,留怡勤,徐豫松,王华兵
(浙江大学动物科学学院,杭州 310058)
昆虫是地球上数量最多的动物群体,现已发现100多万种,形态各异的昆虫几乎遍布世界的每一个角落。昆虫的广泛分布与其多样性的体色和斑纹有着密切的联系。昆虫的体色和斑纹在生态和行为方面具有重要作用,有利于躲避敌害或适应环境变化,是生物进化和自然选择的结果。
昆虫模拟、伪装成周边的环境所形成的拟态色对自身保护有利,由明暗颜色的对比或者鲜艳明亮的色彩形成的警戒色用来警告捕食者自身有毒或不可食,这些方法是昆虫成功欺骗捕食者的有效生存策略(Tullbergetal.,2005;Janzenetal.,2010;Dasmahapatraetal.,2012)。此外,昆虫体色和斑纹还具有寻求伴侣、适应地理、调节体温、抵抗紫外线等重要的生理功能,从而使昆虫在残酷的自然选择中存活下来,因此昆虫体色和斑纹是进化选择的重要靶标之一(Wittkoppetal.,2003,2009;Kronforstetal.,2006,2012;Takahashi,2013;彭晨星等,2016)。
昆虫体色和斑纹多型现象在昆虫第二大目——鳞翅目(Lepidoptera)昆虫中尤其显著。这种多样性不仅存在于不同的物种中,在相近物种甚至同一物种不同的品系间、同一品系处在不同环境或不同发育时期的个体间也会呈现显著差异,仅家蚕Bombyxmori就有200多种与着色相关的突变体,比如:家蚕N4品系表皮有3种斑纹,分别为第2胸节眼点区域、第2腹节的半月纹和第5腹节的星斑纹,然而家蚕自发突变体Zebra(Ze)每个腹节前端都有黑色斑纹,足点处有黑点(KonDoetal.,2017)。凤蝶属中的大多数物种在幼体发育期间会显著改变其体色模式,并且这些变化是固定且不可逆的(Prudicetal.,2007)。柑橘凤蝶Papilioxuthus1-4龄幼虫体表呈现模仿鸟粪的黑色和棕色的斑纹图案,在末龄幼虫期,它们的着色模式又切换为绿色(Tullbergetal.,2005;Jinetal.,2019)。研究者利用家蚕和柑橘凤蝶的着色突变体,通过定位克隆、连锁分析和遗传图谱解析了导致色素沉积差异的基因,但是体色和斑纹模式的形成和调节机制至今仍不完全清楚。近年来,CRISPR/Cas9,RNAi和体内电穿孔介导的基因组编辑技术快速发展,为分析着色的分子机制提供了重要工具。本文综述了昆虫体色和斑纹多样性的形成和影响因素,昆虫着色类型及物质基础,以及黑色斑点和斑纹的形成和调节机制方面的研究进展,希望通过相关研究的梳理,为今后的研究提供借鉴。
1 昆虫体色和斑纹多样性的形成和影响因素
目前昆虫体色和斑纹多样性形成和影响因素的主要假说有寄主专化论、环境因素控制论、基因控制论和激素控制论等。
1.1 寄主专化论
许多昆虫因其寄主植物不同而呈现出不同颜色。棉蚜Aphisgossypii是世界性的重要害虫,多食性的棉蚜在长期取食和进化过程中已分化形成不同的寄主专化型。对棉花型和黄瓜型两种专化型棉蚜寄主的选择行为试验结果表明,棉花型棉蚜对棉花的选择性明显高于对黄瓜的选择性,黄瓜型棉蚜对黄瓜的选择性明显高于对棉花的选择性(王丽,2015)。寄主植物对瓜蚜无翅胎生雌蚜的体色具有明显影响,取食笋瓜、南瓜、瓤子、黄瓜和冬瓜的瓜蚜体色各不相同,依次逐渐变深(王健等,1996)。
1.2 环境因素控制论
影响昆虫体色的环境因素有温度、湿度、种群密度以及背景颜色等,昆虫种类不同,环境因素对体色的影响也存在差异。
1.2.1温度:黑带食蚜蝇Episyrphusbalteatus成虫腹部体色则主要受蛹期发育温度的影响:温度降低导致蛹期延长,会产生大量的暗色个体(霍科科和张宏杰,2004)。当蚜虫在不同的恒温条件下饲养时,成虫的表皮着色表现出显著差异,24℃恒温条件下饲养的雌性成虫,头部为橙棕色,而中胸部呈现橙色;然而在12℃条件下饲养的成虫的头部和中胸部是黑色的(Liu and Carver,1982)。
1.2.2湿度:生活在高湿度环境中的飞蝗Locustamigratoria若虫体色为绿色,而低湿度环境中的若虫个体呈褐色、黄色或浅灰色。变温性果蝇Drosophilajambulina随着湿度的变化呈现多样的体色,而且体色的特异性分化是对湿热环境的适应(Khasaetal.,2013)。
1.2.3种群密度:群居型飞蝗L.migratoria的个体呈现黑色背板和棕色腹面,散居型个体体色一般为均匀的绿色,群居型的黑色体色是在散居型绿色基础上增加红色形成的(Yangetal.,2019)。斜纹夜蛾Spodopteralitura2-3龄幼虫由高密度饲养转移至单独饲养时,终龄期幼虫的黑化程度显著降低(孔海龙等,2011)。
1.2.4背景颜色:19世纪中叶之前的桦尺蠖Bistonbetularia呈浅灰色,工业革命以后,生活在工业污染区的桦尺蠖颜色变暗,而正常环境下的桦尺蠖仍呈浅色。利用计算机视觉研究食物颜色对不同日龄昆虫体色的影响,发现斜纹夜蛾幼虫体色受食物颜色影响,且在1-7日龄最为显著,这是因为食物颜色对斜纹夜蛾体色影响是一个积累的过程(彭云鹏等,2015)。
1.3 基因控制论
随着分子生物学和高通量测序技术的发展,越来越多的研究结果表明体色是由遗传基因控制的。目前已经鉴定出大量控制果蝇、家蚕和柑橘凤蝶体色和斑纹的基因。例如,雄性果蝇的特异性翅色素沉着与yellow基因的顺式调控元件的修饰有关(Gompeletal.,2005);转录因子Apontic-like(apt-like)能够调控家蚕幼虫呈现不同的斑点和斑纹模式(Yoda,2015)。
1.4 激素控制论
激素对昆虫的蜕皮、滞育等生长发育过程具有重要调节功能,在体色变异中发挥的作用也得到广泛的研究。斜纹夜蛾体色多样性由黑化激素和保幼激素(juvenile hormone,JH)共同调控:高浓度的JH抑制黑化激素的分泌,当JH浓度降低时,黑化激素滴度增加,终龄幼虫的体色变为黑色。烟草天蛾Manducasexta的表皮黑化由保幼激素和蜕皮激素(ecdysone)共同调控。眠期两种激素的滴度发生显著变化,眠后期蜕皮激素滴度下降,黑色素合成信号通路基因的转录水平显著提高,黑色素合成信号通路被激活(Hirumaand and Riddiford,2009)。
综上所述,基因、激素和各种环境条件相互协调共同影响昆虫的体色,基因控制在其中发挥决定性的作用,而其具体的协调和调控机制,尤其是在激素和基因水平上的协调和调控机制大多仍然未知。
2 昆虫着色类型及物质基础
根据颜色产生的原因,昆虫着色类型可以分为色素色和结构色。色素色是基于生理代谢产生的,是昆虫着色的重要形式。代谢物沉积在昆虫体壁,吸收某种波长的光,反射其他可见光,形成特定的颜色。结构色是昆虫体壁的鳞片或者蜡质等超微结构,使光波发生衍射、干涉或者折射产生的颜色。
昆虫体内不同类型色素物质的合成和代谢是产生多样性体色模式的重要物质基础,其中眼色素(ommochromes)、黑色素(melanin)、喋啶类色素(peridines)是影响昆虫着色最重要的色素。此外,在鳞翅目模式生物家蚕的生长发育过程中,除了上述3类着色物质,尿酸(uric acid)、类胡萝卜素(carotenoids)和黄酮类色素(flavonoids)等色素物质也发挥了重要作用。据研究,眼色素影响家蚕的卵色和成虫复眼的颜色,黑色素、蝶啶类色素、眼黄素、眼色素和尿酸共同影响家蚕幼虫体壁着色,茧丝中黄酮类色素与类胡萝卜素的比例决定茧色。
3 着色相关通路基因功能分析的新方法
通过经典遗传连锁图谱、基因组数据,结合定位克隆策略,研究人员已经鉴定出许多昆虫着色相关的候选基因。近年来,日益成熟的基因编辑技术,为深入研究着色分子机制提供了实验基础。基于CRISPR/Cas系统的基因编辑技术,可在特定时间诱导基因组或者转录产物发生双链断裂,进行定点修饰、定向敲除或插入目的基因等精确修饰,从而特异性改变遗传物质。目前的CRISPR/Cas9技术通常以人工设计的小向导RNA(small guide RNA,sgRNA)替换tracrRNA:crRNA复合物,通过非同源末端连接(non-homologous end joining,NHEJ)和同源定向修复(homologous directed repair,HDR)高效地删除、插入和激活各种组织细胞中的基因,在哺乳动物人类、食蟹猴,脊椎动物斑马鱼,无脊椎动物昆虫以及细菌等多种生物中已经得到广泛应用(Doudna and Charpentier,2014;Niuetal.,2014;周金伟等,2015;Kangetal.,2016;Tangetal.,2017;Zhangetal.,2019)。但是利用CRISPR/Cas9系统进行基因编辑仍然存在一些问题,例如:存在脱靶效应、筛选纯合体的周期比较长、敲除致死现象。为了快速地分析相关基因的功能以及发挥作用的分子机制,科研工作者一直在开发新的基因编辑工具。电穿孔介导的RNAi技术具有特异性强、重复利用性好以及高效持久的特点,可将目标基因的dsRNA或质粒DNA有效地导入靶组织(如表皮)中,研究靶基因的表达对表皮斑纹的影响,已成为探索斑纹形成相关基因功能的高效工具(Yoda,2015;KonDoetal.,2017)。
4 昆虫体表黑色斑纹和斑点的形成和调节机制
昆虫幼虫的体色和斑纹模式主要取决于表皮细胞和表皮中色素的性质和分布。与成虫相比,幼虫在每次蜕皮期都会重复色素沉着过程,同时受环境的影响较大,使得幼虫斑纹和体色发生突变的几率增加,从而呈现多样的色素沉积模式。在自然界中,黑化是生物体体色发生变异最为显著和普遍的现象,同时也是产生昆虫体色多样性非常重要的着色模式。黑化过程中黑色素(melanin)是体色和斑纹多样性形成过程中至关重要的色素,它不仅参与昆虫红色、深绿色和黑色等颜色斑纹的形成,它的前体物质多巴(dopa)和多巴胺(dopamine)还与昆虫免疫、表皮硬化等生理过程有密切的联系(弓慧琼等,2018)。在昆虫中,鳞翅目昆虫体色和斑纹多型现象尤其显著,可作为出色的模型系统用于研究颜色模式的形成与调节机制,目前已经鉴定出大量参与或调控黑色素合成的基因(表1)。

表1 已知黑色素合成信号通路基因的功能Table 1 Functions of the known genes of melanin synthesis pathway
4.1 昆虫体表黑色斑纹和斑点形成机制
以四氢生物蝶呤(tetrahydrobiopterin,BH4)为辅因子,酪氨酸经过一系列生化反应生成各种色素前体物质如图1所示。其中,黑色素合成代谢通路是研究最广泛的色素合成通路,由TH基因编码的酪氨酸羟化酶(tyrosine hydroxylase,TH)将酪氨酸转化为二羟基苯丙氨酸[又称多巴(dopa)],多巴由DDC编码的多巴脱羧酶(dopa decarboxylase,DDC)转化为多巴胺(dopamine),这些过程在表皮细胞中完成;yellow家族基因和Lac2将多巴胺或者多巴转化为多巴胺黑色素或者多巴黑色素。因此多巴胺和多巴被认为是昆虫表皮黑色素最重要的前体物质(Futahashiand and Fujiwara,2005;Futahashietal.,2008;Hiruma and Riddiford,2009;Liuetal.,2010)。合成的色素前体从表皮细胞中分泌出来,然后掺入表皮,形成可视化的黑色斑纹和斑点模式。除此以外,多巴胺还有两个代谢去向,其中一个去向是由ebony转化为N-β-丙氨酰多巴胺(N-β-alanyl dopamine,NBAD),参与表皮鞣化,且使表皮呈现黄色或者淡黄色,这一过程可以被tan逆转(Futahashietal.,2010;Lietal.,2015)。另一个去向涉及N-乙酰基多巴胺(N-acetyl dopamine,NADA)的产生,NADA参与表皮硬化,是无色硬化蛋白的前体,该过程取决于芳基烷基胺-N-乙酰基转移酶(arylalkylamine N-acetyltransferase,AA-NAT)的活性(Zhanetal.,2010)。根据时空表达谱,上述过程相关基因可以分为3组:编码分泌的蛋白基因yellow和lac2特异性地在眠中期[头囊滑移(head capsule slippage)后约4-8 h]表达;编码表皮黑色素合成酶的基因TH,DDC,ebony和tan在眠后期特异性地表达;GTPCHI在整个蜕皮期中均有表达。用竞争性的TH抑制剂3-碘酪氨酸(3-iodo-tyrosine,3-IT)处理柑橘凤蝶可抑制幼虫表皮黑化(Futahashi and Fujiwara,2005);家蚕BmTH基因结构的改变,导致新生家蚕呈巧克力色,添食多巴可使其恢复黑色,而且恢复效果呈现剂量依赖性,这表明TH是表皮黑色化过程的关键酶(Liuetal.,2010)。mln突变体的幼虫头部和成虫比野生型沉积更多的黑色素,而且突变体头部和胸足多巴胺的含量是野生型的两倍多。通过定位克隆发现,突变体中编码芳基烷基胺-N-乙酰基转移酶的基因AA-NAT发生可变剪切,导致AA-NAT的酶活性消失,使得多巴胺大量积累,并且向着合成黑色素的方向代谢,在幼虫头部和成虫积累大量的黑色素(Daietal.,2010;Zhanetal.,2010)。这些研究表明色素合成通路中的酶以及底物等处于动态平衡的过程,通路中某一催化酶或者基因表达受到抑制时,会造成底物大量积累并且沿着其他色素合成方向进行反应。
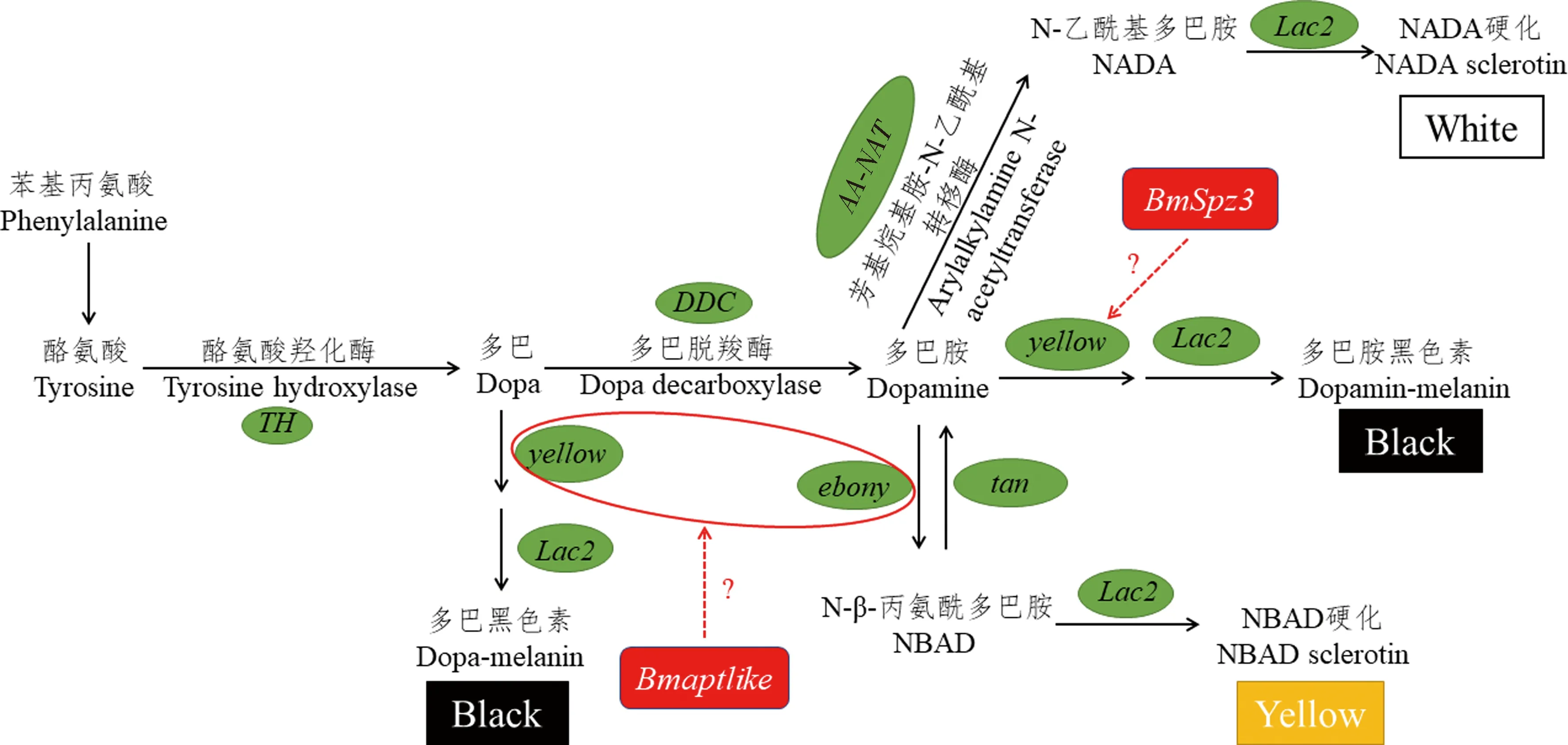
图1 黑色素生物合成信号通路Fig.1 Melanin biosynthesis pathway绿色椭圆框代表色素合成通路的关键基因,红色框代表调节因子,黑色、黄色和白色框代表色素前体沉积到表皮的颜色。The green oval boxes represent the key genes of the pigment synthesis pathway,the red boxes represent the regulator of the pathway,and the black,yellow and white boxes represent the color of the pigment precursor deposited on the epidermis.
4.2 昆虫体表黑色斑纹和斑点调节机制
通常情况下,昆虫在蜕皮期会积累大量的色素,而在此过程中,控制生长发育的保幼激素和滞育激素的滴度会发生剧烈的变化。研究证实,参与调控昆虫体色和斑纹多样性的基因的表达水平受蜕皮激素[主要活性物质20-羟基蜕皮酮(20E)]和保幼激素共同调节(Hiruma and Riddiford,2009)。柑橘凤蝶的斑纹模式在末龄幼虫期发生显著的变化,这种转变是由多种激素(蜕皮激素、保幼激素等)精确调控产生的,在4龄幼虫保幼激素敏感期(4龄起蚕前20 h),柑橘凤蝶5龄幼虫的体色已被决定,这为研究激素对体色和斑纹多样性的调节机制提供了依据(Futahashi and Fujiwara,2008;Jinetal.,2019)。分析家蚕黑色素合成通路中的基因序列,发现yellow,lac2,TH,ebony和tan基因上游5 kb区域具有潜在的单体核受体结合元件RGGTCA序列,已知该序列可结合到20E诱导的转录因子E75A和HR3;研究表明,E75A和spalt在柑橘凤蝶眼点的黑色区域特异性表达(Futahashietal.,2012)。在果蝇中,研究人员发现性别决定因子(doublesex,dsx),HOX基因(abdominal-B,Abd-B)和无翅基因(wingless,Wnt)等参与调节成虫着色模式,在此基础上,研究者发现多种多效性的因子参与调控鳞翅目昆虫黑色素合成通路(表2)。在家蚕中比较典型的是参与背腹轴形成和先天免疫的Toll信号通路,Toll-8及其配体spz3可能通过NF-κB信号通路特异性地诱导黑色素合成通路基因yellow的表达,从而沉积大量的黑色素,导致家蚕Ze突变体背节前端都有黑色斑纹,足点处有黑点。spalt和E75在柑橘凤蝶幼虫体表黑色素合成和眼点形成过程中发挥关键作用(Futahashietal.,2012)。
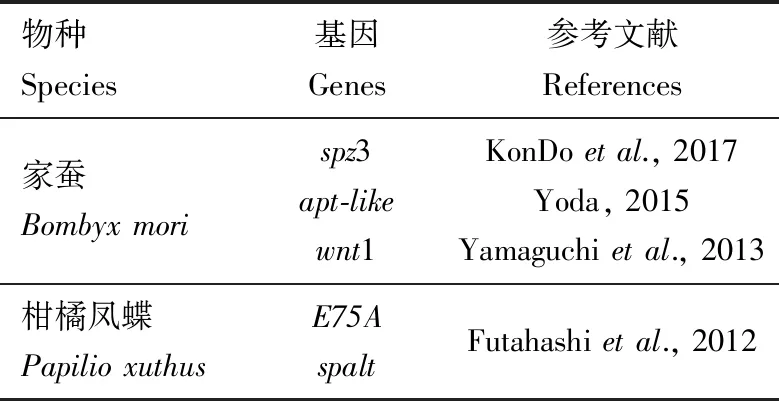
表2 已知调节黑色素合成信号通路的基因Table 2 The known genes regulating melanin synthesis pathway
凤蝶属中大多数物种的体色模式在幼体发育期间会显着改变,这些变化是固定且不可逆的。例如,在柑橘凤蝶中,1-4龄幼虫体表都显示出黑色和棕色的颜色图案,并带有白色“V”形斑块,被认为是模仿鸟粪(模仿图案)。然而,在最后龄期,它们的着色模式切换为绿色,在第3胸节(T3)上有一对假眼点,在腹节的背侧上有深绿色的“V”形标记,这种模式被认为是一种高级的反捕食者适应措施,使其可以在一定距离内隐藏于寄主植物上,从而适应最后龄期可能发生的微生境和觅食行为的潜在变化(Futahashi and Fujiwara,2008)。研究表明,柑橘凤蝶5龄幼虫的斑纹模式预形成过程是在4龄保幼激素敏感期决定的,为了筛选导致5龄幼虫颜色转变的基因,在JH敏感期的20 h内的0,6和12 h 3个时间点,分别取4龄和5龄幼虫期颜色显著改变的3个区域的样品进行RNA测序分析;利用9个RNA文库,最终筛选到20个候选基因,并且对其中的3个转录因子(cll,abd-A和Abd-B)进行功能分析(Jinetal.,2019)。结果表明,在3龄幼虫眼点区域敲低cll,4龄时没有观察到明显的表型变化,然而5龄幼虫敲低cll一侧眼点的尺寸明显变小,而且眼点附近的红色区域变得不可分辨,周围的线条变得无序。当在“V”形标记周围敲低abd-A和Abd-B基因时,在4龄幼虫期同样没有发现明显的表型变化,但是在5龄幼虫期abd-A敲低的个体中,“V”形标记完全消失,仅观察到绿色的体色。相反,在Abd-B敲低的个体中,“V”形标志没有变化,仅出现一些异常的浅黑色区域。为了更加深入地研究Abd-B的功能,在Abd-B高表达的区域进行该基因的RNA干涉实验,发现两个“V”形标志之间出现了大的异常的黑化区域。结果表明这些基因在JH敏感期和在斑纹模式预形成基因网络控制中发挥重要作用(Jinetal.,2019)。
家蚕显性突变体Ze在每个背节的前缘都有一条黑色斑纹。对3 135个幼虫的精确连锁图谱分析揭示了负责Ze位点的63 kb区域,该区域包含3个候选基因,其中包括Toll配体基因spätzle3(spz-3),研究发现只有spz-3/Toll-8参与黑色素化过程。同时,在Ze突变体的斑纹区域,yellow基因显著上调,说明spz3通过影响yellow基因的表达从而影响黑色素合成信号通路的活性。这项研究为Toll信号通路控制家蚕的黑化过程和适应性斑纹模式的形成提供了直接的证据(KonDoetal.,2017)。
5 小结与展望
昆虫体色和斑纹多样性是研究发育生物学、自然选择和形态性状进化的良好对象。生化和遗传研究表明,许多化学物质和色素合成通路参与体色的形成,其复杂的形成机制和精确的调控机制一直吸引着众多研究者的目光。通过对昆虫发育过程的研究,揭示在其进化过程中获得体色和斑纹的多态性形成机制。包括利用家蚕不同时期发生色素沉着,来研究着色模式形成的机制;通过果蝇成虫种内和种间腹部着色的差异,来研究色素沉积模式多样性的机制;利用柑橘凤蝶幼虫斑纹模式的改变,探索色素合成和沉积多样性的调节机制。但是这些研究结果还不足以使我们完全理解昆虫体色和斑纹模式形成和调节的机制。在鳞翅目昆虫中,家蚕和柑橘凤蝶因具有诸多色素沉着品系,以及完善的全基因组序列结果和高质量连锁图谱,结合成熟的基因编辑技术,非常适合作为鉴定体色和斑纹模式形成的分子机制的物种,鉴定出来大量与色素合成相关的基因,为探究昆虫表型的趋同和趋异进化的基础提供了大量的理论依据。例如,编码转录因子保守基因apt-like构成了家蚕p基因座,导致至少15种不同的幼虫斑纹模式。apt-like和黑色素合成基因的表达量在斑纹突变体Striped和正常突变体(p)的黑色区域显著上调,但在无斑纹突变体p中不表达。此外,家蚕黑色素前体物质多巴和多巴胺还与昆虫免疫等生理过程有密切的联系。当昆虫被细菌或真菌感染时,体内不仅通过Spz和Toll信号通路诱导抗菌肽的表达,还会通过前酚氧化酶通路产生黑化(Takahashietal.,2015;Wang and Jiang,2017)。尽管NF-κB因子在幼虫色素沉着中的作用尚不清楚,但是Toll通路确实参与黑色素形成(KonDoetal.,2017)。值得注意的是,Lac-2参与家蚕幼虫色素沉着,而酚氧化酶参与先天免疫的黑化过程,尽管两者在结构上是不同的,但是显示相同的酶活性。因此,有关幼虫色素沉着和先天免疫的其他比较研究可能会揭示黑色素合成更加精确的信号通路,同时有助于解析昆虫免疫信号的网络。
此外,随着对鳞翅目昆虫着色的分子机制的深入研究,更多的疑问也随之产生。例如,色素合成相关的基因在不同物种中发挥的作用是否相同呢?与柑橘凤蝶色素合成相关的基因以时期特异性的模式发挥作用,而果蝇的成年腹部标记被相关基因以标记特异性方式调控。成虫果蝇腹部黑色斑点的色素分布主要受yellow和tan的调控;柑橘凤蝶和家蚕的时期特异性的斑点形成需要TH和DDC的共表达,但是TH和DDC在果蝇中几乎不发挥功能;此外,ebony和tan的表达也具有物种差异性。即使同属鳞翅目,相同基因发挥的功能也有差异,比如GTPCHI和柑橘凤蝶幼虫表皮斑纹的形成有关,而在家蚕中没有发现类似功能。分析色素合成的调控机制发现,保幼激素和蜕皮激素及其下游的转录因子在鳞翅目昆虫着色过程中发挥重要作用;HOX基因Abd-B和色素合成基因共同作用,影响果蝇种间和种内的体色和斑纹模式(Jeongetal.,2006);柑橘凤蝶5龄幼虫期着色模式的改变除受Abd-B的调控以外,还受同属HOX基因的clawless和abdominal-A的影响。这些结果说明果蝇与鳞翅目昆虫着色形成和调节机制相似,但是不完全相同。相信随着鳞翅目昆虫众多体色和斑纹形成机制的解析,昆虫色素调控网络也会取得更多突破。
