离子液体-环己烷(乙醇)二元体系气液相平衡研究
2020-12-11李宏辉李文秀张志刚
李宏辉, 李文秀, 张志刚, 张 弢
(沈阳化工大学 化学工程学院, 辽宁 沈阳 110142)
环己烷和乙醇是重要的化学溶剂,它们的混合物广泛存在于化学工程等许多领域[1-2].常压下,环己烷与乙醇以共沸物的形式存在(环己烷和乙醇摩尔分数分别为55 %和45 %),使用普通精馏的分离方法很难从其废弃混合物中回收出环己烷、乙醇.所以对于共沸物的分离采用萃取精馏[3]方法.萃取精馏是一种用于共沸或近沸混合物分离的高效技术,其具有选择灵活、分离效率高、操作方便等优点.萃取精馏至关重要的步骤是选择高效的萃取剂,相对于有机溶剂[4]和固体盐[5]等传统萃取剂,离子液体具有易回收、对环境无污染、能量消耗较低等优点[6-7].近年来,离子液体卒取剂被广泛应用于共沸物系卒取精馏分离的研究[8-9].
气液平衡数据是精馏设计的基础.Lepori等[10]对含有传统萃取剂的环己烷-乙醇体系的三元VLE数据进行了研究.Harris等发现,以单乙醇胺(MEA)为夹带剂,通过萃取精馏和萃取[11]相结合,可以得到纯环己烷和纯乙醇.Wang等以离子液体(1-丁基-3-甲基咪唑氯盐)为萃取剂进行萃取精馏,并对分离乙醇-环己烷混合物的操作条件进行了优化,最终使得环己烷和乙醇的回收率分别超过99.8 %和99.9 %[12].而Fang等采用基于COSMO-SAC理论的分子设计方法对离子进行设计,最终选用3个以氯离子为基础阴离子的离子液体为萃取剂分离环己烷-乙醇,并对含离子液体的三元系统气液相平衡数据使用威尔逊模型(Wilson)[13]进行了关联,这3种离子液体展现出的分离能力为[BMIM]Cl>[OMIM]Cl >[BDMIM]Cl.
本文测量了常压环境不同离子液体[甲基三辛基醋酸铵([N1,8,8,8][Ac])、1-癸基-3-甲基咪唑醋酸铵([DMIM][Ac])和1-十六烷基-3-甲基咪唑醋酸铵([C16MIM][Ac])]存在下的环己烷、乙醇的二元气液相平衡实验数据,并使用NRTL和Wilson模型对6组二元系统的等压气液相平衡(VLE) 数据进行了关联,获得不同离子液体与共沸组分(环己烷或乙醇)之间的二元能量交互参数.根据两个模型的拟合结果,对比得出更加适合的活度系数模型.
1 实验部分
1.1 化学试剂与实验仪器
实验所用化学试剂和仪器如表 1 和表2所示.

表1 化学试剂

表2 实验仪器
1.2 实验过程
气液相平衡数据在CE-2型全玻璃动力循环气液平衡釜[14]中进行测量.压力采用不确定度0.1 kPa的压力计(TDGC2-0.5 CHNT)测得,通过控制气体缓冲器使压力恒定在101.3 kPa.平衡温度用一个精确校准的温度计确定,标准不确定度为0.01 K.VLE实验样品的制备方法采用数字天平(CAV264C OHAUS)称重,标准不确定度为0.000 1 g.将离子液体和共沸组成加入到气液平衡釜中进行加热,观察温度变化,若沸腾后温度保持不变,需要恒定30 min左右并且观察到气相冷凝液流下速度在1~2滴/s,则釜内气液相达到平衡,进行取样分析.
1.3 样品分析
气液平衡室将蒸汽与液体分离,在球形冷凝器中冷凝.从气相采样点和液相采样点分别进行采样,未取样的冷凝蒸汽被回流到气液平衡室.环己烷+乙醇二元体系的每个实验点均从纯环己烷的初始样品中得到,在环己烷的初始样品中加入不同数量的乙醇,使环己烷的摩尔分数从1减小到0.02.对于离子液体+环己烷和离子液体+乙醇二元系统,环己烷或者乙醇作为初始样品放在平衡釜内,离子液体不断添加到平衡釜中测量得到实验数据.
实验采用的顶空进样器为HS-9,气相色谱仪为安捷伦GC7890A,与安捷伦GC7890A型号色谱相匹配的检测器为火焰离子检测器(flame ionization detector,FID),色谱柱为石英毛细管柱SP-1000,其中柱长30 m,直径2.5 mm,膜厚2.5 μm[15];为了可以把两物质的峰面积清晰分开,设置合适的温度值,其中柱温设置为338 K,进样口温度设置为423 K,检测器温度设置为443K.由于混合组分中离子液体不挥发,在色谱中不出现峰面积,所以气液相组分中只含有易挥发性组分环己烷或者乙醇得到分析峰面积,离子液体含量采用烘干箱烘干易挥发组分后(2 kPa,110 ℃,48 h)得到,采用色谱分析环己烷和乙醇含量比例,用称重法称量干燥前后两者质量之差求出离子液体的液相组成.
2 结果与讨论
2.1 实验数据
对于气液相平衡实验,实验用装置的可靠性对最终获得的实验数据的精确度和准确性具有至关重要作用.为验证实验装置的可靠性,采用环己烷-乙醇的二元气液相平衡实验数据对装置进行验证,并将测定的环己烷-乙醇的实验数据与已报道的两篇文献值进行对比,结果如图1所示,可以说明该平衡釜所测数据与已报道的文献数据[16-17]具有良好的一致性.因此,该相平衡釜具有一定的可靠性,可用于后续的相平衡实验研究.
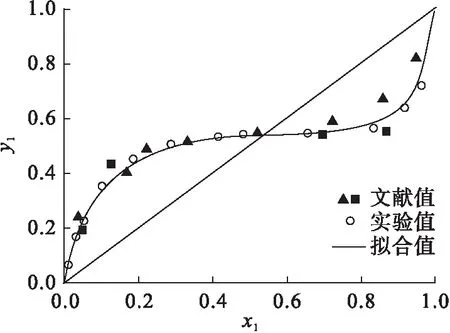
图1 101.3 kPa 下的环己烷+乙醇二元等压气液相平衡
通过上述实验方法得到环己烷(1)+[N1,8,8,8][Ac](3)、环己烷(1)+[DMIM][Ac](3)、环己烷(1)+[C16MIM][Ac](3)、乙醇(2)+[N1,8,8,8][Ac](3)、乙醇(2)+[DMIM][Ac](3)以及乙醇(2)+[C16MIM][Ac](3)的二元相平衡数据.结果如表3~表5所示.
在表3~表5中:w1,w2,w3分别表示环己烷(1)、乙醇(2)、离子液体(3)在体系液相组成中的质量分数;γi[18]表示组分i在体系中的活度系数,表达式为
(1)

(2)

(3)
式中,环己烷和乙醇纯组分的安托因参数A、B、C来自于文献[13].

表3 101.3 kPa下环己烷(1)+[N1,8,8,8][Ac](3)和乙醇(2)+[N1,8,8,8][Ac](3)的二元气液相平衡数据

表4 101.3 kPa下环己烷(1)+[DMIM][Ac](3)和乙醇(2)+[DMIM][Ac](3)的二元气液相平衡数据

表5 101.3 kPa下环己烷(1)+[C16MIM][Ac](3)和乙醇(2)+[C16MIM][Ac](3)的二元气液相平衡数据
活度系数的大小通常可以反映出实际物系系统与理想物系系统的偏差程度[20],理想物系体系的活度系数可以认为是1.因此可以用活度系数来表示离子液体与共沸组成之间的相互作用.不同离子液体与环己烷以及不同离子液体与乙醇二元体系的活度系数如表3~表5所示,可以得出:从活度系数值变化分析,同一种离子液体对于不同的共沸组成产生的作用不同;离子液体含量的增大,体系的温度呈现升高趋势;对于环己烷+离子液体二元体系,离子液体对环己烷有促进气化的作用,活度系数越大,气化促进作用越强,越有利于环己烷挥发;对于乙醇+离子液体二元体系,离子液体与乙醇分子主要以形成氢键为主,彼此之间产生吸引力,使其难以在液相中挥发出去.
2.2 相平衡计算
实验数据计算采用两个热力学模型:非随机双液相(NRTL)活度系数模型[21]和Wilson模型[22].
(1) NRTL方程:

(4)
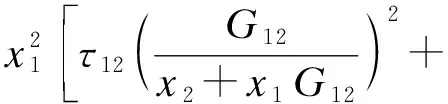
(5)
其中:
G12=exp(-α12τ12);
G21=exp(-α21τ21).
上述NRTL方程每一对二元体系都有3个可调参数即(gij-gjj)、(gji-gii)和αij(αij=αji).实验中,环己烷+离子液体和乙醇+离子液体的数值可用二元气液平衡数据通过非线性回归方式得到.
(2) Wilson方程:
lnγ1=1-ln(x1+A12x2)+
(6)
lnγ2=1-ln(x2+A21x1)+
(7)
其中:
上述Wilson方程可调参数为Aij和Aji.vi为i组分在实验条件下的摩尔体积.环己烷+离子液体和乙醇+离子液体的二元相平衡实验数据可采用以上方程进行回归得到相应模型的计算值.将回归结果和实验测量值绘制成图,如图2~图4所示.其中:横坐标x3代表离子液体在相平衡的液相组成中所占的摩尔分数.
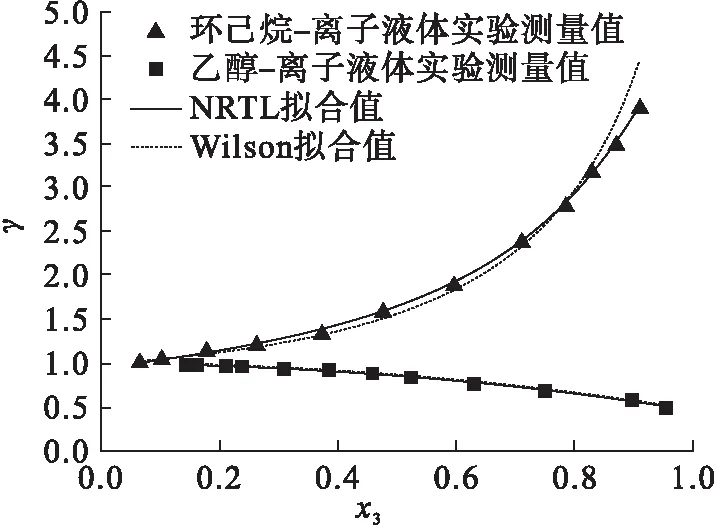
图2 环己烷(乙醇)+[N1,8,8,8][Ac]二元体系的x3-γ图

图3 环己烷(乙醇)+[DMIM][Ac]二元体系的x3-γ图

图4 环己烷(乙醇)+[C16MIM][Ac]二元体系的x3-γ图
对NRTL 模型和Wilson模型关联的计算值与实验值,使用平均相对偏差ARD(%)最小来得到环己烷-离子液体、乙醇-离子液体的二元作用参数,其ARD(%)表达公式[23]为

(8)


表6 NRTL模型中组分之间的二元能量交互参

表7 Wilson模型中模型参数
2.3 误差分析
从表6和表7的模型参数结果分析两个模型的拟合效果,为定量分析以及合理评价NRTL模型和Wilson模型,对以上两个模型拟合结果进行平均相对偏差计算,计算结果如表8所示.

表8 NRTL模型和Wilson模型的平均相对偏差比较
表8列出了离子液体与共沸组成二元体系的活度系数实验值与两个模型拟合值之间的平均相对偏差.对含有不同离子液体的二元气液相平衡实验数据拟合结果进行分析,可以得出NRTL模型与Wilson模型相比较,NRTL模型具有更小的相对偏差,实验数据和计算数据更加接近,可以用于含离子液体体系的数据拟合处理,在今后进一步进行多元气液相平衡实验数据的预测模型中使用.
3 结 论
实验过程中测量了常压环境下(101.3 kPa)含不同的离子液体:环己烷(1)+离子液体(3)和乙醇(2)+离子液体(3)的二元气液相平衡实验数据,从实验结果可以看出离子液体的加入有利于环己烷的挥发,但是与乙醇形成氢键,难以挥发,表明离子液体加入环己烷与乙醇二元体系,有助于他们的分离,分离效果需要结合离子液体+环己烷+乙醇实验测定结果进行分析.从关联结果来看,NRTL模型和Wilson模型拟合结果与实验数据均具有良好的一致性,相比之下,NRTL模型比Wilson模型更加吻合,更适合含离子液体的相平衡数据分析.
符号说明:
x—液相;
y—气相;
T—平衡温度,K;
A—Wilson模型参数;
Δg—NRTL方程交互作用参数,J·mol-1.
上角标:
exptl—实验值;
calcal—计算值.
下角标:
1—环己烷;
2—乙醇;
3—离子液体;
i,j—组分变量.
