大亚湾养殖鱼类寄生车轮虫的种类组成与季节动态
2020-12-10杨宇晴张海发丁雪娟
陈 鹏 张 咏 刘 苏 杨宇晴 袁 凯 张海发 丁雪娟
(1. 华南师范大学生命科学学院, 广州市亚热带生物多样性与环境生物监测重点实验室, 广东省水产健康安全养殖重点实验室, 广州 510631; 2. 广东省海洋渔业试验中心, 惠州 516081)
车轮虫(Trichodinid)隶属于纤毛门寡膜纲游走目车轮虫科(Trichodinidae Claus, 1874), 是一类具有附着盘结构、可自由运动的纤毛虫, 广泛寄生或共栖生于淡海水鱼类的鳃及体表, 是水产养殖(尤其是高密度养殖)中常见且危害较大的一类纤毛虫,车轮虫的寄生可导致宿主严重的组织病变, 造成经济损失[1—3]。因此对鱼类寄生车轮虫的调查研究既有理论意义, 又有应用价值。
全球已发现10属近400种车轮虫, 我国记录有5属约80种, 其中淡水车轮虫50余种, 主要采自四川、重庆、湖北等内陆地区[4—7]; 海水车轮虫20余种, 主要分布于黄渤海海域[8,9], 南海仅见王文强等[10]报道的寄生于海南三亚海区野生鱼类的4个种。车轮虫的相关研究主要集中在分类学上, 生态学方面的研究报道较少[11,12]。大亚湾位于广东省东南, 是广东省沿岸最大的海湾之一, 也是全省唯一的水产资源自然保护区, 湾内面积约600 km2, 自然环境优越、生物资源丰富, 为华南重要渔场之一[13]。已有学者对大亚湾鱼类寄生黏抱子虫、单殖吸虫、复殖吸虫和甲壳动物等进行了调查研究[14—17], 但车轮虫的相关研究空缺。本文首次对大亚湾主要养殖鱼类寄生车轮虫进行了调查研究, 以期探明该海区车轮虫的种类组成, 揭示相关车轮虫的种群季节动态, 填补该海区鱼类寄生车轮虫研究的空缺, 为海水养殖鱼类车轮虫病的诊断及防控提供科学参考。
1 材料与方法
2017年8月至2018年7月对大亚湾养殖的8种经济鱼类鳃寄生车轮虫进行了为期一年的调查研究。调查的宿主鱼包括: 卵形鲳鲹(Trachinotus ovatus)、眼斑拟石首鱼(Sciaenops ocellatus)、黑鲷(Sparus macrocephalus)、星点笛鲷(Lutjanus stella-tus)、大西洋鲷(Sparus aurata)、斜带髭鲷(Hapalogenys nitens)、鞍带石斑鱼(Epinephelus lanceolatus)和虎龙杂交斑(E. fuscoguttatus(♀) ×E. lanceolatus(♂), Hulong grouper), 其中鞍带石斑鱼和虎龙杂交斑取自广东省海洋渔业试验中心(22.71°N, 114.54°E)的室内养殖池, 其余6种鱼则取自3 km外的养殖网箱。每月采样1次, 每次每种鱼各取5尾, 鱼的体长与体重信息见表 1(括号外为平均值, 括号内为量度变化范围), 解剖后取鳃进行湿涂片(每一鳃片涂一张片), 同时测量水体的水温及pH。
采用干银法对空干的鳃涂片进行染色制片: 在3%硝酸银溶液中浸泡150s, 流水冲洗5s, 45℃烘干后于50W白炽灯下曝光120s, 再加显影剂显影20s,流水冲洗5s, 95%酒精脱水120s, 45℃烘干后用中性树胶封片。随后在光学显微镜(Olympus BX51)下观察、拍照。形态学数据的测量依Lom[18]所倡导的统一特定方法进行, 数据统计模式为: Min-Max(Mean±SD), 即最小值-最大值(算术平均值±标准差)。齿体定位图借助Adobe Photoshop CS6完成,并采用Van As和Basson[19]提出和唐发辉等[6]修正的方法进行齿体定位描述; 种群周年动态数据整理及统计分析借助Excel和SPASS20.0软件进行。寄生车轮虫的感染率(Prevalence)与平均感染强度(Mean intensity)等的统计依Bush等[20]。
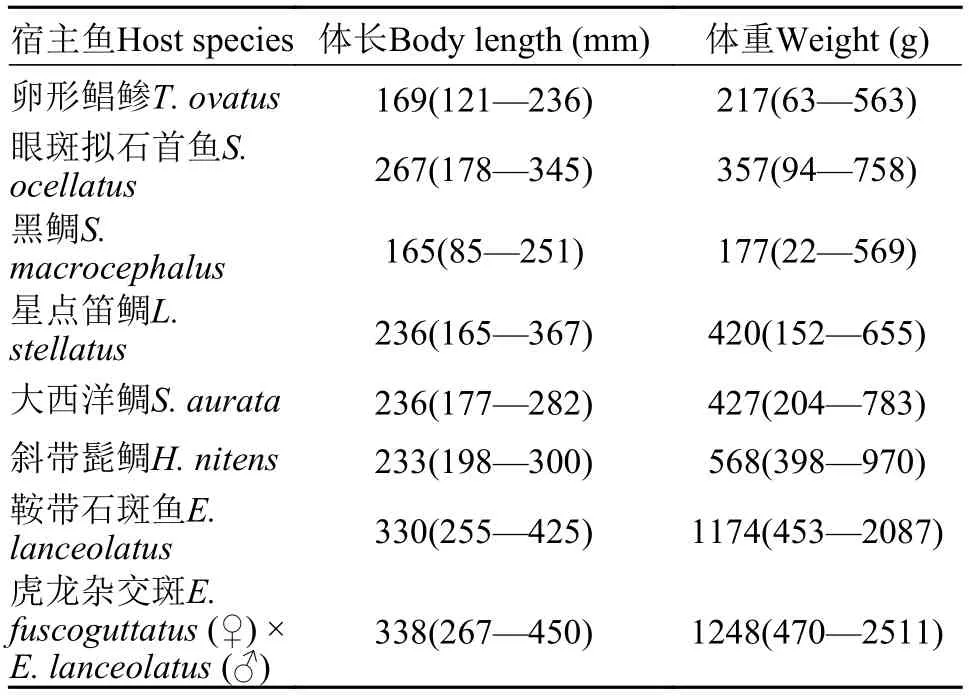
表 1 宿主鱼体长和体重信息Tab. 1 The body length and weight of host fishes
2 结果与讨论
2.1 种类组成与形态特征
本调查共检获车轮虫5种, 描述如下。
亚卓车轮虫Trichodina jadranica(Raabe, 1958)Lom & Laird, 1969(表 2、图 1A和1B、图2A)
宿主: 卵形鲳鲹, 虎龙杂交斑, 鞍带石斑鱼。
该虫为中、大型车轮虫; 附着盘中央具有一个大且圆的颗粒; 齿钩近半月型, 其外切缘平滑略高于骨突, 骨突圆钝, 齿钩后缘平滑且弯曲, 齿钩前缘平滑, 不及Y+1轴, 齿钩凸点不及Y+1轴, 与齿钩凹点在同一水平上, 无钩突及后突起; 齿钩连接粗壮, 齿锥较发达, 齿锥顶点钝圆, 未到达Y轴至Y-1轴距离的一半, 齿锥间嵌合紧密; 齿棘短且粗, 整体平直, 无棘突。
该种在亚洲、欧洲、非洲和澳洲均有分布, 宿主范围广, 能适应海、淡水环境[21]。我国黄渤海海域的牙鲆(Paralichthys oblivaceus)、石蝶(Kareius bicoloratus)和红鳍东方鲀(Takifugu rubripes)上有寄生该虫的记录[22,23]。在不同的宿主和生境中, 种群的齿体形态有一定差异, 但均具该种明显的鉴别特征, 即附着盘中央有一大而圆的颗粒。
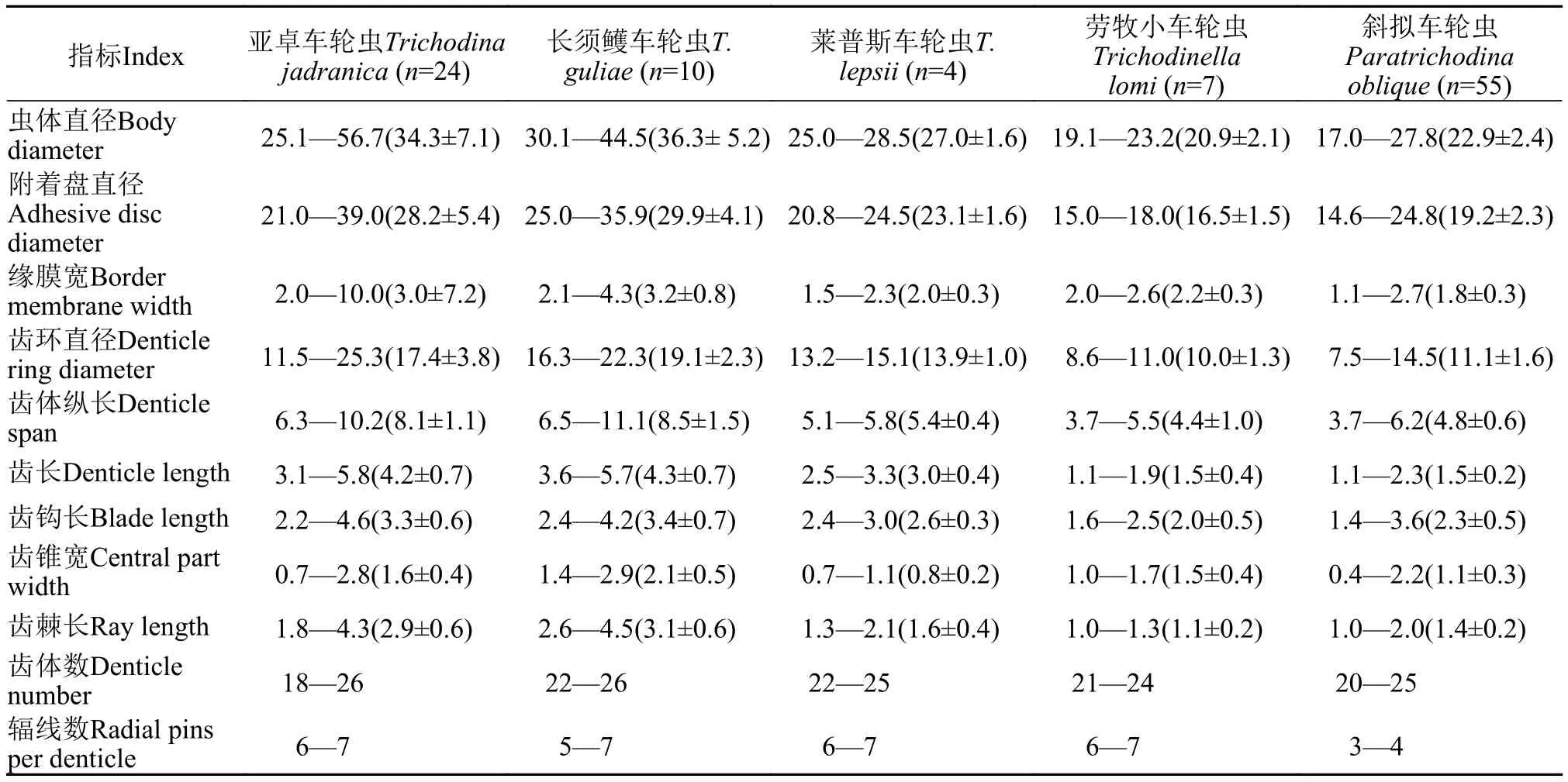
表 2 大亚湾五种车轮虫的形态学数据比较Tab. 2 Morphometric comparison of five trichodinids from Daya Bay (μm)
长须鳠车轮虫Trichodina guliaeAsmat, 2006(表 2、图 1C、图 2B)
宿主: 卵形鲳鲹, 虎龙杂交斑。
该虫为中型车轮虫; 附着盘中央具一个圆形颗粒; 齿钩近半圆形, 齿钩外切缘圆滑, 骨突略尖锐且低于外切缘, 齿钩后缘略弯曲, 齿钩前缘平滑, 齿钩凸点几乎接触Y+1轴, 且与齿钩凹点位于同一水平线上, 无钩突及后突起; 齿钩连接较纤细, 齿锥发达, 齿锥顶点钝圆, 到达Y轴至Y–1轴距离的一半,齿锥间嵌合紧密, X轴上下锥形不相似; 齿棘细长,整体略向前倾斜, 无棘突。
Asmat等[24]在孟加拉国的长须鳠(Mystus gulio)上首次发现该虫, 鉴别特征为近半月形的齿钩、近三角形的齿锥及末端膨大的齿棘。大亚湾种群除虫体直径、缘膜宽及齿棘长比原始描述略小外, 其他形态学数据与原始描述吻合。卵形鲳鲹、虎龙杂交斑为该虫的宿主新记录。
莱普斯车轮虫Trichodina lepsiiLom, 1962(表 2、图 1D和1E、图 2C)
宿主: 卵形鲳鲹, 虎龙杂交斑, 星点笛鲷。
该虫为中型车轮虫; 附着盘中央无明显颗粒;齿钩近平行四边形, 齿钩外切缘平滑, 骨突圆钝且与外切缘水平, 齿钩前缘和后缘均平直, 且两者近乎平行, 齿钩凸点几近接触Y+1轴, 且与齿钩凹点位于同一水平线上, 无钩突及后突起; 齿钩连接和齿锥均较纤细, 齿锥欠发达, 其顶点尖锐, 未到达Y轴至Y–1轴距离的一半, 齿锥间嵌合紧密; 齿棘短粗, 略有弯曲且向前倾斜, 齿棘顶点超过Y轴至Y+1轴距离的一半, 无棘突。

图 1 五种车轮虫的银染标本显微照片Fig. 1 Photomicrographs of silver impregnated adhesive disc of five trichodinids
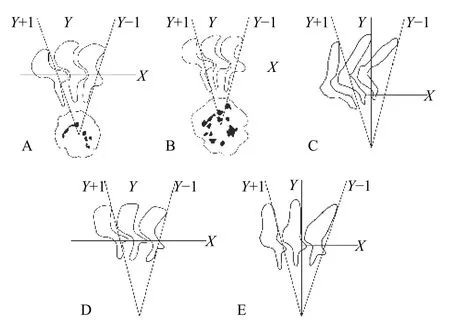
图 2 五种车轮虫的齿体定位图Fig. 2 Diagrammatic representations of the denticles of five trichodinids
该虫已记录的宿主多为鯔类, 如Mugil auratus、M. platanus、M. cephalus等, 并常与浦氏车轮虫(T. puytoraci)混合感染[25,26]。本研究为该虫在亚洲的首次记录, 其缘膜宽、齿体数和齿体纵长比原始描述略小, 其他形态学数据吻合。大亚湾的种群主要寄生在卵形鲳鲹和虎龙杂交斑上, 星点笛鲷上也有少量寄生, 卵形鲳鲹上该虫与其他4种车轮虫混合感染。
劳牧小车轮虫Trichodinella lomiXu, Song &Warren, 1999(表 2、图 1F、图 2D)
宿主: 卵形鲳鲹, 星点笛鲷, 眼斑拟石首鱼。
该虫为小型车轮虫; 附着盘中央无明显颗粒;齿钩发达, 呈狭长棒状齿钩整体明显向后倾斜且超过Y+1轴, 骨突钝圆, 齿钩前后缘均平直, 偶见钩突,无后突起; 齿钩连接纤细且难与齿锥相区分; 齿锥不发达, 齿锥顶点钝圆且未及Y轴, 齿锥间嵌合略疏松; 齿棘多数缺失。
该虫为我国海水养殖真鲷(Pagrosomus major)和鲈(Lateolabrax japonicus)的常见寄生虫, 并常与日本车轮虫(Trichodinajaponica)、直钩车轮虫(T.rectuncinata)、杜氏车轮虫(T. domerguei)和简单两分虫(Dipartiella simplex)等混合感染[22]。大亚湾卵形鲳鲹上的劳牧小车轮虫种群与长须鳠车轮虫、莱普斯车轮虫、亚卓车轮虫和斜拟车轮虫混合感染, 其虫体直径和附着盘直径比原始描述略小, 能看到很短的齿棘, 其他形态学数据与原始描述吻合。
斜拟车轮虫Paratrichodina obliqueLom, 1963(表 2、图 1G—I、图 2E)
宿主: 卵形鲳鲹, 虎龙杂交斑, 星点笛鲷, 眼斑拟石首鱼。
该虫为小型车轮虫; 附着盘中央无明显颗粒;齿钩近三角形, 齿钩外切缘平直, 骨突圆钝, 齿钩前缘平直, 后缘略弯曲, 齿钩凸点略低于齿钩凹点, 少数具有钩突; 齿钩连接粗壮, 与齿锥难以区分, 齿锥发达, 齿锥顶点钝圆, 略超过Y轴, 齿锥间嵌合疏松;齿棘相对纤细且整体平直, 齿棘顶点较钝, 无棘突。
大亚湾的斜拟车轮虫种群, 除附着盘直径和齿钩长较小、齿环直径和齿体数较大外, 其他形态学数据与原始描述吻合, 也与Grupcheva等[27]在地中海竹荚鱼(Trachurus mediterraneus)和保加利亚的宽吻海龙(Syngnathus typhle)及徐奎栋等[22]在黄海的牙鲆上采获的种群一致。
2.2 种群季节动态
在检测的8种鱼中, 有5种鱼感染了车轮虫, 分别为: 卵形鲳鲹、虎龙杂交斑、鞍带石斑鱼、星点笛鲷和眼斑拟石首鱼, 而黑鲷、大西洋鲷和斜带髭鲷上未检出车轮虫。共检获5种车轮虫。从周年感染情况看, 卵形鲳鲹5种虫均有感染, 且5种虫的感染率均是卵形鲳鲹的最高(10%—30%), 眼斑拟石首鱼上2种虫的感染率最低(1.67%, 表 2和表 3); 平均感染强度最高的是斜拟车轮虫(70.5), 随后依次是亚卓车轮虫(35.5)、劳牧小车轮虫(33.8)、长须鳠车轮虫(22.8)和莱普斯车轮虫(20)。从季节动态看, 莱普斯车轮虫感染率及平均感染强度的峰值出现在冬季, 其余4种虫冬季的感染率均显著低于其他季节, 斜拟车轮虫、亚卓车轮虫的平均感染强度在秋季达最高峰, 长须鳠车轮虫和劳牧小车轮虫的分别为春季和夏季(表 4)。卵形鲳鲹上5种车轮虫的感染率均为冬季最低, 平均感染强度除劳牧小车轮虫外也是冬季最低(表 5), 其中斜拟车轮虫春夏秋季的平均感染强度均高于其他4种, 感染高峰出现在秋季。
有研究表明温度是影响车轮虫种群季节变动的重要因素, 且不同虫种对温度的敏感性不一[12,28—31]。本研究显示大亚湾海区养殖鱼类寄生的5种车轮虫,除莱普斯车轮虫外, 4种虫的感染率和平均感染强度都与温度呈正相关关系。感染高峰出现在水温较高的季节, 亦是鱼类生长的旺季。而车轮虫的大量寄生可导致宿主的组织病变, 引起养殖鱼类特别是鱼苗鱼种发病死亡, 造成经济损失[2,3]。在今后大亚湾海区的鱼类养殖过程中, 需加强寄生车轮虫病的监测及预防。

表 3 大亚湾养殖鱼类寄生车轮虫周年感染情况Tab. 3 The annual infection of trichodinids in gills of farmed fish in Daya Bay
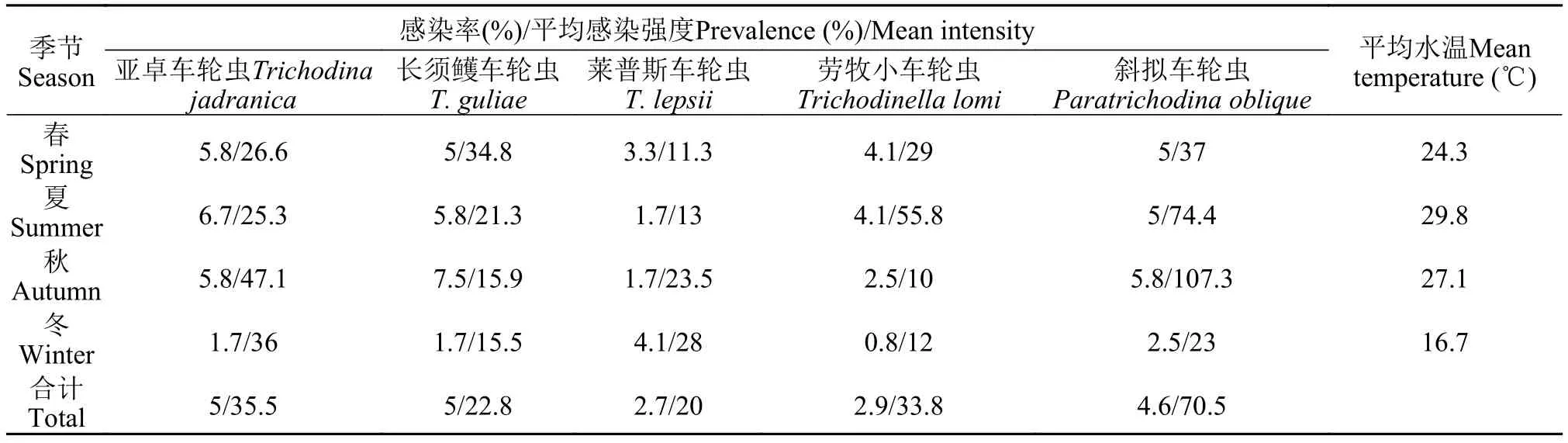
表 4 大亚湾五种车轮虫感染的季节动态Tab. 4 Seasonal dynamics of five trichodinids infection in Daya Bay
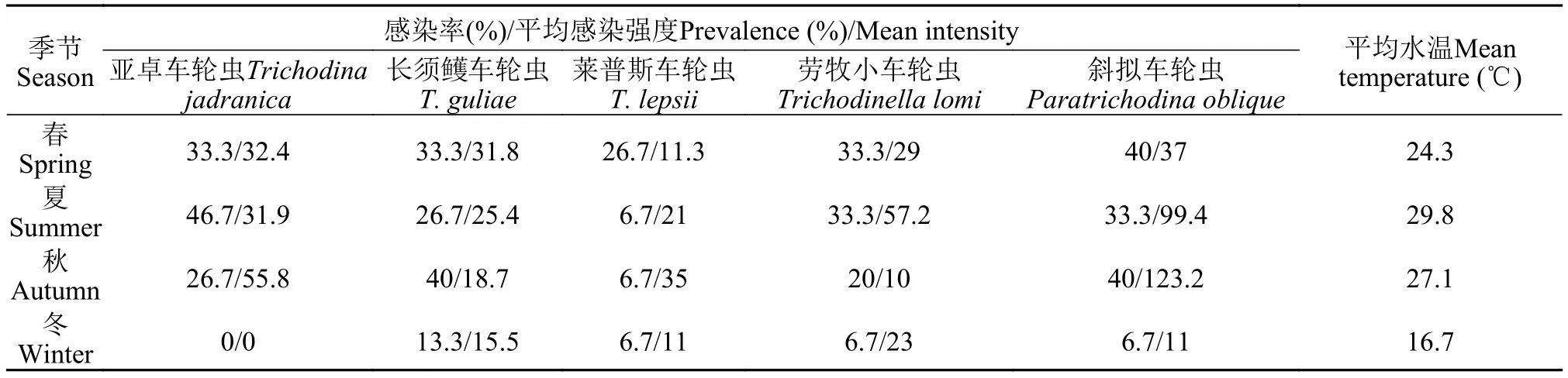
表 5 卵形鲳鯵上五种车轮虫的季节动态Tab. 5 Seasonal dynamics of five trichodinids from the host fish Trachinotus ovatus
致谢:
感谢华南师范大学生命科学学院动物学专业研究生李有智、王琳和朱培炜协助采集标本。
