福建省3例输入性卵形疟的实验诊断分析
2015-11-20林耀莹张山鹰杨发柱谢汉国欧阳榕陈朱云
林耀莹,张山鹰,杨发柱,谢汉国,欧阳榕,陈朱云
卵形疟最早是1900年Charles F.Craig发现,1922年Stephens从一个非洲回英国的士兵血液里被感染的红细胞中发现,并正式命名[1]。卵形疟主要流行于西非、菲律宾、印尼东部和巴布亚新几内亚[2],孟加拉、柬埔寨、印度、泰国和越南也有报道。全球每年大约有1 500万卵形疟感染,在西非疟疾病例中卵形疟超过10%。卵形疟通过基因方法分为两个亚种—卵形疟curtisi和卵形疟wallikeri[3-4],两个亚种的谱系分离各自发生在100万和350万年前[5]。Calderaro A 等报道[1],流行病学和生物学的调查发现,卵形疟与间日疟形态相似,虫种密度低,只引起密度相对低的虫血症,即使实在首发感染,虫密度峰值也低于10 000/μL。随着前往卵形疟流行地区回国人员的增加以及疟疾检测技术的不断完善,偶尔会发现卵形疟病例和形态难以区分的混合感染,甚至是其少见的变异亚种,因此需加强镜检技术培训,并结合PCR等联合诊断,提高检出率。
1 材料与方法
1.1 样本收集 收集3例输入性可疑卵形疟病人(编号分别为FJ1、FJ2、FJ3)的血片以及滤纸血样本。镜检以吉氏染色为准,Whatman903滤纸采集末梢全血,留取直径为1cm滤纸血3滴,干燥后保存在-20。C冰箱。
1.2 病例 FJ1吉林省人,在石狮做生意,2010年12前往加纳,2011年10月25日回国,10月22日在外期间已出现发冷发热症状,10月28日就诊福州市传染病院。FJ2建瓯人,2010年6月前往加纳,2010年8月初回国,8月22日出现发热等症状,8月25日就诊福州市传染病院。FJ3福清人,2009年5月前往尼日利亚,2010年1月回国,此后未离开过福建省,2010年7月21日出现发冷发热等症状,病人自述每日发热,在当地中医院按中暑治疗后稍好转,8月12日再次出现发冷发热症状,8.17就诊福州市传染病院。3例我中心疟疾实验室镜检初步诊断都为间日疟感染,当年未做PCR确诊,但留有血片和滤纸血。
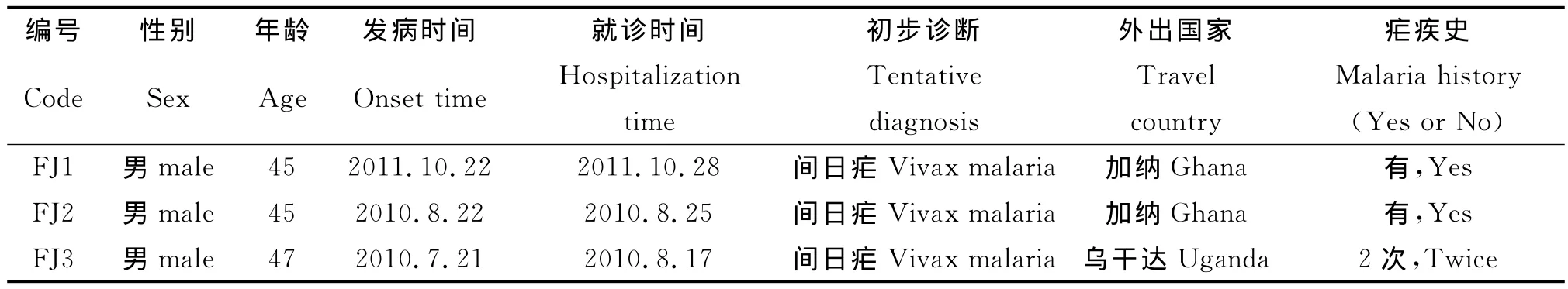
表1 3例病例流行病学史基本资料Tab.1 Epidemiological information of three cases in this study
1.3 DNA提取 根据德国Qiagen的QIAamp DNA Mini kit(250)试剂盒,提取3份滤纸血样本的DNA,-20。C保存。
1.4 套式PCR扩增 参考18SSUrRNA片段[6]进行套式PCR扩增,第1次扩增是通过疟原虫属特异性引物(rPLU6、rPLU5,表2)扩增产物,长度为1 200bp,第2次扩增4种疟原虫P.vivax,P.falciparum,P.malariae,P.ovalecurtisi的种特异产物 (rFAL1、rFAL2,rVIV1、rVIV2,rMAL1、rMAL2,rOVA1、rOVA2,表3),四种疟原虫的预期扩增片段长度分别是120bp,205bp,144bp,800 bp。
第1轮扩增:20μL反应体系中包括模板DNA3.0μL,0.5μL Taq聚合酶(5U/μL),各1.0 μL属 特 异 性 引 物 (10μmol/L),0.4μL dNTPs(10mmol/L),2.0μL 10×Buffer,2.0μL Mg2+(25 mmol/L)。扩增条件:94。C变性3min;94。C变性30s,55。C退火30s,72。C延伸1min,共扩增34个循环;72。C延伸5min。
第2轮扩增:20μL体系中包括第1轮扩增产物2.0μL,0.5μL Taq聚合酶(5U/μL),各1.0μL 4对种特异性引物上、下游引物(10μmol/L),0.4μL dNTPs(10mmol/L),2.0μL 10×Buffer,2.0μL Mg2+(25mmol/L)。扩增条件与第1轮相同。
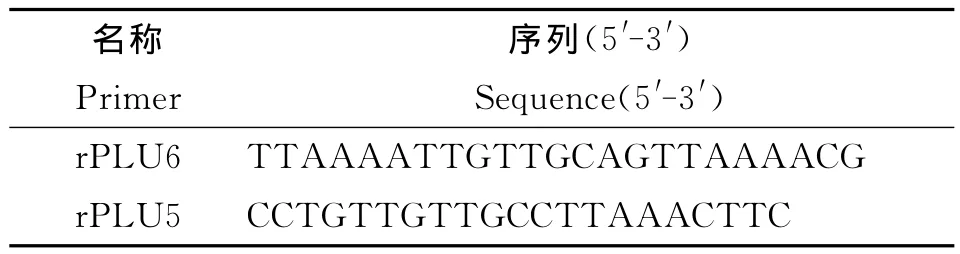
表2 属特异性引物Tab.2 Generic specific primers
1.4 产物电泳 取5μL扩增产物,与2μL的上样缓冲液混匀后,加样于2%琼脂糖凝胶(含溴化乙锭5μg/mL)电泳,80V电泳约30min,凝胶分析仪进行观察和分析。

表3 4对种特异性引物Tab.3 Four couples of specific primers
2 结 果
2.1 镜检
2.1.1 样本FJ1 在图1A中可见较为典型的卵形疟原虫滋养体,胞浆不规则,未见寄生红细胞胀大,但仍可见稍不明显的锯齿形;图1B可见卵形疟原虫裂殖体,且有12个左右的裂殖子不规则分布,颗粒呈深棕色;图1C可见一个红细胞中含有两个环状体,可能为恶性疟原虫环状体,由于未见恶性疟配子体,故很难确定,需要进一步基因分析诊断(图A、C为薄血膜,B图为厚血膜)
2.1.2 样本FJ2 图2可见典型的卵形疟原虫滋养体,寄生红细胞胀大,空泡、薛氏点清晰明显,疟色素呈棕黄色,散在胞浆分布;图E小配子体,呈圆形,疟色素均匀明显,寄生红细胞未胀大,可见均匀散在薛氏点。镜下整体红细胞锯齿状不明显,有散在环状体出现,但数量不多,制片质量差,杂质多,摄影设备较落后等原因,故未列出图片(图为薄血膜)
2.1.3 样本FJ3 图3可见典型的卵形疟原虫滋养体,寄生红细胞变大,锯齿状十分明显,疟色素颗粒清晰可见。图G为卵形疟原虫雄配子体,呈卵圆形,核疏松偏一侧,胞浆深蓝色,疟色素棕黄色偏暗,在胞浆上散在分布。样本未见其它时期形态(薄血膜)
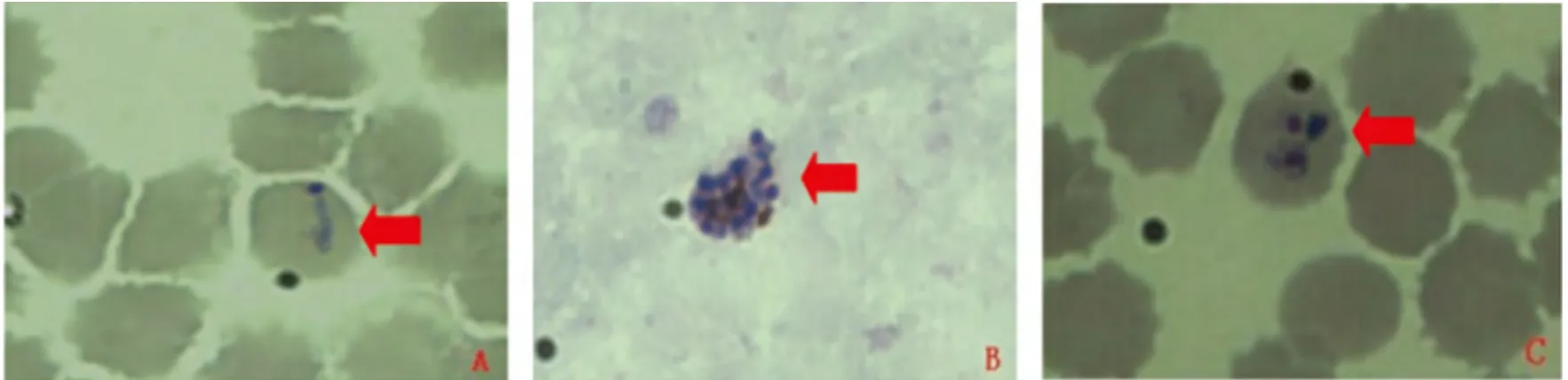
图1 镜下卵形疟原虫形态Fig.1 Morphology of P.ovalein microscope
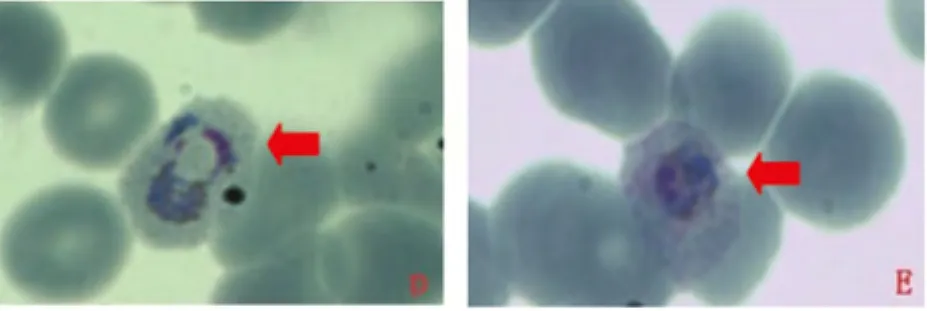
图2 镜下卵形疟原虫形态Fig.2 Morphology of P.ovalein microscope
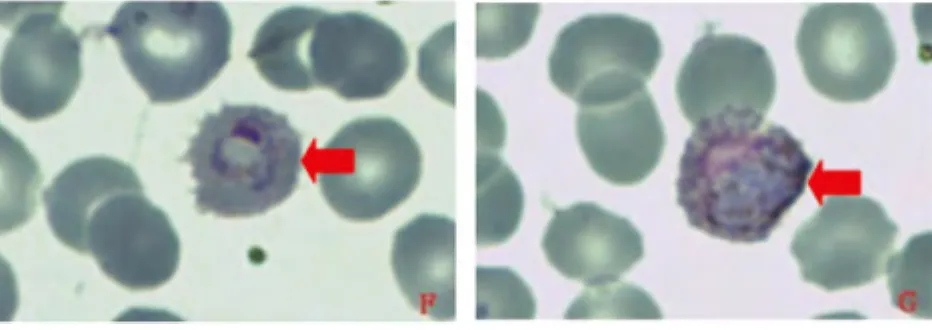
图3 镜下卵形疟原虫形态Fig.3 Morphology of P.ovalein micnoscope
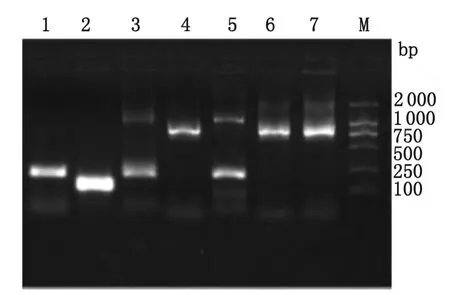
图4 PCR电泳结果Fig.4 Electrophoresis result of PCR
2.2 PCR检测 将4对引物分别进行扩增,然后电泳,并设恶性疟、间日疟阳性对照,发现FJ1、FJ2有产生恶性疟及卵形疟位置的2条带,FJ3只有卵形疟位置的1条带。证实FJ1和FJ2是卵形疟亚种curtisi和恶性疟混合感染,FJ3是单一卵形疟亚种curtisi感染,见图4。
2.3 测序结果 通过上海生工测序,FJ1扩增产物与登录号为KC633226.1卵形疟分离株ZJ04ssr-RNA基因以及登录号为AB182489.1卵形疟ssr-RNA完整序列的经典亚种有99%的一致性。FJ2扩增产物与登录号为KC633226.1卵形疟分离株ZJ04ssrRNA基因一致性为99%。FJ3扩增产物与登录号为AB182489.1卵形疟ssrRNA完整序列的经典亚种有98%的一致性。

表4 测序结果信息Tab.4 Result of sequencing
3 讨 论
由于历史上福建省卵形疟报道较少,卵形疟血片与相关培训少,形态易与间日疟混淆,3例镜检都误诊为间日疟。在回顾性复核时发现FJ1、FJ2除了具有卵形疟原虫的形态特点外,镜检未见恶性疟配子体,且环状体密度低难以与其它虫种区分等,导致恶性疟均未检出,出现混合感染漏诊,需要PCR确诊。FJ2制片染色较差。FJ3有卵形疟原虫的典型特点,经过培训的熟练镜检员不致于误诊。国内卵形疟误诊漏诊等情况也有多家报道。师永霞等[7]2011年报道1例来自赤道几内亚输入性卵形疟血样初次镜检阴性,通过镜检复核和PCR扩增后,发现该病例为卵形疟感染,显示PCR检测的必要。姚立农等[8]在2014年报道的浙江省5例来自非洲的输入性疟疾误诊病例中,发现在基层医疗机构镜检初步都诊断为间日疟,后经复核和PCR扩增发现为卵形疟感染。3例卵形疟除了来自乌干达的FJ3为单一感染卵形疟外,其它2例都伴有恶性疟感染,因此要加强对西非等归国人员疟疾知识的宣传和关注,避免少见类型、形态难以区分混合类型、症状严重的恶性疟的误诊、漏诊等。由于肝细胞期休眠子的潜伏期不同,导致一系列复发的可能,有些肝细胞期存在延迟发育,有报道可能导致复发发生在感染后4年出现,应提醒病人不要忽视复发的存在。
随着经济全球化,出国交流、务工、经商的人越来越多,出现越来越多的来自非洲、东南亚、南美洲的输入性疟疾,也给中国带来更多少见和罕见疟疾类型,如三日疟,卵形疟(经典亚种P.ovalecurtisi和变异亚种P.ovalewallikeri)[9]以及诺氏疟原虫等。虽然两个亚种的分型鉴别目前仍在研究讨论中[4,10-11],但是必须要加强和借鉴全球疟疾专家和学者的研究,完善诊断检测方法,真正了解全球疟疾的分布流行。
[1]Calderaro A,Piccolo G,Gorrini C,et al.A new real-time PCR for the detection ofPlasmodiumovalewallikeri[J].PLoS ONE,2012,7(10):e48033.DOI:10.1371/journal.pone.0048033
[2]Zhou RM,Zhang HW,Deng Y,et al.Laboratory detection on two cases with importedPlasmodiumovaleinfection[J].Chin J Parasit Dis Ctrl,2013,31(2):127-129.(in Chinese)周瑞敏,张红卫,邓艳,等.2例输入性卵形疟的实验室检测[J].中国寄生虫学与寄生虫病杂志,2013,31(2):127-129.
[3]Calderaro A,Piccolo G,Perandin F,et al.Genetic polymorphisms influencePlasmodiumovalePCR detection accuracy[J].J Clin Microbiol,2007,45(5):1624-1627.DOI:10.1128/JCM.02316-06
[4]Li M,Xia ZG,Tang LH.Overviews onPlasmodiumovalewallikeriand its genetic detection system[J].Chin J Parasit Dis Ctrl,2014,32(1):64-67.(in Chinese)李美,夏志贵,汤林华.卵形疟原虫wallikeri亚种及其基因检测体系的研究进展[J].中国寄生虫学与寄生虫病杂志,2014,32(1):64-67.
[5]Putaporntip C,Hughes AL,Jongwutiwes S,et al.Low level of sequence diversity at merozoite surface protein-1locus ofPlasmodiumovalecurtisiandP.ovalewallikerifrom Thai isolates[J].PLoS One,2013,8(3):e58962.DOI:10.1371/journal.pone.005 8962
[6]Snounou G,Viriyakosol S,Zhu XP,et al.High sensitivity of detection of human malaria parasites by the use of nested polymerase chain reaction[J].Mol Biochem Parasitol,1993,61(2):315-320.
[7]Shi YX,Huang JC,Su JK,et al.Laboratory diagnosis of a suspected case of importedPlasmodiumovaleinfection[J].Chin J Zoonoses,2011,27(10):914-920.(in Chinese)师永霞,黄吉城,苏锦坤,等.1例国内罕见的输入性卵形疟的实验室检测[J].中国人兽共患病学报,2011,27(10):914 920.
[8]Yao LN,Zhang LL,Ruan W,et al.Species identification in 5 imported cases previously diagnosed asVivaxmalaria by parasitological and nested PCR techniques[J].Chin J Parasitol Parasit Dis,2013,31(3):221-234.(in Chinese)姚立农,张玲玲,阮卫,等.浙江省5例输入性疟疾误诊病例的病原学诊断分析[J].中国寄生虫学与寄生虫病杂志,2013,31(3):221-234.
[9]Li YC,Wang GZ,Sun DW,et al.A case ofPlasmodiumovale wallikeriinfection in a Chinese worker returning from West Africa[J].Korean J Parasitol,2013,51(5):557-562.DOI:10.3347/kjp.2013.51.5.557
[10]Tanomsing N,Imwong M,Sutherland CJ,et al.Genetic marker suitable for identification and genotyping ofPlasmodium ovalecurtisiandPlasmodiumovalewallikeri[J].J Clin Microbiol,2013,51(12):4213-4216.DOI:10.1128/JCM.01527-13
[11]Fuehrer HP,Stadler MT,Buczolich K,et al.Two techniques for simultaneous identification ofPlasmodiumovalecurtisiandPlasmodiumovalewallikeriby use of the small-subunit rRNA gene[J].J Clin Microbiol,2012,50(12):4100-4102.DOI:10.1128/JCM.02180-12
