局部使用抗生素对拟行玻璃体内注射患者眼表微生物群落影响的自身前后对照研究△
2020-12-10吴琼张明惠娜石蕊黎黎
吴琼 张明 惠娜 石蕊 黎黎
眼表是人体与外界密切沟通的组织,其由完整的黏膜上皮构成上皮屏障,并且是眼部固有免疫的重要组成部分。近年来研究发现,眼表微生物群落也参与到眼表功能稳态的维持[1]。有研究表明,微生物能够促进耐受性树突状细胞及调节性T细胞的产生,通过NKT细胞调节细胞因子分泌,从而发挥免疫调控作用[1-2];并且眼部微生物群落也参与了干眼、翼状胬肉等疾病的发生与发展[3]。全球每年因各种原因需要进行玻璃体内注射的患者可达数千万人[4],目前临床常规操作为术前眼局部滴用广谱抗生素以预防眼内炎发生,然而越来越多的研究表明,内眼手术前局部抗生素的使用并不能减少眼内炎的发病率,且还存在诱导耐药、增加医疗成本等弊端[5],所以深入全面地研究抗生素对机体各个方面的影响,不断深化规范用药意识是十分必要的。本研究分析眼局部抗生素的使用对眼表微生物群落的影响,以更加全面地了解抗生素对眼表稳态的作用,同时为进一步研究微生物群落与眼表免疫的作用机制奠定基础。
1 资料与方法
1.1 一般资料与分组选取2018年9月至2019年1月在西安交通大学第一附属医院眼科门诊以及陕西省人民医院眼科住院部就诊需行玻璃体内注射的患者30例为研究对象,最终成功建库测序并满足自身前后对照的患者7例。排除标准:无法随访者;合并其他眼表疾病者;3个月内使用过激素或抗生素类眼液、眼膏(除玻璃体内注药围手术期用药外)者;3个月内经历过眼部任何手术者(除玻璃体内注射外)。本试验分为未用药组和用药组两组,其中,未用药组为未滴用任何抗生素的术眼结膜囊菌群;用药组为滴用左氧氟沙星滴眼液(可乐必妥)1~2 d后的术眼结膜囊菌群。本研究通过本院伦理委员会认证,征得患者同意并签署知情同意书。
1.2 方法
1.2.1 样品采集与保存严格无菌眼表取材。受试者入院后未滴任何抗生素眼液前,术眼滴爱尔凯因滴眼液,1~3 min后嘱受试者向上看,打开灭菌冻存管,翻开下眼睑,使用无菌干棉拭子,轻微压力涂擦眼球下方的结膜表面,采集患者下眼睑结膜囊内微生物,整个过程用时10~15 s。术眼滴左氧氟沙星滴眼液(可乐必妥)每日4次,1~2 d后受试者未冲洗结膜囊前,再次采用上述方法对术眼进行结膜囊微生物样本采集。结膜样本拭子置于1.5 mL无菌管中放入冰盒送入实验室,-80 ℃冰箱冻存,1周内提取16S rDNA。
1.2.2 DNA 提取与PCR扩增样本被接收后,将棉拭子前端无菌处理剪下,转移至破碎管中,研磨5 min,65 ℃裂解13 min,室温12 000 r·min-1离心10 min。取上清至离心管中,混匀,加入-20 ℃预冷的异丙醇和100 g·L-1醋酸钠3 mL,-20 ℃过夜沉淀。重复离心3 次,晾干后溶于适量缓冲液,使用10 g·L-1琼脂糖凝胶检测DNA 提取质量。用V3-341F(5’-ACTCCTACGGGAGGCAGCAG-3’)和V4-80R(5’-GGACTACHVGGGTWTCTAAT-3’)[6]通用区引物对16S V3-V4可变区进行PCR扩增。取质量合格的基因组DNA样品30 ng及对应的融合引物配置PCR反应体系,设置PCR反应参数进行PCR扩增,使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化并溶于Elution Buffer,贴上标签,完成建库。使用Agilent 2100 Bioanalyzer对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,选择HiSeq平台进行高通量测序。
1.2.3 测序及数据处理使用IIIumina 的Miseq PE301+8+8+301平台进行双端测序。根据华大基因提供的高通量测序的下机数据(raw data),利用FLASH软件进行拼接、过滤、嵌合体去除,利用USEARCH(v7 .0.1090)软件进行OTUs(operational taxonomic units)聚类分析,根据OTUs聚类分析结果,采用Observed species、Ace、Chao、Simpson、Shannon评估指数分别对样本进行Alpha多样性分析,以评估单个样本的物种丰富度;Beta多样性分析用于测量两个或多个组合之间的差异。采用 GreenGene数据库进行注释。
1.2.4 统计学分析采用SPSS 18.0软件进行统计学分析,数据以均数±标准差表示,连续变量的组间比较采用独立样本t检验,分类变量的组间比较采用χ2检验,在样本量或理论数较小时使用Fisher确切概率法。使用R(v3.2.1)软件的mixOmics包进行PLS-DA(partial least squares discrimination analysis)分析,PLS-DA分析是一种用于判别分析的多变量统计分析方法,常用于判断研究对象如何分类。使用mother(v.1.31.2)软件对各样品的Alpha多样性指数等指标进行计算。分析各物种在样品中的含量,进而计算出不同样品间的Beta多样性值。Beta多样性通过 QIIME(v1.80)方法进行计算。使用Lefse软件对LDA分析的P值设定,根据Segata等[7]的方法,以3.0作为判断“显著差异菌落”的阈值。
2 结果
2.1 患者一般资料本研究纳入30例(43眼)患者,17例单眼,13例双眼,共获得86例标本,成功建库41例标本,其中7例患者可形成自身前后比较,共14例标本。入选患者年龄及性别、疾病构成的比较差异均无统计学意义(均为P>0.05),纳入自身前后对照研究的7例患者有较好的代表性(见表1)。
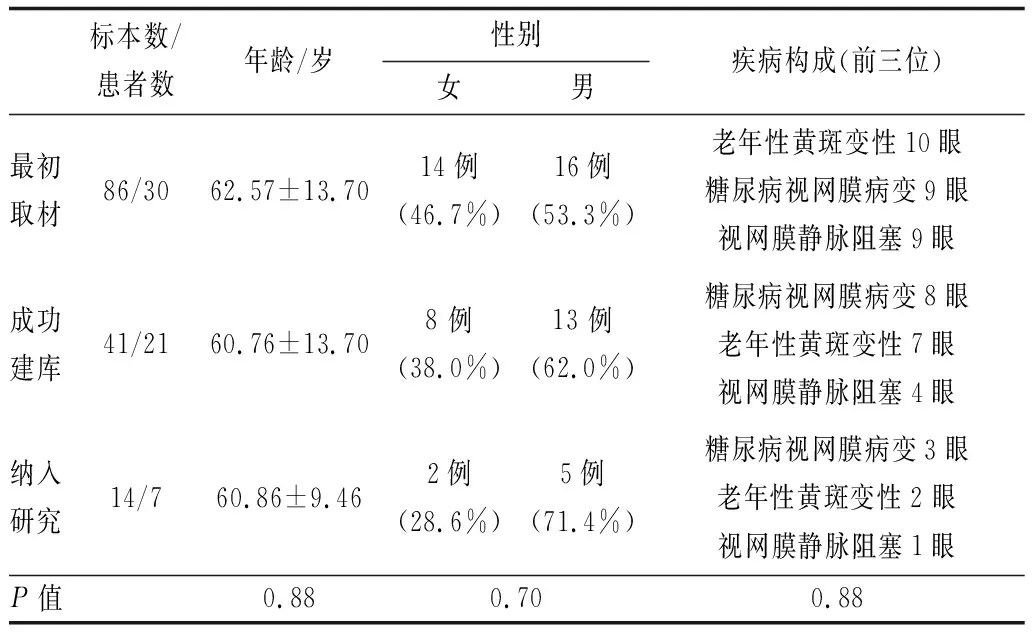
表1 纳入研究患者一般资料
2.2 OTUs聚类分析两组共获得607 362条有效序列和869个OTUs,未用药组共得到659个OTUs,用药组共得到575个OTUs,两组共有的OTUs为365 个(图1A) 。抗生素使用后,OTUs数量的确减少。PLS-DA分析显示,未用药组与用药组分成了两个群落,表明两组OTUs丰度上有显著性差异(图1B) 。

图1 OTUs 聚类分析 A:维恩图;B:基于OTUs丰度的PLS-DA 分析
2.3 人眼表微生物群落多样性分析Alpha多样性分析结果表明,未用药组组内与用药组组内眼表微生物群落的Alpha多样性差异无统计学意义(P=0.38;见图2),表明未用药组组内与用药组组内眼表微生物的群落构成差异无统计学意义。Beta多样性分析结果显示,未用药组与用药组眼表微生物群落的Beta多样性差异无统计学意义(P=0.32,统计量值为180;见图3)。
2.4 人眼表微生物群落的分类组成对所有样本进行分析,在未用药组,厚壁菌门所占比例最大(30.0%),其次为放线菌(26.8%)、变形菌(26.1%)、拟杆菌(10.9%)、蓝藻菌(2.7%)。在用药组,变形菌所占比例最大(40.2%),其次为厚壁菌门(33.6%)、放线菌(12.4%)、拟杆菌(3.7%)、蓝藻菌(2.9%)(图4A)。与未用药组相比,用药组中变形菌与厚壁菌门的占比增多,但放线菌的占比减少。在属水平,未用药组主要为放线菌、棒状杆菌、表皮葡萄球菌,用药组主要为α-变形菌、鞘脂单胞菌、链球菌;与未用药组相比,用药组中鞘脂菌(10.4%vs.5.2%)、链球菌(12.5%vs. 1.4%)、不动杆菌(4.2%vs. 3.2%)的占比增多,而葡萄球菌(7.0%vs. 9.4%)与棒状杆菌(6.6%vs.21.4%)的占比减少(图4B)。在种水平,与未用药组相比,用药组约氏不动杆菌(2.6%vs. 1.3%)、马链球菌(11.0%vs. 0%)的占比增多,而表皮葡萄球菌的占比减少(5.4%vs. 9.4%)(图4C)。图4D为关键物种差异比较柱状图(种水平上)TOP10物种相对丰度,松鼠葡萄球菌、马链球菌在未用药组中相对丰度极低,而在用药组中相对丰度显著上升,与之前的柱状图结果一致。以上结果显示,用药后共生菌/条件致病菌(葡萄球菌、棒状杆菌)明显减少,致病菌(链球菌、不动杆菌)增加。
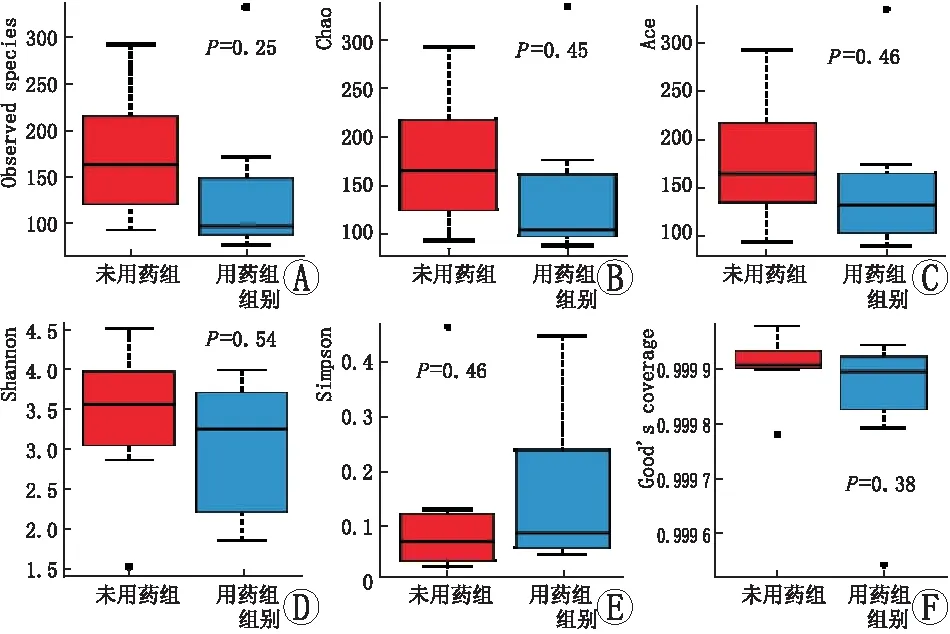
图2 组间Alpha多样性盒形图 A:Observed species指数;B:Chao指数;C:Ace指数;D:Shannon指数;E:Simpson指数;F:Good’s coverage

图3 组间Beta多样性盒形图
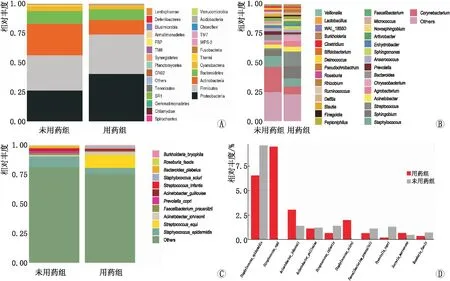
图4 未用药组和用药组核心群落比较 A:门水平;B:属水平;C:种水平;D:种水平上关键物种差异比较柱状图TOP10条形图
2.5 样本组间菌群构成差异分析以LDA值3.0作为标准来检测样本中的显著物种。通过对两组样本进行Lefse分析显示,未用药组中共有8种显著菌被发现,它们分别属于不同分类水平的菌:微球菌、allobaculum、放线菌、莫拉克斯菌、韦荣球菌(图5)。用药组无任何菌的LDA值大于3.0,说明经过抗生素处理后的结膜囊菌群发生显著变化。allobaculum属于厚壁菌门,这与前面的物种丰度柱状图结果一致。

图5 未用药组LDA 评分大于3.0的8种菌
3 讨论
微生物群落对外界环境变化较敏感,不同的饮食结构、不同地域的受试者微生物群落构成就可能会有明显的差异[8-10]。因此,本研究采用自身前后对照的设计,排除受试者的生活环境、用眼习惯、饮食结构等个人因素对结果产生的影响,更可靠地反映抗生素这单一因素对眼表微生物群落的影响。初期共收集30例患者用药前后86例标本,由于DNA浓度、配对等因素,最终分析7例患者共14例标本,其中成功建库百分比为47.67%(41/86),纳入自身对照标本百分比为16.28%(14/86),充分说明自身对照研究的难点,样本量较少,与其他文献报道的自身对照研究相似[11]。
本研究结果显示,用药组中OTUs的数量显著低于未用药组。使用抗生素眼液减少了结膜囊微生物的物种多样性。这一发现与抗生素对肠道和口腔微生物群落的影响相似[12]。Alpha多样性与Beta多样性分析均未发现用药前后眼表微生物群落的显著性差异,考虑与样本量较少有关,仍需要加大样本量进一步研究。
在本研究中,变形菌门、厚壁菌门、放线菌门、拟杆菌门和蓝藻菌门被确定为5种主要的眼部结膜微生物群,这与文献[13-14]报道的结果相似。在属水平的观察可知,用药组与未用药组相比,棒状杆菌、葡萄球菌含量减少,鞘脂菌、链球菌、不动杆菌含量增多。在种水平,用药组与未用药组相比,表皮葡萄球菌含量减少,而马链球菌与约氏不动杆菌含量增多,与美国Bascom Palmer眼科研究所的系列研究结果相似[15-16],眼表菌群包含多种革兰阳性细菌,使用抗生素后,革兰阴性细菌(如链球菌)的含量增加。既往文献结果显示,抗生素的使用降低了眼表共生菌群(如棒状杆菌[17-18])与非致病性细菌/条件致病菌(如表皮葡萄球菌)[19-20]的百分比,而致病菌链球菌[21]与不动杆菌[22-23]的丰度增加。这种菌群比例的失调,不利于眼内炎的预防[18,24-25]。
目前已有大量研究认为,在玻璃体内注射术前广泛使用抗生素并不能显著降低眼内炎发生率[26-27],其原因尚不清楚,有待进一步深入研究。本研究的意义在于,从微生物群落角度发现,眼局部抗生素的使用破坏了眼表微生物稳态的平衡,使致病菌丰度增加,推测可能与术后感染发生率未显著下降有关。本研究结果表明,眼局部使用抗生素的确会影响拟行玻璃体内注射患者的眼表稳态维持,为将来深入探索其中作用机制奠定基础。
