腹膜后Castleman 病合并膜性肾病1 例诊治体会
2020-12-10韦颖
韦颖
(柳州市中医医院肾病科,广西 柳州)
1 病例资料
患者,女,64 岁,因“双下肢水肿半月”入院。入院前半月无明显诱因出现双下肢水肿,伴腹胀、活动后气促,到我院门诊就诊,查“TP 55.8g/l、ALB 28.5g/l、CHO 8.51mmol/l、TG 7.14mmol/l,肾功能正常,甲状腺功能正常,糖化血红蛋白正常,尿隐血3+、尿蛋白(2+)。泌尿系彩超提示左肾内上方肿块(肾上腺肿瘤可能),左肾积液。”考虑肾病综合征。病程中患者无少尿、肉眼血尿,无发热、皮疹、关节痛,无腹痛、腰痛、腹泻、纳差等。既往史、个人史、家族史无特殊。入院查体:血压151/83mmHg,余生命征正常。神志清楚,精神可,全身浅表淋巴结未触及肿大。双肺呼吸音清晰,未闻及干湿啰音。心率75 次/分,心律齐,心脏各瓣膜听诊区未闻及杂音。腹软,无压痛、反跳痛,腹部未触及包块,移动性浊音(-),肠鸣音4 次/ 分。双肾区无叩痛。双下肢中度凹陷性水肿。入院实验室检查:红细胞计数(RBC)5.74 ↑×1012/L,平均红细胞体积(MCV)64.1 ↓fL,平均红细胞血红蛋白含量(MCH)20.2 ↓pg,平均红细胞血红蛋白浓度(MCHC)315.0 ↓g/L,血小板计数(PLT)434 ↑×109/L。24h 尿蛋白定量5297.6 ↑mg/24h。血清铁三项检查:血清总铁结合力(TIBC)39 ↓μmol/L, 转铁蛋白饱和度19.2 ↓%,转铁蛋白(TF)1.39 ↓g/L。血清铁蛋白测定124.35ng/mL。G-6-PD 酶活性检测正常。红细胞孵育渗透脆性实验(MDST)阴性,HbA198.1%↑,HbA21.9 ↓。抗碱性血红蛋白(HbF)0.00%,未见血红蛋白H 包涵体,异常血红蛋白带(-)。血沉31 ↑mm/h。补体C40.69 ↑g/L。免疫球蛋白测定及CRP 正常。血清蛋白电泳:白蛋白(ALB)49.7 ↓%,α1 球蛋白3.9 ↑%,α2球蛋白18.9 ↑%, 蛋白比值(A/G)0.99 ↓。抗核抗体滴度<1:80。抗O+类风湿因子、抗心磷脂抗体(IgA、IgG、IgM)、抗肾小球基底膜抗体、抗核抗体谱、抗中性粒细胞浆抗体、免疫球蛋白G4 正常。血清免疫固定电泳、本-周氏蛋白定性、直接抗人球蛋白试验阴性。乙肝五项定性:乙肝e 抗体定性(抗-HBe)阳性(+),乙肝核心抗体定性(抗-HBc)阳性(+)。艾滋病毒、丙肝、梅毒相关抗体阴性。CA-125、CA-153、CA-199 测定正常。心电图及心脏彩超大致正常。胸部CT 示:1、左肺上叶尖后段钙化灶,2、右肺中叶纤维化,3、肝多发囊肿。腹部MRI 示(图1):1、腹膜后多发病变,考虑偏恶性,不除外巨淋巴结增生症,2、肝脏多发小囊肿。肾病科行经皮肾脏穿刺活检术,提示II 期膜性肾病(免疫荧光:可见 15 个肾小球,,IgG (+++);IgM (+);IgA (-);C3 (+);C1q (-)。沉积部位:弥散、球性、毛细血管攀。沉积方式:细颗粒状。光镜:可见 40 个肾小球其中1 个肾小球球性硬化。图2)。药物予利尿、补铁、降脂、抗血小板聚集等治疗。
因腹膜后占位性质不明,考虑恶性病变可能,至普通外科行腹膜后肿瘤切除术,术后病理诊断(后腹膜肿物):比较符合Castleman 病改变,免疫组化:CK-P、Bcl-6、CD10、CyclinD1、P53、Ki-67(-),CD21 显FDC 网正常表达,Bcl-2 显套区及间区增宽,CD3、CD20、CD68、CD34、S-100 均正常表达(图3)。术后复查全腹CT 检查示(图4):腹腔后Castleman 病术后,原腹膜后偏左侧肿块已切除;腹膜后仍可见多发小淋巴结;肝脏多发囊肿;左肾略增大,左肾盂轻微扩张、积液,左肾周筋膜稍增厚。术后1月复查24h 尿蛋白定量4045.6 ↑mg/24h,ALB 35.3g/l;术后半年复查24h 尿蛋白定量483mg/24h;术后1年复查24h 尿蛋白定量231mg/24h。
2 讨论
本病例特点:(1)老年女性,病程短,临床表现为水肿、腹胀;(2)诊断肾病综合征明确;(3)肾脏病理提示II 期膜性肾病;(4)后腹膜肿物病理提示Castleman 病。
Castleman 病在 1954年被首次报道,但迄今为止仍无法明确其病因及相关发病机制。目前公认人类疱疹病毒-8(HHV-8)及白细胞介素 -6(IL-6)与其发病相关[1]。众多研究亦表明IL-6 是与CD 发病相关的最密切细胞因子[2]。另外,Castleman 病患者的临床症状及影像学检查无特异性,及易误诊及漏诊,必须依靠组织病理学检查及免疫组织化学染色明确诊断[3]。临床上分为单一淋巴结受累的单中心型(LCD)和多部位淋巴结受累的多中心型(MCD),组织学上分为透明血管型(HV)、浆细胞型(PC)及兼有二者特征的混合型[4]。针对LCD,手术切除是主要治疗手段。MCD 受累淋巴结广泛,可进展为恶性淋巴瘤, 预后差,目前利妥昔单抗(CD20 单抗) 常作为MCD 的一线治疗方案[5]。

图1 后腹膜肿物MRI(术前)

图2 肾组织标本活检

图3 后腹膜肿物活检(HE 染色)
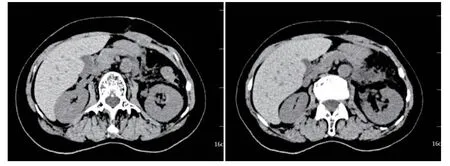
图4 腹部CT(术后)
从目前病例报道中看,CD 引起肾脏损害的病理改变以肾淀粉样变最多, 且多见于浆细胞型及混合型CD[6]。老年患者以肾病综合征状态起病,临床上首先应需重点排除继发性因素, 尤其是恶性肿瘤、自身免疫性疾病、病毒感染等。该病例患者生化检验除红细胞呈小细胞形态改变、血小板升高外,自身免疫性疾病及病毒感染筛查未见明显异常,肾脏病理活检提示膜性肾病。因后腹膜后占位不排除恶性病变,予手术切除,病理诊断符合Castleman 病。术后追踪复查可见肾综状态逐渐减轻。
Eagena 等[7]对48 例伴癌肾病综合征患者行肾活检, 结果显示其中膜性肾病占33 例 (68.7%)。有文献报道约10%的MN 继发于恶性肿瘤, 而且是恶性肿瘤的首发症状[8]。现认为肿瘤相关性MN 的发病机制可能与肿瘤引发自身免疫功能紊乱, 使患者对于内源性或外源性的抗原更敏感,从而产生免疫复合物攻击肾脏导致肾损害[9]。针对原发肿瘤的治疗与肿瘤相关性肾病的预后密切相关, 积极有效的治疗能使肾病综合征减轻甚至缓解,反之肿瘤复燃或转移也会使肾病综合征复发[10]。另有文献报道21 例肿瘤合并肾损害患者中肾损害症状在手术或化疗后均有不同程度的好转[11]。
鉴于透明血管型为广泛的淋巴增生异常, 病灶邻近淋巴结可以同样的病理过程受累,由正常淋巴结向病变淋巴结演变[12]。此病例术后复查尿蛋白明显减少,但术后影像学腹膜后仍可见多发小淋巴结节,需密切观察患者病情演变,定期监测血常规、肝肾功能及尿蛋白情况,警惕复发,如必要时可行深部淋巴结穿刺活检。
