浮萍原生质体瞬时表达体系的建立及其应用研究
2020-12-10宋乐元杜安平王海燕
宋乐元,方 扬,田 润,杜安平,王海燕*
(1.四川大学生命科学学院 生物资源与生态环境教育部重点实验室,四川 成都 610065;2.中国科学院成都生物研究所,中国科学院环境与应用微生物重点实验室,四川 成都 610041;3.四川维度创研生物科技有限公司,四川 成都 610041)
【研究意义】浮萍是一种形态极其简单的小型开花植物[1],其组织形态高度退化为“叶状体”,但部分品种仍有“根茎叶花果实”的分化,具有高等植物同样的复杂表达系统[2]。浮萍生长速度极快,培养简单且成本低廉,也可无性繁殖。这不仅有利于遗传稳定性,还使其生物反应器不受季节限制,可以实现连续生产。【前人研究进展】目前,研究者已对部分浮萍品系开展了遗传转化体系的研究,有2个品系的表达体系已经用于商业化生产抗体、药用蛋白、人源化重组蛋白、生长素、生长因子等[3]。浮萍的生物学特征以及现有的研究基础均表明其表达体系是一个极具潜力的植物表达体系,在生物反应器领域有广阔的应用前景。因此,浮萍生物反应器的开发受到越来多的研究者的青睐,而浮萍遗传转化体系的研究、植物表达系统所需的功能元件的挖掘和筛选鉴定等工作,就成了浮萍生物反应器开发的核心问题。【本研究切入点】植物遗传转化操作通常需要较长的周期,这也是浮萍生物反应器开发的主要限速步骤。而浮萍的瞬时表达体系正适合浮萍生物反应器的快速研究,包括对功能元件的挖掘和筛选以及植物表达体系的优化等。然而,目前尚未见关于浮萍瞬时表达体系研究的报道。传统的植物原生质体瞬时表达体系是利用电转化和化学转化等方式将外源基因导入原生质体,经过夜培养即可。但是,在前期实验中发现浮萍原生质体比较脆弱,难以经受转化及较长时间的放置,故选择以农杆菌浸染愈伤作为外源基因转入方式,再将转化细胞制备原生质体。【拟解决的关键问题】因此,本研究拟通过优化调整农杆菌浸染和浮萍原生质体制备的相关实验参数,建立浮萍瞬时表达体系,并对其应用进行初步探索,为浮萍生物反应器的开发奠定基础。
1 材料与方法
1.1 材料
浮萍Lemnagibba愈伤组织、载体pCAMBIA2300-GFP和pCAMBIA2301-U启-GFP均来自中国科学院成都生物研究所;载体pCAMBIA2301和pCAMBIA2301-N启-GFP由四川维度创研生物科技有限公司提供;农杆菌GV3101、LBA4404、C58C1及EHA105购自武汉淼灵生物科技有限公司。
1.2 试剂
MgCl2、CaCl2、KCl2。MES、甘露醇、BSA购自sigma;果胶酶(Pectolyase Y-23)、纤维素酶(Cellulase R-10)和离析酶(Macerozyme R-10)购自Yakult;pMDTM19-T Vector Cloning Kit、TaKaRa MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0、TaKaRa ExTaq®、限制性内切酶购自TAKARA;T4DNA ligase、RevertAid First Strand cDNA Synthesis Kit购自Thermo Fisher;Eastep®Super Total RNA Extraction Kit购自普洛麦格(北京)生物技术有限公司;其他化学试剂均为分析纯。
1.3 方法
1.3.1 拟南芥基因扩增 提取拟南芥总RNA(Eastep®Super Total RNA Extraction Kit)利用反转录技术获取cDNA(RevertAid First Strand cDNA Synthesis Kit),然后以其为模板,分别扩增基因AT3G10030.1(Aspartate/glutamate/uridylate kinase family protein)和AT2G26800.2(Aldolase superfamily protein)(表1)。基因AT4G16410.1(Transmembrane protein)直接合成N端198 bp,并在两端分别添加EcoRⅠ和BglⅡ。
1.3.2 载体构建 将载体pCAMBIA2301用XhoⅠ酶切后自连,构成载体pCAMBIA2301-a。再以载体pCAMBIA2300-GFP为模板,依次用上游引物MCS-gfp3、MCS-gfp2、MCS-gfp1与下游引物YS009搭配,采用重叠PCR技术扩增带有多克隆位点的GFP(Green Fluorescent Protein )序列,并将其连接到pCAMBIA2301-a之中,替换原GUS基因,构成载体pCAMBIA2301-GFP-MCS。最后将该载体用PvuⅡ酶切后自连,构成载体pCAMBIA2301-GFP。
将拟南芥基因AT3G10030.1经NcoⅠ和BamHⅠ插入载体pCAMBIA2301-GFP,融合于GFP的N端,构成载体pCAMBIA2301-C-GFP(用于胞质定位研究);将拟南芥基因AT2G26800.2经NcoⅠ和BglⅡ插入载体pCAMBIA2301-GFP,融合于GFP的N端,构成载体pCAMBIA2301-M-GFP(用于膜定位研究);将拟南芥基因AT4G16410.1经EcoRⅠ和BglⅡ插入载体pCAMBIA2301-GFP,融合于GFP的N端,构成载体pCAMBIA2301-CH-GFP(用于叶绿体定位研究)。

表1 引物信息

图1 植物载体Fig.1 Representation of plant-compatible vectors
1.3.3 原生质体产率测定 将洁净的血球计数板覆上盖玻片,取原生质体溶液滴入血球计数板与载玻片的缝隙,待液体充满计数室后,在显微镜下观察并记录计数室的原生质体数量,重复3次。
原生质体产率(个/g)=计数室原生质数量×稀释倍数×10 000(个/mL)×体积(mL)/初始质量(g)
1.3.4 原生质体活性测定 制备原生质体单细胞悬液,按2∶1的比例加入FDA染液[4]染色1~2 min,取少量于载玻片上观察,发荧光者即为活细胞。
荧光显微镜观察方法:采用450~490 nm激发滤片,510 nm双分色镜和520 nm阻挡滤片的FITC滤片组进行观察并记数,重复3次。
细胞活率(%)= 活细胞总数/总细胞数×100
1.3.5 浮萍原生质体制备参数优化 本研究采用酶解法制备浮萍原生质体,根据文献报道[5-9]及前期实验结果,酶解液为2 %纤维素酶、0.5 %离析酶、0.5 %果胶酶、20 mmol/L MES、0.5 mol/L甘露醇、20 mmol/L KCl、10 mmol/L CaCl2、0.1 % BSA、pH 5.8。分别对制备材料类型、预处理方法、渗透压浓度进行单因素试验。
其中,材料类型分别为绿色致密型愈伤(Lemnagibba愈伤诱导时,叶片卷曲膨大,最早出现的绿色颗粒状愈伤组织)、黄色松散型愈伤(绿色致密型愈伤继续培养后,出现的黄色松散似沙状的愈伤组织)和悬浮培养愈伤(利用黄色松散型愈伤组织进行悬浮培养,待其愈伤颗粒大小约3 mm即可);渗透压浓度为0.2~0.7 mol/L的甘露醇;预处理方法分别为未处理、暗处理(暗培养16 h)、冷处理(4 ℃放置16 h)、高渗处理(0.6 mol/L甘露醇浸泡30 min)、复合处理Ⅰ(暗培养16 h,再用0.6 mol/L甘露醇浸泡30 min)、复合处理Ⅱ(4 ℃放置16 h,再用0.6 mol/L甘露醇浸泡30 min)。
制备方法:取制备材料0.2 g,加入2 mL酶解液,置于26 ℃环境中避光振荡(40 r/min)孵育12 h。加入2 mL W5溶液[8]轻柔混匀,经200目钢丝网过滤,1000 r/min离心3 min,小心去掉上清,用200 μl MMG溶液(4 mmol/L MES、0.5 mol/L甘露醇、15 mmol/L MgCl2、pH 5.8)轻轻重悬细胞。各组试验均重复3次,统计原生质体产率和活性。
1.3.6 农杆菌浸染参数优化 本研究分别对农杆菌类型、菌液浓度、乙酰丁香酮浓度及共培养时间等因素进行单因素试验。除试验因素外,其余因素参照下述浸染方法。
浸染方法:①将农杆菌培养至OD600约为1,于3000 r/min离心10 min收集菌体,用等量B5培养基(含100 μmol/L乙酰丁香酮)重悬菌体即为浸染液。②选取生长状态较好的悬浮培养愈伤组织1 g(鲜重),加入10 mL浸染液,静置20 min,吸干菌液。③将浸染后的愈伤组织转移到铺垫有滤纸的培养皿中,加入2~3 mL B5培养基(含100 μmol/L乙酰丁香酮),保持滤纸和愈伤组织湿润,于28 ℃暗培养2 d。④用清水冲洗愈伤组织去除残留农杆菌,制备原生质体并用荧光显微镜观察。取50 μl原生质体溶液统计转化率,并重复3次。
转化率(%)=发光细胞数/总细胞数×100
1.3.7 浮萍原生质体亚细胞定位 根据文献报道[10-11]选择定位于细胞膜(AT2G26800.2)、细胞质(AT3G10030.1)和叶绿体(AT4G16410.1)的拟南芥基因,分别与GFP构成融合表达载体,利用浮萍瞬时表达体系进行瞬时表达,通过共聚焦显微镜(Leica TCS-sp8)观察其在浮萍细胞中的定位情况。
GFP观察的激光参数:激发光488 nm,发射光:505~530 nm;叶绿体自发光的激光参数:激发光488 nm,发射光600~750 nm。
1.3.8 启动子功能检测 选取3个用于植物细胞蛋白表达的启动子:35 S启动子、N启动子、U启动子。以GFP作为报告基因,利用浮萍原生质体进行瞬时表达,并用荧光显微镜(Nikon Ti-E)观察GFP表达情况。采用Image J软件统计500个发光细胞的累积光密度,并用NORMDIST函数分析其分布情况。
2 结果与分析
2.1 材料类型对原生质体制备产率和活性的影响
浮萍Lemnagibba制备原生质体时,不同类型的愈伤组织制备原生质体的产率差异极显著,而活性差异却不显著(表2)。其中,以悬浮培养的愈伤组织制备原生质体的产率最高,故以其作为制备原生质体的材料。
2.2 渗透压浓度对原生质体制备产率和活性的影响
渗透压浓度对浮萍Lemnagibba原生质体制备的影响主要在产率方面。当甘露醇浓度在0.2~0.6 mol/L时,原生质体的活性差异不显著,但浓度上升到0.7 mol/L时,活性下降极显著。随着渗透压的增加,原生质体的产率先增后减,当甘露醇浓度为0.5 mol/L时,产率达到最高水平,且与其他浓度相比,差异达到极显著水平(表3)。综合考虑产率和活性情况,选择渗透压条件为0.5 mol/L甘露醇。
2.3 预处理方法对原生质体制备产率和活性的影响
经过冷处理的材料,其制备的原生质体的活性相对较高,且差异显著性达到极显著水平。在原生质体产率方面,冷处理仅低于暗处理,且差异不显著,却与其他处理方法的差异显著(表4),故选择冷处理作为预处理的方法。综合上述试验,浮萍Lemnagibba的悬浮培养愈伤组织(图2-a),可以用酶解法来制备原生质体(图2-b),并可用FDA染色来检测活性情况(图2-c)。
2.4 农杆菌浸染参数对转化率的影响
本研究所选的4种农杆菌,在浸染浮萍Lemnagibba愈伤组织时,其转化率的差异极大,其中GV3101转化率最高(图3-a)。转化率随着农杆菌GV3101浓度的增加,呈现先升后降的趋势。当其浓度(OD600)为1时,转化率最高(图3-b)。而乙酰丁香酮浓度为100 μmol/L时,转化率最高,过高和过低的乙酰丁香酮都会降低转化效率(图3-c)。在缺乏乙酰丁香酮时,未能成功转化,可见其对于浮萍Lemnagibba是必须的。另外,在一定时间内,增加共培养的时间有利于农杆菌浸染更加充分,进而增加转化率。当共培养2~3 d时,具有最高的转化率,而随着时间继续延长,转化率又开始下降,这可能是由于愈伤生长状态下降所致(图3-d)。因此,兼顾转化率和实验周期,共培养时间为2 d。
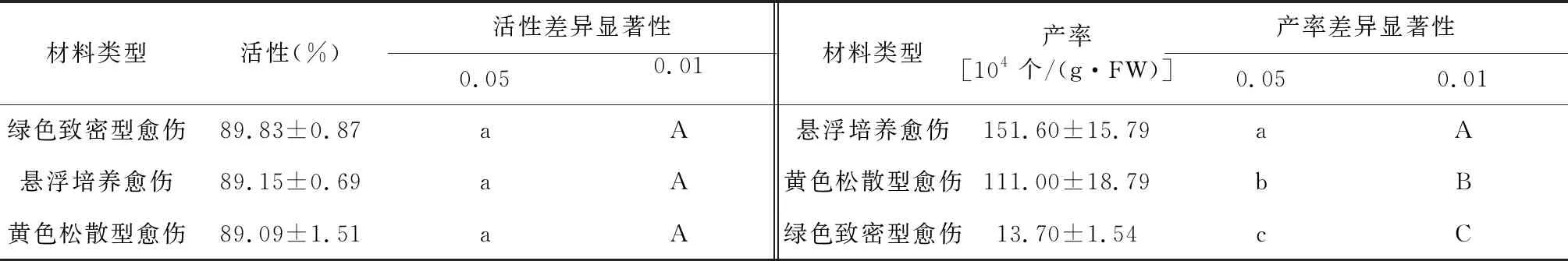
表2 不同材料制备原生质体活性和产率的差异显著性(LSD法)
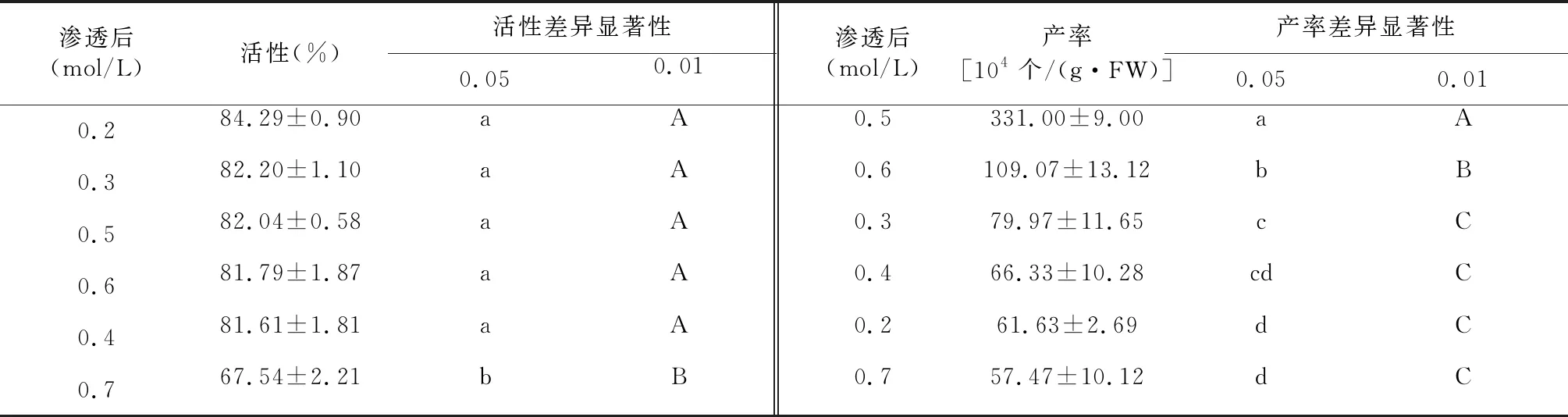
表3 不同渗透压条件制备原生质体产率和活性的差异显著性(LSD法)
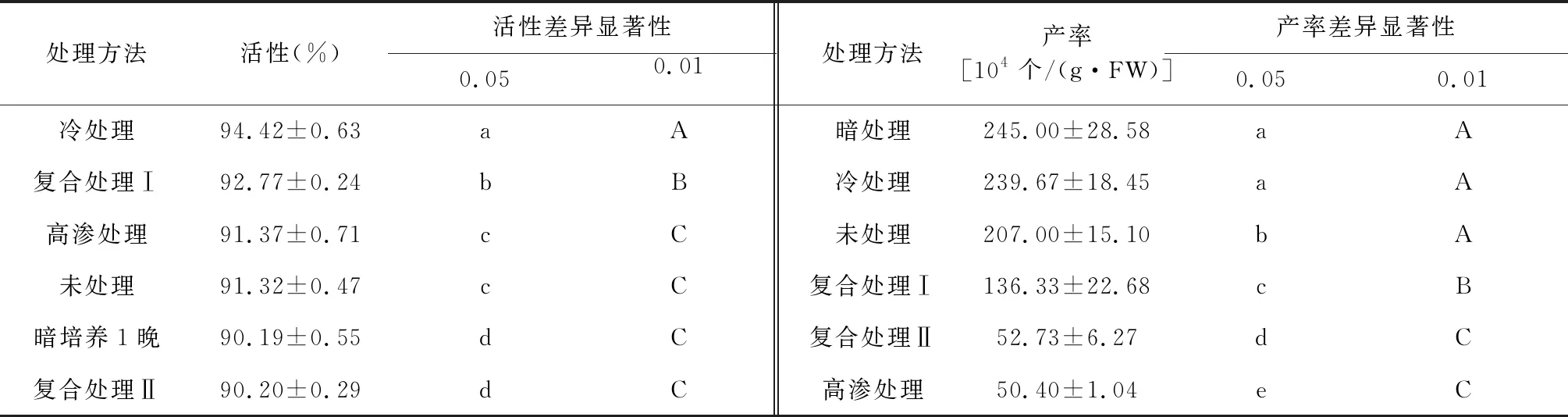
表4 不同预处理条件制备原生质体活性和产率的差异显著性(LSD法)
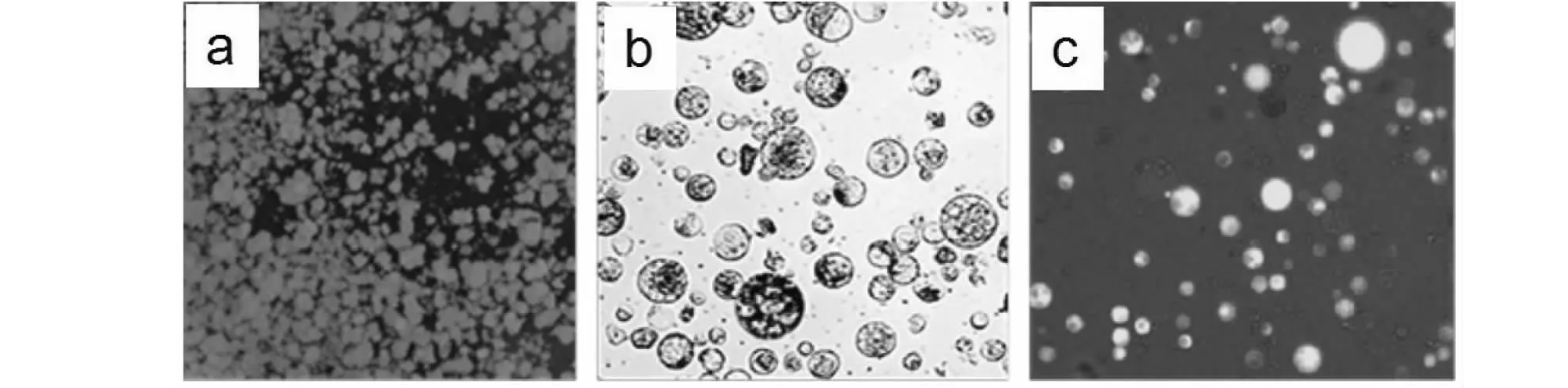
a:悬浮培养愈伤组织;b:原生质体;c:原生质体FDA染色(发光者皆为活细胞)图2 原生质体制备及活性测定Fig.2 Preparation and activity determination of protoplasm
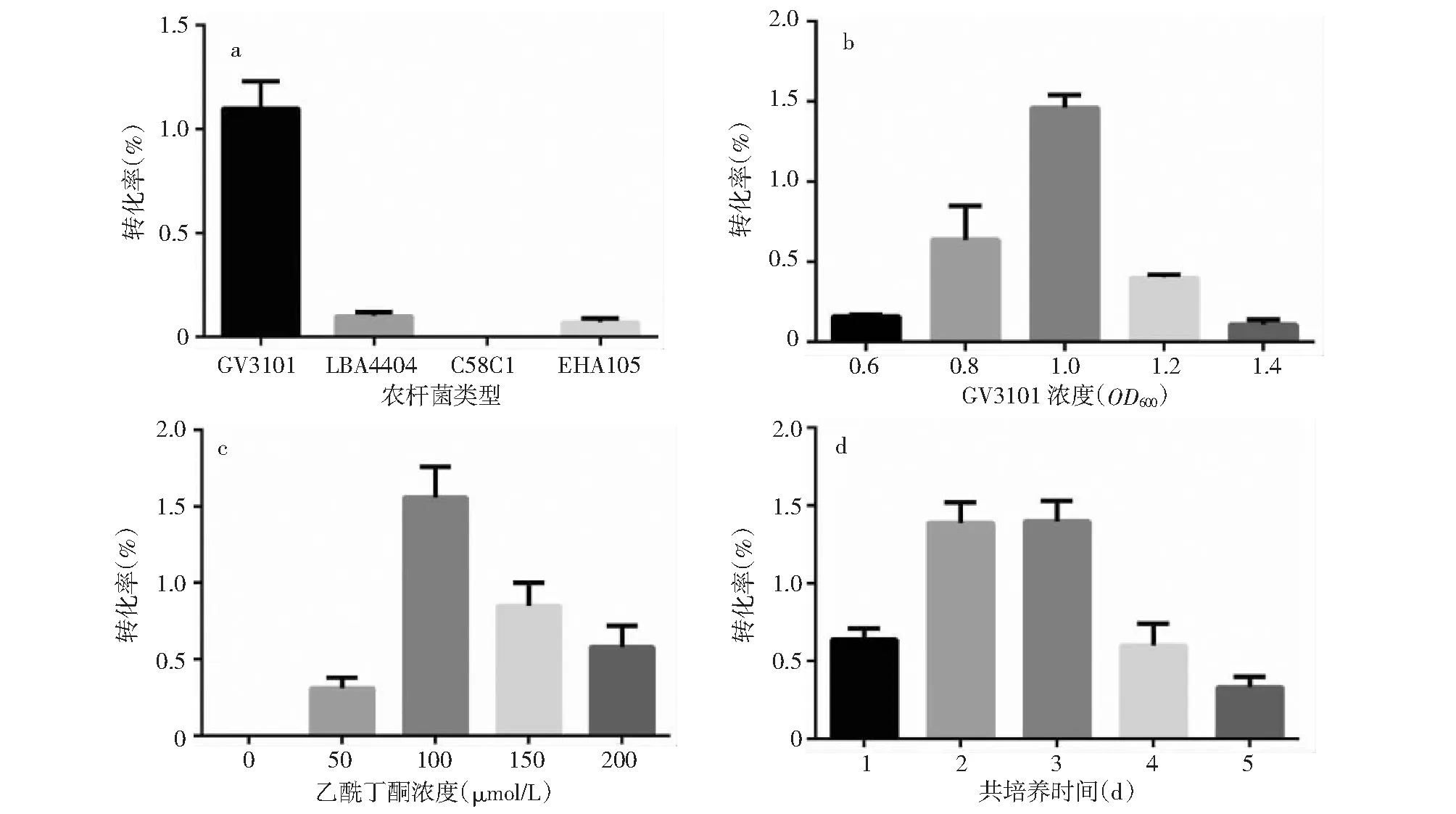
图3 农杆菌浸染参数对转化率的影响Fig.3 The impacts of conditions of agrobacterium tumester on transformation rate
2.5 亚细胞定位
本研究共选择3个已知定位信息的拟南芥基因,并以GFP作为报告基因。其共聚焦显微镜观察结果(图4)显示,GFP基因单独表达时,其荧光分布于整个细胞质中。拟南芥基因AT3G10030.1与GFP融合表达时,荧光分布于整个细胞质,与其在拟南芥细胞中定位情况一致[10]。拟南芥基因AT2G26800.2与GFP融合表达时,荧光主要分布于细胞膜,与其在拟南芥细胞中定位基本一致[10]。拟南芥基因AT4G16410.1与GFP融合表达时,荧光分布位置与叶绿体自发光位置一致,与其在拟南芥中的分布情况基本一致[11]。上述结果表明,该瞬时表达体系可以用来研究目的蛋白的亚细胞定位情况。
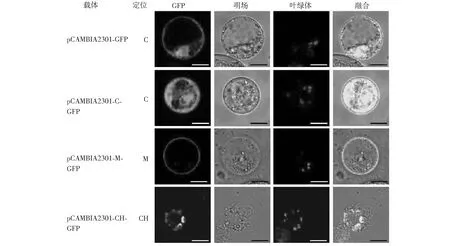
C:细胞质 M:细胞膜 CH:叶绿体 ;*标尺:10 μm图4 亚细胞定位结果Fig.4 The results of subcellular localization
2.6 启动子功能检测
本研究选取3个植物启动子分别与GFP构建融合表达载体,并利用浮萍原生质体瞬时表达体系进行瞬时表达。结果表明,不同启动子的发光强度有所差异(图5-a),且同一表达载体在不同细胞中的表达情况也不相同。对500个发光细胞的统计分析,3个启动子表达GFP累计光密度分布显示:U启动子累积光密度的总体平均数最大(49.60),N启动子次之(43.13),35S启动子最小(18.65);而离散度则是N启动子最大,U启动子次之,35S启动子最小(图5-b)。
3 讨 论
植物原生质体制备的方法包括机械法、渗透压法和酶解法,酶解法是目前最常用的方法,其中常用的酶有纤维素酶、离析酶、果胶酶、半纤维素酶和崩溃酶等[12]。本研究采用纤维素酶、离析酶和果胶酶制备浮萍的原生质体,经过对原生质体制备材料、预处理方法、渗透压浓度等一系列参数的优化,确定了浮萍Lemnagibba原生质体制备的最佳方案:以4 ℃过夜培养的浮萍悬浮培养愈伤组织为制备材料,用酶液(2 %纤维素酶、0.5 %离析酶、0.5 %果胶酶、0.1 mol/L CaCl2、0.2 mol/L KCl、1 % BSA、20 mmol/L MES pH 5.8、0.5 mol/L甘露醇)于25 ℃避光消化16 h(40 r/min)。
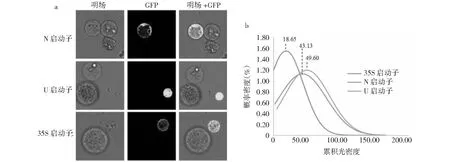
a:不同荧光强度的原生质体细胞;b:不同发光细胞的累积光密度分布情况图5 GFP发光情况及其累积光密度分布情况Fig.5 GFP luminescence and its cumulative optical density distribution
农杆菌浸染浮萍Lemnagibba愈伤组织的效率受到诸多因素的影响,包括愈伤组织的生长状态、农杆菌的类型及浓度、乙酰丁香酮浓度和共培养的时间等[13]。其中农杆菌的类型影响极大,GV3101在OD600≈1、乙酰丁香酮100 μmol/L时,转化效率最佳。此外,愈伤组织的生长状态也很重要,但难以对其生长状态进行准确的界定,需要一定的经验积累。而共培养时间的延长可以增加农杆菌持续浸染时间,但也会逐渐降低愈伤组织活性。
蛋白质的亚细胞定位研究有助于探索其生理功能,是当前蛋白质组学研究的一个重要方法,也常用于生物信息学预测信息的验证[14]。而GFP以其极好的灵敏性和无细胞毒性,可实现对活体的实时观察,被广泛用作定位研究的报告基因[15]。本研究将拟南芥中已知定位信息的基因,与GFP构建融合表达载体,利用浮萍原生质体瞬时表达体系进行瞬时表达,证明该体系可以用于亚细胞定位研究。这为浮萍基因的亚细胞定位研究奠定了基础,可以在一定程度上避免使用拟南芥等模式植物进行研究的物种差异[16]。
高效的表达载体是生物反应器开发和利用不可或缺的,而启动子则是一个高效表达载体所必须的核心元件。快速准确地检测启动子的功能,方能为构建高效的表达载体提供坚实基础。通常而言,需经过转基因操作获取转基因植株,再通过分析目的基因表达情况来评估启动子的功能,这样获得的结果虽最为准确,但却需要耗费长达数月甚至数年时间,且难以实现高通量。利用浮萍Lemnagibba瞬时表达体系,可以快速地检测载体的表达情况,从而评估包括启动子在内的表达载体功能元件的功能。然而,该瞬时表达体系对于组织特异性启动子功能的验证还存在不足,需要更加深入的研究。另外,该瞬时表达体系不仅耗时短,大约3~4 d,还可以实现高通量检测,大大提高了实验效率。本研究选择的3个启动子表达GFP的荧光强度存在差异,主要表现在总体平均数、离散度等方面,证明该方法可用于验证启动子功能。但是,该结果并不界定启动子的强弱,仅展示其荧光强度的分布情况。故,在具体的研究中,应根据研究目的不同,以总体平均数或离散度作为标准,选择恰当的启动子。
与模式植物拟南芥的原生质体瞬时表达体系相比,以农杆菌介导的浮萍Lemnagibba瞬时表达体系还存在一定的差距,主要体现在转化率上,尚不足拟南芥的十分之一。该体系较低的转化率也大大增加了工作量,还限制了该体系的应用领域。然而植物原生质体制备和转化是极为复杂的,本研究还有一些技术障碍未能突破,需要更加深入的探索。在植物原生质体制备过程中,常用产率和活性来评估其制备方法,但用这种评估标准制备出的原生质体可能并不是最适合转化的,这也是值得探索的方面。随着研究的深入,浮萍原生质体瞬时表达体系可更加高效、稳定,为浮萍生物反应器的开发提供助力。
4 结 论
成功建立浮萍原生质体瞬时表达体系,可以在短时间内完成亚细胞定位研究和启动子功能验证。
