云南小麦品种(系)抗逆性相关基因的KASP标记检测
2020-12-10王志伟乔祥梅王志龙杨金华程加省于亚雄
王志伟,乔祥梅,王志龙,杨金华,程加省,程 耿,于亚雄
(云南省农业科学院粮食作物研究所/国家小麦改良中心云南分中心,云南 昆明 650200)
【研究意义】小麦是我国的三大主要口粮作物之一,其产量高低直接关系着国家的粮食安全。干旱是限制小麦生产的最主要非生物因素之一,对产量和品质的形成有着严重影响[1-2]。穗发芽(Pre-harvest sprouting,PHS)是一种影响小麦生产的外界环境胁迫灾害,不仅造成小麦籽粒产量和利用价值降低,而且对品质有严重劣化作用[3-4],常对小麦生产造成严重经济损失。选育和推广抗逆小麦品种是保障国家粮食安全、促进小麦生产持续稳定发展的有效途径之一。明确云南小麦抗旱和抗穗发芽等抗逆性状相关功能基因的组成分布,对今后云南小麦抗逆育种具有重要意义。【前人研究进展】小麦的抗旱性是一个复杂的生物学性状,是多个因素共同作用的结果,由多基因共同决定[5-6,8,11-12]。DREB(Dehydration responsive element binding)是植物应答干旱、高盐、高温和低温等非生物逆境的一类重要的转录因子[7]。Shen等[8]研究发现,小麦转录因子基因TaDREB1应答低温、干旱和ABA胁迫。Wang等[9]研究发现,DREB转基因小麦的抗旱性明显增强,脯氨酸含量是对照品种的2倍。Wei等[10]克隆了小麦TaDREB1基因,并将其定位于3B染色体上,位于标记Xmwg818和Xfbb117之间。果聚糖外切水解酶1-FEHw3基因在极端干旱条件下对小麦中水溶性碳水化合物的再活化起着关键作用,在1-FEHw3基因启动子区域的生长素响应元件中发现SNP,推测1-FEHw3基因的Westonia等位基因型可能影响基因表达和酶活性水平,开发了该基因的CAP标记;在2年干旱条件下验证,Westonia等位基因型与较高的千粒重相关,为抗旱有利等位基因型[11]。细胞壁转化酶(CWI)是3种转化酶之一,对植物生长发育至关重要。小麦细胞壁转化酶基因TaCWI-4A位于染色体4A上,在TaCWI-4A的启动子区域中检测到2个SNP,TaCWI-4A基因的Hap-4A-C单倍型为抗旱有利基因型,在雨养生产地区表现为多穗粒数,而TaCWI-4A基因的Hap-4A-T单倍型为非抗旱有利基因型,在灌溉条件良好地区表现为高千粒重[12]。小麦穗发芽属于数量性状,受多基因控制,其抗性能力主要受种子休眠性、α-淀粉酶活性、种皮颜色和颖壳抑制物等因素影响,其中休眠性与其抗性能力呈显著相关[13]。Vp-1基因位于小麦第3同源群染色体的长臂上[14],是小麦种子成熟、干燥及休眠的主要转录调节因子,既能促进胚成熟,又可加速休眠并抑制其萌发[15]。Yang等[16]研究发现,Vp-1基因的Vp-1B等位变异与穗发芽抗性相关,在3BL上开发出Vp-1B等位变异的STS标记Vp-1B3,可对不同穗发芽抗性的小麦品种基因型进行有效区分。TaSDR-B1基因对小麦穗发芽抗性起到重要调控作用,定位于小麦2BS染色体着丝点附近,有1个SNP(A/G)存在于其起始密码子上游位点,其A类型命名为TaSDR-B1a,G类型命名为TaSDR-B1B;进一步研究发现TaSDR-B1a基因型发芽指数(GI值)显著低于TaSDR-B1B基因型[17]。TaPHS1基因是MFT-like基因,来源于白粒小麦Rio Blanco,位于小麦3AS 染色体上,发现在TaPHS1基因中存在2个SNP引起的突变,可通过调控小麦成熟期的籽粒休眠对小麦穗发芽抗性起正向调节作用[18]。【本研究切入点】KASP(Kompetitive allele specific PCR)技术具有稳定性高、准确性高和成本低的特点,目前已经在高通量SNP分型以及InDels检测上被广泛应用[19-22]。Rasheed等[20]基于已克隆基因的序列,利用KASP技术开发了小麦抗旱性和穗发芽抗性相关功能基因的KASP标记,可用于TaDreb-B1、1-fehw3、TaCwi-4A、TaPHS1、TaSdr-B1和TaVp-1B等功能基因的快速准确检测。【拟解决的关键问题】利用 3个抗旱性相关基因的KASP标记TaDreb_SNP、fehw3_SNP、CWI4A_SNP和3个穗发芽抗性相关基因的KASP标记PHS_646、SDR_SNP、Vp1b1-83_IND,对42份云南育成的小麦品种(系)进行抗旱和抗穗发芽等抗逆性状相关基因单倍型检测鉴定,旨在了解云南小麦品种(系)中抗逆性状相关基因的组成分布状况,筛选出含有目标基因的优异小麦种质,为云南小麦抗逆育种提供材料和方法。
1 材料与方法
1.1 供试材料
研究所用材料为云南省内相关育种单位选育的42份云南育成小麦品种和育成高代品系,品种信息见表2。
1.2 DNA提取
每份试验材料取8~10粒种子置于培养皿室温下培养,萌发7 d后取幼苗叶片,采用CTAB法[23]提取基因组DNA。
1.3 KASP标记检测
供试材料的KASP标记检测工作委托中国农业科学院作物科学研究所何中虎研究员课题组进行。试验所用抗旱性和穗发芽抗性相关功能基因的6组KASP标记引物来源于Rasheed等[20]设计,引物序列详见表1。PCR反应体系为10 μl,包括4.78 μl DNA (5~50 ng/μl),5 μl KASP MasterMix(LGC公司,英国),0.14 μl KASP Assay Mix,0.08 μl Mg+。KASP Assay Mix是由3条引物的稀释获得,按FAM-引物(100 μmol/L)∶HEX-引物(100 μmol/L)∶通用引物(100 μmol/L)∶ddH2O=12∶12∶30∶46混合而成[19]。采用降落PCR进行扩增,反应程序:95 ℃热处理15 min;95 ℃变性20 s,65~55 ℃退火和延伸25 s,10个降落循环(每循环降低1.0 ℃);95 ℃变性10 s,57 ℃退火和延伸1 min,30个循环;4 ℃避光保存[19]。PCR反应在Bio-Rad CFX96 PCR仪上(Bio-Rad,美国)上进行。每次反应设置4个空白对照组,其DNA模板用ddH2O代替。扩增结束后进行荧光扫描,并做基因分型分析。
2 结果与分析
2.1 供试小麦品种(系)抗旱性相关基因的KASP标记检测
TaDreb-B1基因分型结果(表2、图1-a)发现,云麦42等有23份品种(系)为TaDreb-B1基因的TaDREB-B1a耐旱单倍型,频率为54.76 %;云麦39等19份品种(系)为TaDreb-B1基因的TaDREB-B1B水分敏感单倍型,频率为45.24 %。1-fehw3基因分型结果发现,云麦39等24份品种(系)为1-fehw3基因的Westoniatype抗旱单倍型,频率为57.14 %;云麦53等17份品种(系)为1-fehw3基因的Kauztype非抗旱单倍型,频率为40.48 %。TaCwi-4A基因分型结果发现,云麦39等35份品种(系)为TaCwi-4A基因的Hap-4A-C抗旱单倍型,频率为83.33 %;云麦73等7份品种(系)为TaCwi-4A基因的Hap-4A-T非抗旱单倍型,频率为16.67 %。
2.2 供试小麦品种(系)穗发芽抗性相关基因的KASP标记检测
TaPHS_646基因分型结果(表2、图1-b)发现,云麦39等35份品种(系)为TaPHS_646基因的RioBlanceotype抗穗发芽单倍型,频率为83.33 %;云麦69等4份品种(系)为TaPHS_646基因的NW97S186type感穗发芽单倍型,频率为9.52 %。TaSdr-B1基因分型结果发现,云麦76等17份品种(系)为TaSdr-B1基因的TaSdr-B1a抗穗发芽单倍型,频率为40.48 %;云麦39等24份品种(系)为TaSdr-B1基因的TaSdr-B1B感穗发芽单倍型,频率为57.14 %。TaVp-1B基因分型结果发现,云麦39等29份品种(系)为TaVp-1B基因的Vp1B1c抗穗发芽单倍型,频率为69.05 %;云麦73等7份品种(系)为TaVp-1B基因的Vp1B1a感穗发芽单倍型,频率为16.67 %。
2.3 供试小麦品种(系)抗旱性和穗发芽抗性相关基因的分布
如表2所示,聚合3个抗旱性相关基因抗性单倍型(TaDREB-B1a/Westoniatype/Hap-4A-C)的小麦品种(系)有11份,分别是云麦42、云麦62、云麦68、云麦76、云15D4-15、云154-65、宜麦2号、保麦2号、靖麦12、靖麦14、楚麦16号,频率为26.19 %;聚合3个穗发芽抗性相关基因抗性单倍型(RioBlanceotype/TaSdr-B1a/Vp1B1c)的小麦品种(系)有10份,分别是云麦52、云麦76、云麦77、云麦78、云16D4-13、云6-14、云124-6、弥12V4-15、易122-329、保麦2号,频率为23.81 %;同时聚合抗旱性和穗发芽抗性相关基因6个有利单倍型(TaDREB-B1a/Westoniatype/Hap-4A-C/RioBlanceotype/TaSdr-B1a/Vp1B1c)的小麦品种(系)仅有云麦76和保麦2号2份品种,频率为4.76 %。

表2 42份云南小麦抗旱性和穗发芽抗性的KASP标记基因分型

续表2 Continued table 2
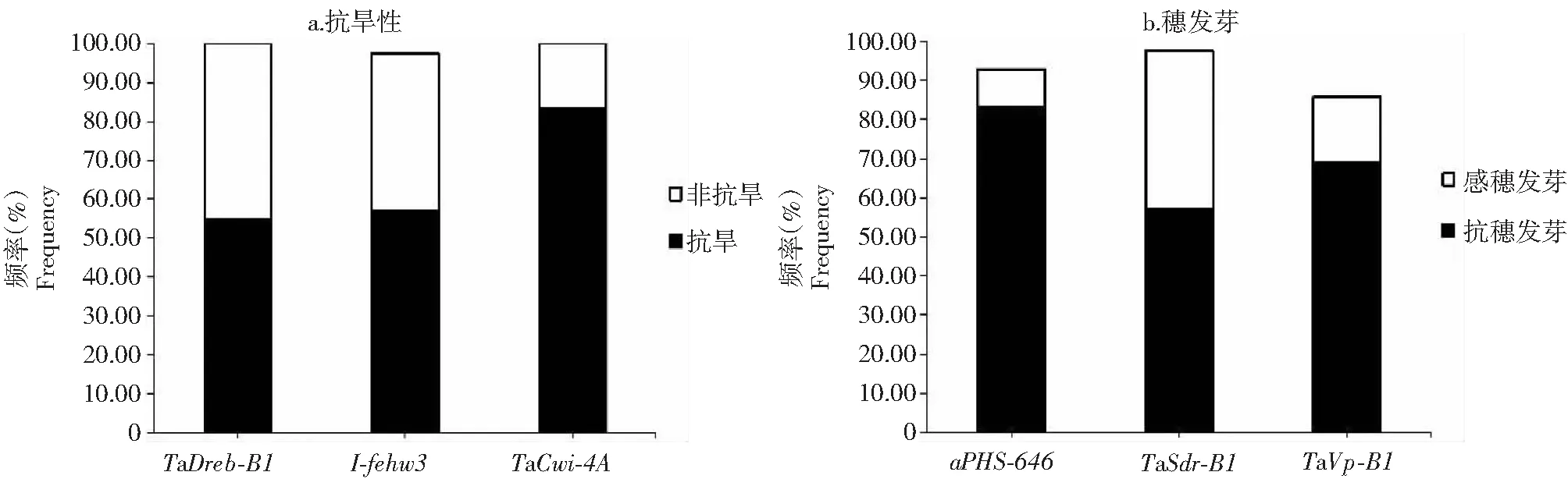
图1 42份云南小麦中抗旱性和穗发芽抗性相关基因的分布频率Fig.1 Frequency of genes associated with drought tolerance and PHS resistance in 42 wheat cultivars
3 讨 论
与传统SNP检测平台相比,高通量的KASP检测方法具有稳定性高、准确性高和低成本的特点[19]。Rasheed等[20]利用这一简便高效的技术,开发了70余个高通量KASP功能标记,可对小麦产量、品质、抗性和适应性等相关基因进行有效鉴定。邹景伟等[24]、张维军等[25]、杨子博等[26]、张宏军等[27]分别利用KASP功能标记对不同类型小麦品种的不同性状相关基因进行了检测分析,发现KASP标记辅助选择能显著地提高小麦育种效率。本研究利用KASP标记结合序列测定准确、快速地鉴定出云南小麦品种(系)的抗旱和抗穗发芽等抗逆性相关基因型,为云南小麦抗逆育种提供了材料和方法。
抗旱性和穗发芽抗性改良是小麦抗逆育种的重要育种目标,但小麦抗旱性、穗发芽抗性均属于多基因控制的数量性状,其抗性机理十分复杂[28]。云南小麦2/3以上种植于贫瘠山区旱地,受典型立体气候影响,生长阶段频发冬春季节性干旱,麦收季节受雨季影响易受穗发芽损害,因此抗旱、抗穗发芽等抗逆性状一直是云南小麦育种的关键选育目标,而明确云南育成小麦品种(系)中抗旱、抗穗发芽相关基因的组成分布,有助于今后云南小麦抗逆育种工作的开展。利用TaDreb_SNP标记、fehw3_SNP标记、CWI4A_SNP标记对42份供试品种(系)抗旱性相关基因型进行检测,筛选出含TaDreb-B1基因TaDREB-B1a耐旱单倍型的品种(系)23份、1-fehw3基因Westoniatype抗旱单倍型的品种(系)24份、TaCwi-4A基因Hap-4A-C抗旱单倍型的品种(系)35份,频率分别为54.76 %、57.14 %、83.33 %,研究结果表明云南小麦的总体抗旱性水平较高。
小麦穗发芽抗性相关基因多于种皮色泽、种子休眠、内源激素调控、α-淀粉酶活性等特性有关,仅有少数相关基因位点的遗传效应较大[24-25,29]。利用PHS_646标记、SDR_SNP标记、Vp1b1-83_IND标记对42份供试品种(系)抗穗发芽相关基因型进行检测,筛选出含TaVp-1B基因的Vp1B1c抗穗发芽单倍型的品种(系)29份,频率为69.05 %,接近于中国推广小麦品种抗穗发芽的平均频率71.7 %[29],但低于四川小麦品种抗穗发芽的平均频率83.8 %[30];筛选出含TaPHS_646基因RioBlanceotype抗穗发芽单倍型的品种(系)35份,频率为83.33 %,与邹景伟等[24]研究结果一致;筛选出含TaSdr-B1基因的TaSdr-B1a抗穗发芽单倍型的品种(系)17份,频率为40.48 %。研究结果显示云南小麦的总体穗发芽抗性水平较高。
从多基因聚合角度分析,11份品种(系)为3个抗旱基因TaDREB-B1a/Westoniatype/Hap-4A-C抗旱性单倍型组合,频率为26.19 %;10份品种(系)为3个抗穗发芽基因RioBlanceotype/TaSdr-B1a/Vp1B1c穗发芽抗性单倍型组合,频率为23.81 %;仅有云麦76和保麦2号聚合抗旱性和穗发芽抗性相关基因,为TaDREB-B1a/Westoniatype/Hap-4A-C/RioBlanceotype/TaSdr-B1a/Vp1B1c抗性单倍型组合,频率为4.76 %。上述品种可直接在今后抗旱性和抗穗发芽的聚合育种中作亲本利用,是云南小麦抗逆育种和品质改良的捷径。对比品种的实际抗旱性、穗发芽抗性与基因检测结果,发现部分品种存在不吻合的情况,如云麦54、云麦69和云麦72是云南省审定的典型旱地小麦品种,但检测为TaDREB-B1b/Kauztype非抗旱单倍型;检测为NW97S186type感穗发芽单倍型的凤麦32和凤麦36属于穗发芽抗性品种,检测为RioBlanceotype/Vp1B1c抗穗发芽单倍型的凤麦34属于感穗发芽品种,且穗发芽率大于98 %[31]。上述结果充分说明抗旱性和穗发芽抗性等抗逆性状均是由多基因位点控制的数量性状,品种实际抗逆性水平是多个基因调控的综合作用结果,品种抗逆性需兼顾表型和基因性进行综合评价,同时需大力发掘更多相关基因位点的功能,才能实现更好地在抗逆分子标记辅助育种中加以应用。
4 结 论
42份供试云南小麦品种(系)在抗旱性和穗发芽抗性等抗逆性状相关基因组成上具有丰富的多态性,在云南小麦抗逆育种中加大TaDreb-B1、1-feh-w3、TaCwi-4A、TaPHS1、TaSdr-B1、TaVp-1B等基因有利单倍型的聚合利用,可有效的综合提高云南小麦抗逆性。
