猪SUMO1基因的碱基序列特征及其在猪肺炎支原体感染过程中的表达
2020-12-09王丽杨晓阳曹静赵为民涂枫付言峰李碧侠陈哲任守文方晓敏
王丽 杨晓阳 曹静 赵为民 涂枫 付言峰 李碧侠 陈哲 任守文 方晓敏


摘要:根据NCBI 上GenBank 的猪类泛素蛋白修饰分子1(SUMO1)基因碱基序列(NM_001112676.1),设计编码区全长上、下游引物,成功克隆了猪SUMO1基因完整的编码区序列。经生物信息学软件分析发现猪SUMO1基因的蛋白质编码区(CDS) 全长306 bp,编码101个氨基酸,SUMO1 的蛋白质氨基酸序列在物种间高度保守。SUMO1基因在猪心、肝、脾、肺、肾、小肠及肌肉组织中均有表达,且在肺部表达较高。猪肺炎支原体感染原代猪肺泡巨噬细胞后SUMO1的mRNA表达水平显著升高。参与调控炎症反应的基因,如TLR2、P65和RXRα均存在潜在的SUMO化修饰位点,并且猪肺炎支原体感染后它们的mRNA表达水平极显著升高。
关键词:猪肺炎支原体;SUMO1;猪肺泡巨噬细胞;炎症反应
中图分类号:S858.286.3文献标识码:A文章编号:1000-4440(2020)05-1229-08
Abstract:The full-length upstream and downstream primers of SUMO1 (the gene of small ubiquitin-like modifier 1) were designed according to the base sequence of SUMO1 gene (NM_001112676.1) of GenBank on National Center for Biotechnology Information(NCBI) and the whole CDS(coding sequence) of porcine SUMO1 National Center for Biotechnology Information gene was cloned successfully. The results of bioinformatics software analysis showed that porcine SUMO1 gene-related protein CDS was 306 bp in length, encoded 101 amino acids and the amino acids sequence of SUMO1 protein was highly conserved among species. SUMO1 gene was expressed in porcine heart, liver, spleen, lung, kidney, small intestine and muscle, among which the relative expression of SUMO1 was higher in lung than in other tissues. After Mycoplasma hyopneumoniae infection, the mRNA expression level of SUMO1 was significantly increased in primary porcine alveolar macrophages. The potential SUMO modification sites were found in TLR2, P65 and RXRα genes, which participated in the regulation of inflammatory response. In addition, their mRNA expression levels were significantly up-regulated after Mycoplasma hyopneumoniae infection.
Key words:Mycoplasma hyopneumoniae;small ubiquitin-like modifier(SUMO1);porcine alveolar macrophages;inflammatory response
猪支原体肺炎,是由猪肺炎支原体(Mycoplasma hyopneumoniae, Mhp)感染引起的存在于各年龄段猪中的慢性接触性呼吸道传染病[1]。Mhp具免疫抑制和免疫逃避的特性,使该病难根治,需要长期消耗性的治疗,并且容易继发感染其他呼吸道相关病毒而造成死亡,是养猪业主要疫病之一[2-3]。近年来针对Mhp的致病机理和免疫防御等的研究取得了显著进展,但Mhp的耐药菌不断地出现,候选基因也不明确[4],其致病的分子机制研究相对还很缺乏,特别是对宿主炎症反应的调控机制以及如何诱导免疫抑制等问题尚未得到完全解析。
SUMO化修饰是一种高度动态可逆的类泛素化修饰方式,通过与多种底物的供价结合发挥功能。哺乳动物中已发现4种SUMO蛋白,即SUMO1、SUMO2、SUMO3和SUMO4,其中SUMO1与SUMO2和SUMO3的同源性只有50%左右[5]。SUMO化位点的预测主要是利用生物信息学与氨基酸位点定向诱变和基于质谱(MS)的蛋白质组学分析,蛋白质中存在SUMO修饰的保守序列ψKXE/D(ψ为疏水性氨基酸,X为任意氨基酸),则其中的赖氨酸是可能的SUMO修饰位点 [6]。SUMO蛋白可以调节蛋白质与蛋白质或DNA之间的相互作用,从而调控转录因子的活性;SUMO蛋白可以与泛素竞争性结合赖氨酸,从而维持靶蛋白的稳定性;介导蛋白质在核孔的穿梭,调节其在细胞中的定位[7-8],从而参与各种各样的生命活动如细胞的增殖分化、基因的表达、细胞器的合成、细胞的凋亡等。
SUMO化修饰参与调节炎症反应,宿主细胞被病毒感染后容易引起炎症反应,且其整体SUMO化修饰水平发生了明显的变化。SUMO蛋白可以对病毒本身的蛋白质或者宿主细胞中的蛋白质进行修饰,影响宿主细胞对病毒的防御能力 [8]。在乳腺癌细胞中SUMO1是调节炎症反应的关键因子,SUMO连接酶TRIM38可以调节先天性免疫和炎症反应。NEMO被SUMO化修饰后可以加强NF-κB的活性,促进NF-κB依赖性细胞因子的合成以及胰腺炎症反应[8]。但SUMO化修飾在猪肺炎支原体感染过程中的研究报道甚少。本研究克隆猪SUMO1基因的编码区序列,对其编码的氨基酸序列进行生物信息学分析,检测SUMO1在猪组织中的表达谱,并利用猪肺炎支原体J株感染原代猪肺泡细胞,分析细胞中SUMO1的表达变化规律,并检测炎症因子及相关因子的表达水平,为进一步研究类泛素化修饰在猪肺炎支原体感染中的作用机制奠定基础。
1材料与方法
1.1试验材料
1.1.1菌株及主要试剂试验用猪肺炎支原体为J菌株,由江苏省农业科学院兽医研究所馈赠,使用时菌株含量调整为1 ml 1×108CCU[9]。
限制性内切酶、T4连接酶、DNA marker、cDNA 反转录试剂盒、pMD19-T、预混PCR试剂盒和SYBR Green Real-time PCR Master Mix 定量PCR试剂盒购自TaKaRa公司,RNA提取和DNA回收试剂盒均购自北京天根生化科技有限公司,青链霉素和胎牛血清购自Thermo Fisher公司,RPMI-1640培养基与PBS缓冲液购自Hyclone公司。引物合成和测序均在擎科生物技术有限公司进行。
1.1.2试验组织样品试验用猪心、肝、脾、肺、肾、小肠及肌肉样品均采自南京六合屠宰场。
1.2方法
1.2.1原代猪肺泡巨噬细胞的分离及培养将猪肺脏取出后,用无菌绳子将气管结扎,再用清洗液(含双抗的PBS缓冲液)冲洗肺部表面,并用无菌纱布擦干。向气管中注入清洗液,每次50~100 ml,并轻轻揉捏肺脏表面,回收灌洗液,并利用70 μm细胞过滤器去除组织块状杂质,重复灌洗2~3次。在1 000 r/min转速下离心10 min,弃掉上清液,利用清洗液重复洗涤3次,最后将获得的猪肺泡巨噬细胞用含10%血清的RPMI-1640培养液重悬后铺于细胞培养皿中,置于5% CO2、37 ℃的细胞培养箱。培养1.5~2.0 h后从培养箱中取出培养皿,弃掉旧培养基,并利用清洗液润洗2~3次后加入预热的全新培养液培养。
1.2.2猪肺炎支原体感染原代猪肺泡巨噬细胞将猪肺炎支原体J株原液取出后置于离心管中,10 000 r/min离心20 min后弃上清液,再利用PBS悬浮后,10 000 r/min离心20 min后弃上清液,如此清洗1~2次后加入无双抗的细胞培养基悬浮。将悬液加入铺有原代猪肺泡巨噬细胞的细胞培养板中进行猪肺炎支原体感染,24 h后收集细胞样品进行后续处理。
1.2.3SUMO1基因的克隆根据NCBI 上GenBank 的猪SUMO1碱基序列(NM_001112676.1),设计编码区全长上、下游引物(表1)。PCR 扩增反应总体积为50 μl,包括:预混PCR反应液25 μl,ddH2O 16 μl,上、下游引物各2 μl,cDNA模板 5 μl。PCR 扩增反应条件为:95 ℃ 2 min后,进行33个循环(98 ℃ 30 s,60 ℃ 30 s, 72 ℃ 30 s),最后72 ℃ 10 min。将PCR 扩增产物参照DNA回收试剂盒说明书进行回收后,与pMD19-T 载体连接,转化到DH5α大肠杆菌中。37 ℃摇菌1 h后,将浑浊的菌液涂在含有氨苄抗性的固体培养基上,37 ℃培养,正置30 min后倒置12 h左右,随机挑取3~5个克隆置于液体培养基中摇菌6~8 h,菌液浑浊后测序。将测序正确的菌液进行扩大培养、质粒提取和保存。
1.2.4半定量PCR和实时荧光定量PCR检测基因表达收集猪不同组织的样品,提取RNA,浓度和质量测定达标后,反转录为cDNA,用半定量PCR 检测SUMO1在猪7种不同组织中的表达情况。利用表1中SUMO1定量引物和HPRT1内参引物进行PCR扩增, 反应体系总体积为20.0 μl,包括:预混PCR反应液10.0 μl,ddH2O 6.6 μl,上、下游引物各0.5 μl,cDNA 模板2.0 μl。PCR反应条件为:95 ℃ 2 min后,进行35个循环(95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s),最后72 ℃ 10 min。利用Image J软件分析琼脂糖凝胶电泳得到的目的条带的灰度值。
收集经过猪肺炎支原体处理和未处理的猪肺泡巨噬细胞,提取RNA,浓度和质量测定达标后,反转录为cDNA。利用表1中目的基因的定量引物和HPRT1内参引物进行荧光定量PCR扩增检测目的基因mRNA表达水平。反应体系为20 μl,退火温度为60 ℃,其他条件参照定量PCR 试剂盒说明书,将得到的Ct值采用2-△△Ct方法进行分析。定量PCR中每个样品3个重复。
1.2.5试验结果分析及预测软件试验中所有数据的差异分析均利用SPSS17.0软件进行,结果表示为平均值±标准差。利用SUMOsp2.0进行SUMO化位点预测。猪SUMO1蛋白生物信息学分析软件和网站参照赵为民等使用的分析软件和网站[10]。
2结果与分析
2.1猪SUMO1基因编码区的扩增及克隆
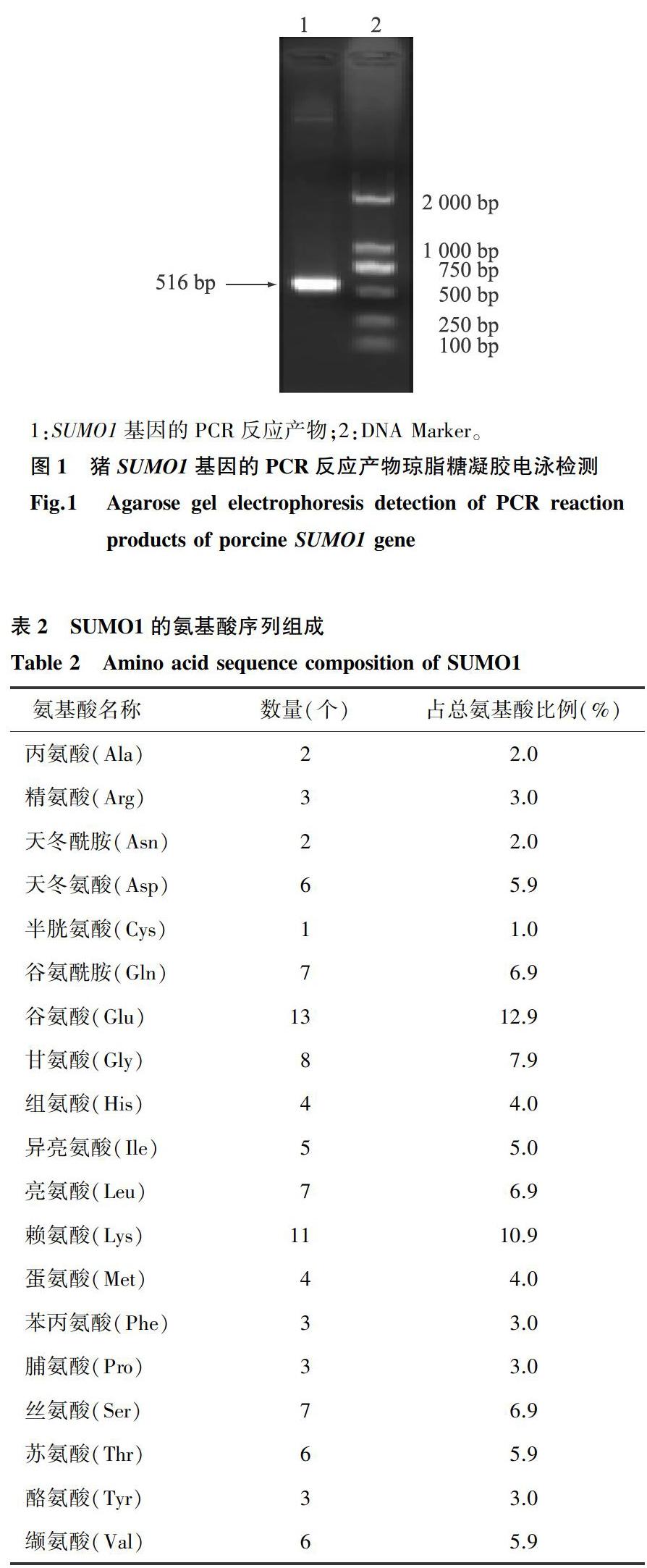
提取猪肺脏组织RNA,反转录为cDNA后进行PCR扩增,得到SUMO1基因的编码区全长序列。利用1.5%琼脂糖凝胶电泳检测PCR 扩增产物,如图1所示,在大约500 bp附近有单一目的条带,与预计片段大小516 bp基本相符。经回收、双酶切、连接、转化、铺板、挑菌、摇菌后进行菌液测序验证,成功克隆了猪SUMO1基因的编码区,全长为306 bp,起始和终止密码子分别为ATG和TAG,其中G+C含量为24.6%。
2.2猪SUMO1的蛋白质理化性质分析
2.2.1SUMO1的氨基酸序列分析结果(表2)显示:猪SUMO1由101个氨基酸组成,包含19种氨基酸。
2.2.2SUMO1的磷酸化位点预测如图2所示,猪SUMO1的氨基酸序列中存在磷酸化修饰的潜在位点。
2.2.3SUMO1的结构预测及分析分别用NPS@SOPMA和SWISS-MODEL预测SUMO1的二级结构(图3、表3)和三级結构(图4)。结果显示,无规则卷曲、α-螺旋和延伸链为SUMO1的二级结构的主要结构,占比达到91.08%,β-转角占比较小,为8.91%。
SignalP 4.1和TMHMM 2.0软件预测结果显示, SUMO1没有信号肽,也不存在跨膜结构,这符合SUMO1作为修饰性非分泌小分子蛋白质的特性。
2.2.4SUMO1的系统进化树分析在NCBI中查找了8 种代表性动物的SUMO1氨基酸序列,比对分析结果(图5)显示,预测的猪SUMO1氨基酸序列(NP_001106146.1)与人(NP_001005781)、小鼠(NP_033486.1)、大鼠(NP_001009672.1) 、猪(NP_001106146.1)、牛(NP_001030535.1)、猕猴(NP_001182571.1)和狗(NP_001239192.1)的SUMO1氨基酸序列相似性均为100%,而与鸡(NP_989466.1)的SUMO1氨基酸序列相似性也达到98%。系统进化树(图6)显示,猪SUMO1蛋白在进化中与其他6种哺乳动物的SUMO1蛋白聚为一大类,而鸡的SUMO1蛋白单独为一类。
2.3SUMO1在猪不同组织中的表达谱
利用猪不同组织的cDNA样品进行PCR扩增,检测结果如图7A所示,在 182 bp 处得到预期的单一SUMO1基因目的条带,以及单一的内参基因HPRT1条带。对组织表达谱的各个条带进行灰度值分析后得到图7B中的相对表达量,其中SUMO1在心、肝、脾、肺、肾、小肠及肌肉组织中均有表达,且在肺组织中表达量相对较高,推测其参与调控肺组织的生理功能。
2.4猪支原体肺炎感染原代猪肺泡巨噬细胞后SUMO1的mRNA表达水平
利用猪支原体肺炎J株对原代猪肺泡巨噬细胞进行感染处理24 h后,检测SUMO1的mRNA表达水平。结果显示猪肺炎支原体感染后SUMO1在原代猪肺泡巨噬细胞中的表达水平显著升高(图8),表明SUMO1的修饰作用可能参与猪肺炎支原体的感染。
2.5调控炎症反应因子表达的上游调控基因SUMO化修饰位点预测
在NCBI上查找到TLR2、NF-κB和RXRα的氨基酸序列,并利用SUMOsp 2.0软件分析预测它们可能的SUMO化修饰位点。结果如表4所示,TLR2、NF-κB和RXRα均存在潜在的SUMO化修饰位点,并均含有经典的SUMO修饰序列。
2.6猪支原体肺炎感染原代猪肺泡巨噬细胞后相关调控基因的mRNA表达水平
猪肺炎支原体感染原代猪肺泡巨噬细胞24 h后检测相关调控因子的表达情况,结果显示TLR2、P65和RXRα的mRNA表达水平均极显著性上调(图9)。
3讨论
猪肺炎支原体感染机体会造成细支气管和血管周围的巨噬细胞和淋巴细胞发生单核细胞浸润,引起炎症因子的表达和炎症反应[11-13]。将猪的免疫器官胸腺切除后,再接种猪肺炎支原体,其肺炎症状较未切除胸腺的猪轻,表明在猪支原体肺炎致病过程中免疫系统发挥着关键作用[14]。本研究分离培养了原代猪肺泡巨噬细胞,利用猪肺炎支原体J株进行感染,发现炎症因子IL-6及IL-8的mRNA表达水平极显著上调,说明猪肺炎支原体感染也会引起细胞水平的炎症反应。利用半定量PCR检测了SUMO1在猪不同组织中的表达谱,发现SUMO1在猪心、肝、脾、肺、肾、小肠及肌肉中均有表达,且在肺部SUMO1的表达量较其他组织高,说明SUMO1可能参与调控肺组织的生理功能。
为了研究猪SUMO1在肺组织中的功能,本研究首先克隆了猪SUMO1基因的碱基序列,其次利用生物信息学分析软件及网站预测分析了其基本属性。发现猪SUMO1基因的编码区长为306 bp,可以编码101个氨基酸。分析了8种不同物种,发现SUMO1蛋白氨基酸序列在它们中的相似度高达98%以上。系统进化树分析结果顯示猪SUMO1蛋白与其他6种哺乳动物的SUMO1蛋白聚为一类,而卵生动物鸡单独为一类。这表明作为蛋白质翻译后修饰的蛋白质分子,SUMO1氨基酸序列在物种间高度保守以保证其功能的保守。
机体的炎症反应受多种因子的调节,Toll样受体家族成员在先天性和适应性免疫引起的炎症反应中作为固有模式识别受体发挥着重要作用,其中TLR2的报道甚多,它可以激活先天性免疫反应,启动炎症反应[15-16]。在敲除TLR2后机体过敏性炎症反应会减轻[17]。TLR2可以调控NF-κB参与抗菌肽抵抗细菌对机体的侵袭,而NF-κB可以调控RXRα等核转录因子参与炎症反应的发生[9]。虽然TLR2、NF-κB和RXRα均参与机体的炎症反应调控,但它们在猪肺炎支原体感染过程中的作用还不明确。本研究发现猪肺炎支原体感染后原代猪肺泡巨噬细胞中这些调控基因(TLR2、NF-κB和RXRα)的表达水平均显著性上调。利用SUMOsp 2.0软件预测分析后发现这些调控因子均存在潜在的SUMO修饰位点。进一步分离培养原代猪肺泡巨噬细胞后利用猪肺炎支原体感染,发现SUMO1的表达水平显著升高,推测SUMO1在猪肺炎支原体感染过程中参与炎症反应的发生。
SUMO化修饰能通过直接或间接的方式影响NF-κB和RXRα的功能。在肺癌细胞中SUMO1与NF-κB的表达呈显著正相关关系,过表达SUMO1后NF-κB的表达水平显著上调,干扰SUMO1后NF-κB的表达水平显著下调[18]。这与乳腺癌细胞中去SUMO化蛋白SENP2可以抑制NF-κB的活化相符合[19]。利用LPS、IL-1β、TNFα诱导肝癌细胞产生炎症反应时,RXRα的K108残基可以被SUMO化修饰,并影响其下游基因的表达,其中LPS和IL-1β处理细胞后能诱导RXRα被SUMO1蛋白修饰,而TNFα处理后可以诱导RXRα被SUMO1和SUMO2蛋白修饰[20]。本研究中发现SUMO1与TLR2、NF-κB和RXRα的表达呈现正相关关系,有待进一步验证猪肺炎支原体感染过程中SUMO1通过调控TLR2、NF-κB和RXRα的功能参与调控猪肺炎支原体感染引起的炎症反应的推测。
参考文献:
[1]SIMIONATTO S, MARCHIORO S B, MAES D, et al. Mycoplasma hyopneumoniae: from disease to vaccine development [J]. Vet Microbiol, 2013, 165(3/4): 234-42.
[2]邵国青,华利忠.混合感染背景下猪呼吸道病的免疫与控制[J].中国兽药杂志,2012(46):97-99.
[3]MAES D, SIBILA M, KUHNERT P, et al. Update on Mycoplasma hyopneumoniae infections in pigs: Knowledge gags for improved disease control [J]. Transbound Emerg Dis, 2018, 65(Sup 1):110-124.
[4]OKAMURA T, ONODERA W, TAYAMA T, et al. A genome-wide scan for quantitative trait loci affecting respiratory disease and immune capacity in landrace pigs [J]. Animal Genetics, 2012, 43: 721-729.
[5]ENSERINK J M. Sumo and the cellular stress response [J]. Cell Div, 2015, 10:4.
[6]KLAUS S, PUCK K, EVERTVAN D, et al. SUMO Assay with peptide arrays on solid support: Insights into SUMO target sites [J]. The Journal of Biochemistry, 2008, 144(1):39-49.
[7]WANG C, ZENG N, LIU S, et al. Interaction of porcine reproductive and respiratory syndrome virus proteins with SUMO-conjugating enzyme reveals the SUMOylation of nucleocapsid protein [J]. PLoS One, 2017, 12(12):e0189191.
[8]YANG Y, HE Y, WANG X, et al. Protein SUMO ylation modification and its associations with disease [J]. Open Biol, 2017, 7(10):170167.
[9]ZHOU X, LI X, WANG X, et al. Cecropin B represses CYP3A29 expression through activation of the TLR2/4-NF-κB/PXR signaling pathway [J]. Science Reports, 2016,14(6):27876.
[10]趙为民,涂枫,方晓敏,等.猪PKM2基因的序列分析与组织表达及亚细胞定位[J].湖南农业大学学报,2019,45(1):8-77.
[11]方晓敏,赵为民,付言峰,等.猪支原体肺炎发生的品种敏感差异及分子基础[J].中国农业科学,2015,48(14):2839-2847.
[12]郭芸芸,张雪寒,刘茂军,等.猪肺炎支原体纤毛黏附因子P97和F7-CTB对O型口蹄疫灭活疫苗的免疫增强作用[J]. 江苏农业科学,2019,47(11):204-210.
[13]赵为民,涂枫,王丽,等. 猪PKM2基因在肺炎支原体感染3D4/21细胞后的互作蛋白质鉴定与分析[J].江苏农业学报, 2019,35(6):1381-1389.
[14]李彦伟,刘茂军,武昱孜,等.猪肺炎支原体致病机理研究进展[J].动物医学进展,2013,34(8):84-88.
[15]GOULOPOULOU S, MCCARTHY C G, WEBB R C. Toll-like receptors in the vascular system: sensing the dangers within [J]. Pharmacological Reviews, 2016, 68: 142-167.
[16]PAGE K, LIERL K M, HUGHES V S, et al. TLR2-mediated activation of neutrophils in response to German cockroach frass [J]. Journal of Immunology, 2008, 180: 6317-6324.
[17]LI X, CHEN Q, CHU C, et al. Ovalbumin-induced experimental allergic asthma is Toll-like receptor 2 dependent [J]. Allergy and Asthma Proceedings, 2014, 35: 15-20.
[18]KE C, ZHU K, SUN Y, et al. SUMO1 promotes the proliferation and invasion of non-small cell lung cancer cells by regulating NF-κB[J]. Thorac Cancer, 2019, 10(1):33-40.
[19]GAO X, WU Y, QIAO L, et al. SENP2 suppresses NF-κB activation and sensitizes breast cancer cells to doxorubicin[J]. Eur J Pharmacol, 2019, 854(5):179-186.
[20]REBECCA S, SAUL J. Inflammatory mediators increase SUMOylation of retinoid X receptor α in a c-Jun N- terminal kinase -dependent manner in human hepatocellular carcinoma cells [J]. Molecular Pharmacology, 2013, 84: 218-226.
(责任编辑:张震林)
