辽宁省番茄上番茄斑驳花叶病毒的分子鉴定
2020-12-09涂丽琴吴淑华高丹娜吉颖程兆榜周益军朱月林刘勇季英华
涂丽琴 吴淑华 高丹娜 吉颖 程兆榜 周益军 朱月林 刘勇 季英华

摘要:为明确2015年在辽宁省调查番茄病毒病时发现的病毒类型,对田间采集的番茄病样进行了分子检测。结果显示,在用烟草花叶病毒属通用检测引物进行RT-PCR扩增时22份样品中有6份扩增到800 bp左右的目的片段,扩增产物测序后BLAST分析结果表明它与已报道的番茄斑驳花叶病毒(Tomato mottle mosaic virus,ToMMV)(KF477193)同源性最高,为99.2%。为进一步确认,针对ToMMV编码的外壳蛋白(CP)设计了一对特异性引物,对样品进行RT-PCR检测,结果显示6份阳性样品都能扩增到目的条带,对其克隆测序后发现CP基因序列全长480 bp,编码1个相对分子质量约1.77×104的蛋白质,系统进化树表明该病毒与ToMMV的同源性最高,共同聚类于一个分支。这些结果表明在辽宁省番茄病株上检测到的病毒为ToMMV的1个分离物,这是在辽宁省番茄上发现番茄斑驳花叶病毒的首次报道。
关键词:番茄斑驳花叶病毒;分子鉴定;番茄
中图分类号:S436.412.1+1文献标识码:A文章编号:1000-4440(2020)05-1126-07
Abstract:To clarify the types of viruses found in the process of investigation on tomato virus diseases from Liaoning province in 2015, the infected tomato samples collected in the fields were detected by molecular methods. The results showed that the target fragment of approximately 800 bp long was amplified from six samples of twenty-two samples in the process of RT-PCR amplification, using universal primers for Tobamovirus. The amplified products were sequenced and the results of BLAST analysis showed that, the sequence showed the highest homology with the reported tomato mottle mosaic virus (ToMMV) (KF477193), with a value of 99.2%. To make further confirmation of the above result, a pair of specific primers based on coat protein (CP) sequence coded by ToMMV were designed and used to do RT-PCR detection of the samples. The results showed that the target band could be amplified from six positive samples. The cloning and sequencing results of the target band revealed that the full length of CP gene was 480 bp, encoding a protein with a relative molecular weight of approximately 1.77×104. The results of the phylogenetic tree indicated that the virus sequence showed the highest homology with ToMMV and they all clustered into one branch. The above results indicate that the virus detected in infected tomatoes from Liaoning is an isolate of ToMMV, and this is the first report of ToMMV found in tomatoes from Liaoning province.
Key words:tomato mottle mosaic virus;molecular identification;tomato
番茄(Solanum lycopersicum)为主要的茄科蔬菜作物之一,广泛种植于世界上多个国家与地区。目前已发现可感染为害番茄的病毒种类大概为146种[1],常见的有黄瓜花叶病毒(Cucumber mosaic virus,CMV)、烟草花叶病毒(Tobacco mosaic virus,TMV)、番茄花叶病毒(Tomato mosaic virus,ToMV)、烟草蚀纹病毒(Tobacco etch virus,TEV)、番茄斑萎病毒(Tomato spotted wilt virus,TSWV)、番茄黄化曲叶病毒(Tomato Yellow leaf curl virus,TYLCV)和番茄不孕病毒(Tomato aspermy virus,TAV)等[1-4]。2013年Li等[5]在墨西哥番茄上发现一种新病毒——番茄斑驳花叶病毒(Tomato mottle mosaic virus,ToMMV),该病毒侵染番茄会导致植株出现发育迟缓、顶端坏死等症状,病叶出现斑驳、皱缩和坏死等症状,其果实产量与品质显著下降,对番茄产量构成严重威胁[6],随后美国[7-8]、以色列[9]、西班牙[5]、巴西[10]等地陆续出现該病毒的危害报道。2014年中国西藏地区出现该病毒[11],之后云南、海南等地陆续出现该病毒[12-13],给各地的茄果类蔬菜作物生产造成了极大的影响。
ToMMV隶属于帚状病毒科(Virgaviridae)烟草花叶病毒属(Tobamovirus),为正义单链RNA(+ ssRNA)病毒,其基因组全长约为6 400 bp,含4个开放阅读框(Open reading frame,ORF)并编码4个大小各异的蛋白质,分别为1.83×105的RNA依赖的RNA聚合酶蛋白(RNA-dependent RNA polymerase,RdRP)、1.26×105的甲基转移酶/解旋酶蛋白(Methyltransferase/helicase)、2.98×104的运动蛋白(Movement protein,MP)以及1.77×104的外壳蛋白(Coat protein,CP)[13]。其中甲基转移酶/解旋酶蛋白由琥珀(UAG)终止密码子终止,RNA依赖的RNA聚合酶蛋白通过通读此终止密码子产生,这2个较大的蛋白质能组成RNA复制蛋白复合体,参与病毒的复制[14]。
2015年我们在开展辽宁省番茄病害的调查研究时观察到田间出现类似病毒感染症状的植株,病样采集后通过RT-PCR、基因克隆和测序等对其进行分子检测与鉴定。
1材料与方法
1.1供试病样
供试番茄病样于2015年7月采自辽宁省沈阳市(累计22份),以温室内培育的健康番茄为对照,病样采集后分别取100 mg至不同的磨样管中并做好标记,将磨样管置于液氮中进行速冻后快速将其置于-80 ℃冰箱。
1.2主要試剂与仪器
RNA提取液(RNAiso Plus)、反转录试剂盒PrimerScriptTM RT Master Mix (Perfect Real Time)、Ex Taq酶和基因克隆T载体pMD 18-T购自大连TaKaRa公司,2×Taq Master Mix购自南京Vazyme公司,大肠杆菌菌株Top10购自南京Warbio公司,质粒提取试剂盒和凝胶回收试剂盒购自美国Axygen公司,限制性内切酶BamH I购自美国New England Biolabs公司,引物送至上海Invitrogen公司合成,其余有机和无机试剂为国产分析纯。
全自动样品磨样仪(Tissue lyser-64)购自上海净信科技公司。
1.3病样总RNA提取
取-80 ℃冰箱中放置的番茄病样磨样管,经液氮冷冻后用全自动样品磨样仪将管中病样磨成粉末,按照Trizol法[15]利用RNAiso Plus提取番茄样品的总RNA,置于-80 ℃冰箱保存备用。
1.4病毒RT-PCR检测
利用番茄病样总RNA作模板,用PrimerScriptTM RT Master Mix(Perfect Real Time)试剂盒进行反转录。反转录体系(10 μl):2 μl 5×Primer ScriptTM RT Master Mix,病样RNA 500 ng,最后用RNase Free ddH2O补足至总体积为10 μl,轻轻混匀;反应程序:37 ℃ 15 min,85 ℃ 5 s,4 ℃结束,得到cDNA。随后对其进行PCR检测,PCR体系(20 μl):10 μl 2×Taq Master Mix,1 μl 10 μmol/L Tob-Uni1(表1),1 μl 10 μmol/L Tob-Uni2,1 μl cDNA,7 μl ddH2O,轻轻混匀;反应程序:94 ℃高温变性5 min;94 ℃ 45 s,49 ℃ 45 s,72 ℃ 55 s,33个循环;72 ℃ 5 min,4 ℃ 结束。取5 μl PCR反应产物于0.5×TAE电泳缓冲液中,用1%琼脂糖凝胶进行电泳分离,根据电泳结果将其产物送至测序公司测序。
1.5ToMMV CP基因克隆
根据番茄斑驳花叶病毒外壳蛋白序列设计特异引物ToMM CP_F和ToMM CP_R(表1),对上述检测结果为阳性的病样cDNA再次进行PCR扩增。PCR体系(25 μl):0.5 μl 5 U/μl Ex Taq,2.5 μl 10×Ex Taq Buffer(Mg2+ plus),1.0 μl 10 μmol/L ToMM CP_F,1.0 μl 10 μmol/L ToMM CP_R,0.5 μl 10 mmol/L dNTP mix,1.0 μl cDNA模板,18.5 μl ddH2O,轻轻混匀;反应程序:94 ℃ 5 min;94 ℃ 45 s,56 ℃ 45 s,72 ℃ 35 s,33个循环;72 ℃ 5 min,4 ℃ 保存。将扩增产物进行1%琼脂糖凝胶电泳检测,利用凝胶回收试剂盒回收凝胶中的扩增带。按照pMD 18-T载体连接试剂盒说明书将回收产物连接至T载体,其产物经42 ℃热激法转入大肠杆菌Top 10后涂于含200 mg/L氨苄青霉素(Ampicillin)的LB固体平板上,随后将其倒置于37 ℃ 恒温培养箱培养12 h左右,挑取LB板上的单克隆进行菌落PCR和单酶切验证,验证后送至测序公司进行序列测定。
1.6序列测定与分析
委托安徽通用生物有限公司对扩增序列进行测定。使用ClustalX、BioEdit和DNAstar分析软件以及NCBI上的BLAST程序(http://www.ncbi.nlm.nih.gov/BLAST/Blast.cgi)对序列进行比对等分析。使用MEGA6软件对其系统进化结果进行分析,进化树的置信度用1 000次Bootstrap评价。
2结果与分析
2.1疑似病毒病的番茄病害田间症状
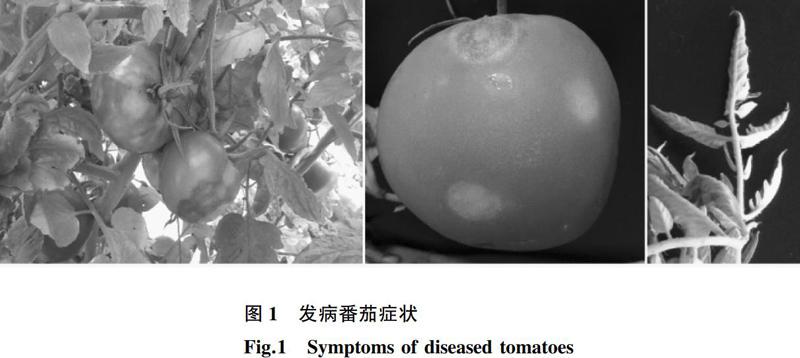
2015年7月,笔者在辽宁省进行番茄病害调查研究时发现当地番茄植株出现类似病毒病感染的症状,其果实呈现无规则坏死斑,早期呈灰白色,后期深褐色,有些病株会伴有叶片变小、皱缩和黄化等症状(图1)。病株果实的坏死斑硬化,坏死斑块上未发现霉层或菌核,初步怀疑是病毒病侵染危害。
2.2番茄病样中病毒的分子检测
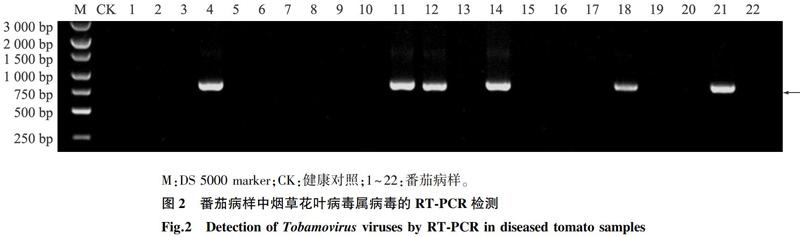
对番茄病样RNA进行RT-PCR检测以确定其感染的病毒种类。结果表明在利用烟草花叶病毒属(Tobamovirus)通用引物Tob-Uni1与Tob-Uni2进行检测时,采集的22份番茄样品中有6份样品扩增到约800 bp的目的条带,且健康番茄植株无该条带(图2),说明番茄病样中可能有烟草花叶病毒属病毒的感染。为进一步明确其病毒类型,我们抽选6份样品中的部分样品进行序列测定,序列BLAST分析结果显示其与ToMMV(KF477193,99.2%)的同源性最高,说明检测到的病毒可能是ToMMV的1个分离物。
2.3番茄病样中ToMMV的分子检测
为明确上述病毒是否为ToMMV的1个分离物,我们针对ToMMV CP基因设计出特异性扩增引物ToMM CP_F与ToMM CP_R。RT-PCR结果显示6份阳性样品都能扩增到和预期目的片段大小(480 bp)接近的特异性条带(图3),表明该条带为特异性的CP基因扩增条带。这进一步说明辽宁省番茄病样中检测到的病毒可能是ToMMV。
2.4番茄病样ToMMV CP基因序列分析
对所有阳性样品扩增到的ToMMV CP基因片段进行克隆,并随机选取3个样品(样品4、12、18)进行Bam H I单酶切验证(图3)。对6个阳性样品的ToMMV CP基因克隆进行序列测定,分析结果表明其序列全长480 bp,编码1个大小约1.77×104的蛋白质。序列比对分析结果显示6个分离物之间的同源性在99.4%至100.0%之間,BLAST分析结果表明它们与ToMMV的同源性最高,表明该病毒属ToMMV分离物。
为进一步解析其分类地位,利用MEGA6将本试验测定序列与目前已公布的ToMMV CP序列(表2)比对后进行聚类分析,以同属的ToMV(NC_002692)、番茄褐色皱纹果病毒(Tomato brown rugose fruit virus,TBRV)(NC_028478)、地黄花叶病毒(Rehmannia mosaic virus,RheMV)(NC_009041)、TMV(NC_001367)作为外群,使用Kimura 2- parameter模型和临近法(Neighbor-Joining,NJ)重建系统进化树(图4)。结果表明本研究测定的6个分离物(4、11、12、14、18、21)的CP序列全部聚类到ToMMV分支中,与其他ToMMV分离物的同源性在98.5%至99.8%之间。这些结果进一步说明辽宁省番茄上检测到的病毒为ToMMV。
3讨论
番茄斑驳花叶病毒是近年来新发生的一种植物病毒,对多个国家包括番茄在内的多种作物造成了严重损失。中国自2014年首次报道该病毒发生危害以来,目前至少已有7个省(市)出现该病毒发生危害[11-13],其中番茄上仅海南有发生危害的报道[17]。本研究2015年在对辽宁省番茄上病毒病进行调查时,在当地番茄上检测到ToMMV,为辽宁省番茄上发现该病毒的首次报道。
除番茄[12]外,也有报道显示ToMMV自然条件下还可以侵染危害辣椒[11]、茄子[13]等茄果类蔬菜作物,而室内接种试验结果显示ToMMV除侵染危害上述作物外,还可以侵染假酸浆、酸浆、矮牵牛、本氏烟、黄花烟草、大白菜、青菜、萝卜、青花菜、花椰菜、油菜、拟南芥、野生昆诺黎等多种植物[5,11]。ToMMV作为烟草花叶病毒属成员之一,它亦可以通过汁液摩擦等方式传播扩散,而且有些作物上已有报道种子亦可携带病毒[18],因而其寄主种类与范围可能比较广泛[11]。在对不同品种之间的抗病性进行评估时发现ToMMV比ToMV更容易侵染一些番茄品种,并产生更严重的症状[19]。因此在生产上要密切关注ToMMV的发生动态,加强种苗检疫,早发现,早防控,减少损失。
番茄是公认的世界范围广泛种植的重要蔬菜作物之一,生产中已发现的能侵染并危害番茄的病毒种类多达146种[1,20-22],这些病毒通过单独侵染或复合侵染的方式危害番茄,严重影响其产量和品质,降低其经济价值,从而限制番茄产业的发展。因此本研究在对辽宁省番茄上病毒病进行调查时,除ToMMV外,也对采集的病样中的其他病毒如烟草花叶病毒、番茄花叶病毒、黄瓜花叶病毒等进行了检测,在有些病样中也检测到番茄花叶病毒等病毒。这些结果一方面说明当地番茄上病毒种类可能比较复杂,要明确当地番茄上病毒种类需要更广泛的样本采集及更系统的病毒种类调查;另一方面本研究从田间采集的病样中检测到ToMMV,但ToMMV是否为导致番茄出现田间症状的主要原因还有待于进一步的病毒分离及回接试验验证。
参考文献:
[1]HANSSEN I M, LAPIDOT M, THOMMA B P. Emerging viral diseases of tomato crops[J]. Molecular Plant-Microbe Interactions, 2010, 23: 539-548.
[2]MOUSSA A B, MAKNI M, MARRAKCHI M. Identification of the principal viruses infecting tomato crops in Tunisia[J]. European and Mediterranean Plant Protection Organization Bulletin, 2010, 30(2): 293-296.
[3]PARRELLA G, CRESCENZI A. The present status of tomato viruses in Italy[J]. Acta Horticlturae, 2005, 695: 37-42.
[4]MASSUMI H, SHAABANIAN M, POUR A H, et al. Incidence of viruses infecting tomato and their natural hosts in the southeast and central regions of Iran[J]. Plant Disease, 2009, 93(1): 67-72.
[5]LI R, GAO S, FEI Z, et al. Complete genome sequence of a new tobamovirus naturally infecting tomatoes in Mexico[J]. Genome Announcements, 2013, 1(5): e00794.
[6]AMBRS S, MARTNEZ F, IVARS P, et al. Molecular and biological characterization of an isolate of Tomato mottle mosaic virus (ToMMV) infecting tomato and other experimental hosts in eastern Spain[J]. European Journal of Plant Pathology, 2017, 149(2): 261-268.
[7]FILLMER K, ADKINS S, PONGAM P, et al. Complete genome sequence of a Tomato mottle mosaic virus isolate from the United States[J]. Genome Announcements, 2015, 3(2): e00167-15.
[8]PADMANABHAN C, ZHENG Y, LI R, et al. Complete genome sequence of a tomato-infecting tomato mottle mosaic virus in New York[J]. Genome Announcements, 2015, 3(6): e01523-15.
[9]TURINA M, GERAATS B P J, CIUFFO M. First report of tomato mottle mosaic virus in tomato crops in Israel[J]. New Disease Reports, 2016, 33: 1.
[10]NAGAI A, DUARTE L, CHAVES A, et al. First Complete genome sequence of an isolate of tomato mottle mosaic virus infecting plants of Solanum lycopersicum in South America.[J]. Genome Announcements, 2018, 6(19): e00427-18.
[11]LI Y Y, WANG C L, XIANG D, et al. First report of tomato mottle mosaic virus infection of pepper in China[J]. Plant Disease, 2014, 98(10): 1447.
[12]LI Y Y, WANG Y, HU J, et al. The complete genome sequence, occurrence and host range of tomato mottle mosaic virus Chinese isolate[J]. Virology Journal, 2017, 14(1): 15.
[13]CHE H Y, LUO D Q, CAO X R, et al. First report of tomato mottle mosaic virus in tomato crops in China[J]. Plant Disease, 2018, 102(10): 2051.
[14]LARTEY R T, VOSS T C, MELCHER U. Tobamovirus evolution: gene overlaps, recombination, and taxonomic implications[J]. Molecular Biology and Evolution, 1996, 13(10): 1327-1338.
[15]吳淑华,赵文浩,李廷芳,等. 南京辣椒上一种斑驳类型病毒病的分子鉴定[J]. 江苏农业学报, 2015, 31(6): 1284-1290.
[16]LETSCHERT B, ADAM G, LESEMANN D E, et al. Detection and differentiation of serologically cross-reacting tobamoviruses of economical importance by RT-PCR and RT-PCR-RFLP[J]. Journal of Virological Methods, 2002, 106(1): 1-10.
[17]ZHAN B H, CAO N, WANG K N, et al. Detection and characterization of an isolate of tomato mottle mosaic virus infecting tomato in China[J]. Journal of Integrative Agriculture, 2018, 17(5): 1207-1212.
[18]LOVELOCK D A, KINOTI W M, BOTTCHER C, et al. Tomato mottle mosaic virus intercepted by Australian biosecurity in Capsicum annuum seed[J]. Australasian Plant Disease Notes, 2020, 15(1): 8.
[19]NAGAI A, DUARTE L M L, CHAVES A L R, et al. Tomato mottle mosaic virus in Brazil and its relationship with Tm-22 gene[J]. European Journal of Plant Pathology, 2019, 155: 353-359.
[20]鲁清华,张宇,张松柏,等. 湖南省长沙市番茄黄化曲叶病毒的检测与系统发育分析[J]. 南方农业学报,2018, 49(7):1332-1337.
[21]郑雪,陈勇,郑立敏,等. 番茄环纹斑点病毒侵染辣椒挥发物成分分析及对西花蓟马行为反应影响[J].山东农业科学,2018, 50(11):111-115.
[22]姜静,王银磊,李亚茹,等. 江苏省及其他地区番茄黄化曲叶病毒的分子鉴定及序列分析[J].江苏农业学报,2018,34(1):238-240.
(责任编辑:张震林)
