氨态氮浓度和收割频率对绿狐尾藻根系泌氧特性的影响
2020-12-09黄鑫星蒋家陆罗沛李红芳张树楠刘锋何铁光肖润林吴金水
黄鑫星 蒋家陆 罗沛 李红芳 张树楠 刘锋 何铁光 肖润林 吴金水


摘要:植物根系泌氧特性对人工湿地微环境的状态以及污染物去除至关重要。本研究采用室内培养试验,分析0~200 mg/L氨态氮和2种收割频率下的绿狐尾藻根系泌氧特性,并探究植物株高、单株生物量、根孔隙度等对根系泌氧特性的影响。结果表明,经过29 d的培养,在0 mg/L、50 mg/L、100 mg/L和200 mg/L氨态氮处理下绿狐尾藻根系泌氧速率分别为8.6 μmol/(h·g)、14.1 μmol/(h·g)、14.6 μmol/(h·g)和7.7 μmol/(h·g)。除培养第15 d外,50 mg/L和100 mg/L氨态氮处理的绿狐尾藻根系泌氧速率随培养时间的增加而逐渐增加。收割处理会降低綠狐尾藻根系泌氧速率,根系泌氧速率表现为:未收割对照>14 d收割一次处理>7 d收割一次处理,收割频率高的绿狐尾藻根系泌氧速率较低。适宜的氨态氮质量浓度及收割频率有利于植物生长和恢复,过高的氨态氮质量浓度或收割频率会降低植物根孔隙度和株高,从而减少根系泌氧速率。相关性分析结果表明,绿狐尾藻根系泌氧速率与其根孔隙度、株高和单株生物量显著正相关(P<0.01),说明根系泌氧速率取决于作物自身生长状态和根系特征。在湿地运行管理中,适当调节进水氮负荷和植物收割频率有利于优化植物生长状况和根系泌氧特性,从而改善湿地环境。
关键词:根系泌氧;氨态氮;收割频率;绿狐尾藻
中图分类号:X171;X52文献标识码:A文章编号:1000-4440(2020)05-1112-07
Abstract:The root radial oxygen loss characteristics of plants are important for the state of microenvironment and pollutant removal in constructed wetlands. In this study, an indoor incubation experiment was used to explore the radial oxygen loss characteristics of Myriophyllum aquaticum under the treatments of 0-200 mg/L ammonia nitrogen and two harvesting frequencies, and the effects of plant height, biomass of single plant and root porosity on the radial oxygen loss characteristics were analyzed. The results showed that after 29-day incubation, the radial oxygen loss rates of M. aquaticum treated with 0 mg/L, 50 mg/L, 100 mg/L and 200 mg/L ammonia nitrogen were 8.6 μmol/(h·g), 14.1 μmol/(h·g), 14.6 μmol/(h·g) and 7.7 μmol/(h·g), respectively. Expect for the 15th day of cultivation, the radial oxygen loss rate of M. aquaticum under 50 mg/L and 100 mg/L ammonia nitrogen treatments gradually increased with the increase of culture time. The rate of radial oxygen loss of M. aquaticum was decreased under harvesting treatment, and the radial oxygen loss rate followed the order of the non-harvesting >harvesting once every 14 days >harvesting once every seven days. The lower radial oxygen loss rate was observed in the higher harvesting frequency treatment. These results indicated that proper ammonia nitrogen concentration and harvesting frequency were conducive for plant growth and recovery. Too high ammonia nitrogen concentration or harvesting frequency could reduce the root porosity and plant height, thus reducing the rate of radial oxygen loss. Correlation analysis results indicated that the radial oxygen loss rate of M. aquaticum had a significantly positive correlation with root porosity, plant height and biomass of single plant (P<0.01), showing that the rate of radial oxygen loss depended on plant growth condition and root characteristics. Adjusting the influent nitrogen load and plant harvesting frequency is beneficial to optimize the plant growth status and radial oxygen loss characteristics and improve the wetland environment during the operation and management of constructed wetlands.
Key words:radial oxygen loss;ammonia nitrogen;harvesting frequency;Myriophyllum aquaticum
人工湿地具有处理效果好,管理运行方便,成本低等优点,广泛应用于废水处理[1]。水生植物是人工湿地的重要组成部分,根系泌氧使植物根际形成了氧扩散层,周围基质环境处于好氧状态,利于根际好氧微生物的生长[2-3],加速污染物的降解[4-5]。因此,研究湿地植物根系泌氧特征对于改善湿地微环境,提高污染物去除效率具有重要意义。
前人的大量研究结果表明,湿地植物根系泌氧速率不仅受植物生理特性,如通气组织、生物量、根系特征和根系活性等的影响[6-7],也受外界环境(水质、光照、温度)和植物管理措施等的影响[8-13]。Norio等[8]发现环境温度从20 ℃升高到30 ℃,芦苇(Phragmites australis)的根系泌氧速率降低21%~26%,温度升高会改变芦苇的光合作用和蒸腾作用,从而影响根系泌氧速率。Inoue等[9]发现光照度降低,东方香蒲(Typha orientalis Presl)的根部泌氧速率降低。黄丹萍等[10]的研究结果表明,高氮磷环境会促进菖蒲根系通气组织形成,增加根系泌氧量。本研究团队前期研究发现,绿狐尾藻(Myriophyllum aquaticum)能耐受高质量浓度氨态氮(>200 mg/L),生长速度快,构建的表面流人工湿地对污水的净化能力强[11-12]。绿狐尾藻湿地同步发生硝化-反硝化作用,这可能源于绿狐尾藻的根系泌氧特性[13],因此有必要對其根系泌氧特性进行研究,特别是在不同氨态氮环境下的根系泌氧速率。绿狐尾藻多次收割可提高人工湿地的净化能力,多次收割处理下植物吸收的氮、磷量占其总去除量的22%~60%[14-15]。Wang等[16]发现,完全收割或部分收割芦苇地上部分会显著降低其根系泌氧速率。收割频率对绿狐尾藻根系泌氧特性的影响需要进一步研究。
鉴于此,本研究拟以绿狐尾藻为研究对象,采用室内培养试验,研究不同质量浓度氨态氮(0 mg/L、50 mg/L、100 mg/L、200 mg/L)和收割频率(7 d收割1次和14 d收割1次)处理下绿狐尾藻根系泌氧速率的变化,探讨植物株高、单株生物量、根孔隙度等对根系泌氧特性的影响,以期深入解析人工湿地污染物的去除机理,为人工湿地技术在废水处理中的实际应用提供理论依据。
1材料与方法
1.1试验设计
采集株高为20~30 cm的绿狐尾藻,依次用自来水和蒸馏水清洗,然后置于1/10 Hoagland营养液中培养10 d。
选取生长状况一致的500 g绿狐尾藻(单株生物量约为5 g,共100株),置于盛有50 L 1/10 Hoagland营养液(氮营养除外)的塑料桶中,每3 d换一次营养液。选取(NH4)2SO4作为NH+4-N来源,设置氨态氮质量浓度为0 mg/L、50 mg/L、100 mg/L、200 mg/L 4个处理,每个处理设置3个重复。于培养的第1 d、第8 d、第15 d、第22 d和第29 d,每桶采集4株绿狐尾藻,记录株高和单株生物量,并测量其根系泌氧速率和根孔隙度。
从预先培养10 d的绿狐尾藻中选择生长状况一致的500 g绿狐尾藻(单株生物量约为5 g,共100株),置于盛有50 L 1/10 Hoagland营养液的塑料桶中,每3 d换一次营养液。采用2种收割频率:7 d收割一次(共收割5次,分别为培养的第1 d、第8 d、第15 d、第22 d、第29 d)和14 d收割一次(共收割3次,分别为培养的第1 d、第15 d、第29 d),收割绿狐尾藻的地上部分并记录收割生物量。同时设置未收割组作为对照(CK),每个处理设置3个重复。收割后的第2 d采集绿狐尾藻,每次采集4株,测定植物株高、单株生物量、根系泌氧速率和根孔隙度。
1.2根系泌氧速率和根孔隙度测定
采用柠檬酸钛比色法[17]测定绿狐尾藻的根系泌氧速率。预先将400 ml 1/10 Hoagland营养液置于棕色检测瓶中,用氮气吹脱4 h以上去除溶解氧,加入20 ml柠檬酸钛溶液混匀备用。将绿狐尾藻置于400 ml营养液中,用液体石蜡密封。在实验室条件下培养6 h,轻轻晃动检测瓶混匀溶液,取2 ml溶液用分光光度计于527 nm下测定吸光度,根据标准曲线计算根系释放氧气量,用根部干质量计算根系泌氧速率。设置不含植物的处理作为空白对照,所有操作均在惰性气体操作箱内进行。
采用Kludze等[18]的方法测定绿狐尾藻根孔隙度。将25 ml比重瓶装满水,称质量记为ρ,用干净滤纸吸去植物根系表面水分,然后称取0.3 g并置入装满水的比重瓶中,称质量记为ρr,然后抽真空2 h,取出根系用研钵磨碎后再放入比重瓶,装满水后称质量,记为ρgr。根孔隙度(ρor)采用下面公式计算:
1.3数据分析
利用软件Microsoft Excel 2007整理试验数据并计算,用Origin 2017软件制作图表,采用最小显著性差异法进行差异分析,用皮尔逊法进行相关性分析。
2结果与分析
2.1不同氨态氮质量浓度和收割频率下绿狐尾藻的生长特征
根孔隙度、株高和单株生物量是植物重要的生长指标。图1显示,经过29 d培养,50 mg/L和100 mg/L氨态氮处理的绿狐尾藻根孔隙度从初始的6.2%和6.2%分别增加到19.7%和20.3%。200 mg/L氨态氮处理的绿狐尾藻根孔隙度随培养时间的增加总体呈先增加后降低的趋势。经过29 d培养,0 mg/L、50 mg/L、100 mg/L和200 mg/L氨态氮处理绿狐尾藻株高分别为82 cm、94 cm、100 cm和75 cm,单株生物量分别为19 g、27 g、32 g和22 g。
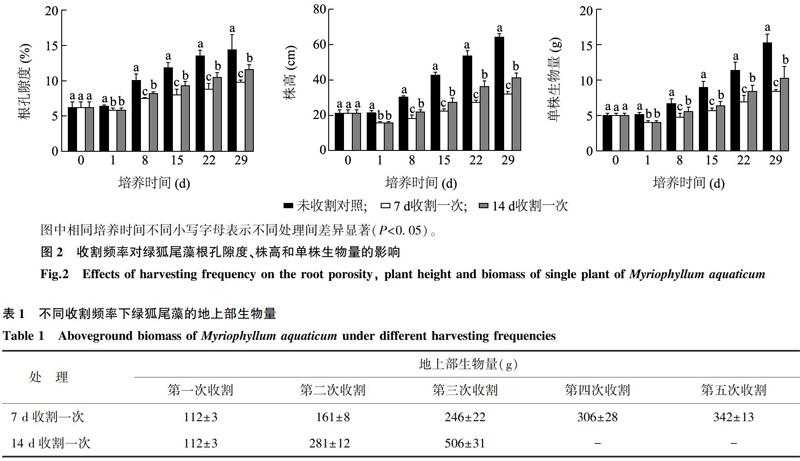
图2显示,未收割组的绿狐尾藻根孔隙度(6.2%~14.4%)大于收割组(5.8%~11.6%),并且14 d收割一次组(5.8%~11.6%)大于7 d收割一次组(5.8%~9.8%)。经过29 d培养,绿狐尾藻的株高表现为未收割组(62 cm)>14 d收割一次组(41 cm)>7 d收割一次组(32 cm),单株生物量表现为未收割组(15 g)>14 d收割一次组(10 g)>7 d收割一次组(8 g)。
表1显示,绿狐尾藻生长迅速,再生能力强。相同生长期下,绿狐尾藻的地上部生物量随收割次数的增加而增加,多次收割提高了其地上部分的再生能力。
2.2氨态氮质量浓度对绿狐尾藻根系泌氧速率的影响
图3显示,在培养第8 d和第15 d,绿狐尾藻根系泌氧速率随氨态氮质量浓度的增加而增加。在培养第22 d和第29 d,与100 mg/L氨态氮处理相比,200 mg/L氨态氮处理的绿狐尾藻根系泌氧速率明显降低。在200 mg/L氨态氮处理下,培养至第29 d,绿狐尾藻根系泌氧速率从第15 d的9.2 μmol/(h·g)降低至7.7 μmol/(h·g),低于0 mg/L、50 mg/L、100 mg/L处理[根系泌氧速率分别为8.6 μmol/(h·g)、14.1 μmol/(h·g)、14.6 μmol/(h·g)],说明适当质量浓度的氨态氮有利于植物生长,可以增加根系泌氧速率,过高质量浓度氨态氮处理降低植物根系泌氧速率。除第15 d外,50 mg/L和100 mg/L氨态氮处理的绿狐尾藻根系泌氧速率随培养时间的增加而逐渐增加。
2.3收割频率对绿狐尾藻根系泌氧速率的影响
图4显示,在培养第1 d至第29 d,与未收割对照相比,收割处理的绿狐尾藻根系泌氧速率显著降低(P<0.05)。第一次收割(培养第1 d)后,绿狐尾藻根系泌氧速率从原来的4.1 μmol/(h·g)降低到3.0 μmol/(h·g),降低了26.8%。第二次收割后,收割频率为14 d一次(培养第15 d)的绿狐尾藻根系泌氧速率为4.1 μmol/(h·g),比未收割对照 [6.7 μmol/(h·g)]低38.8%。第二次收割后,收割频率为7 d一次(培养第8 d)的绿狐尾藻根系泌氧速率为3.3 μmol/(h·g),比未收割对照[6.9 μmol/(h·g)]低52.2%。培养至第29 d,相同培养时间下,14 d收割一次处理的绿狐尾藻根系泌氧速率[3.8~5.2 μmol/(h·g)]比7 d收割一次处理[3.3~4.2 μmol/(h·g)]高15.0%~31.0%,说明收割频率越高,绿狐尾藻根系泌氧速率的降低程度越大。
2.4绿狐尾藻根系泌氧速率与其生长特征的相关关系
表2显示,未收割对照和不同收割频率处理的绿狐尾藻根系泌氧速率均与根孔隙度、株高和单株生物量均显著正相关(P<0.01),相关系数分别为0.809、0.620、0.657和0.972、0.873、0.744。说明根系泌氧速率受根孔隙度、株高和单株生物量的共同影响。
3讨论
本研究发现50 mg/L和100 mg/L氨态氮处理有利于绿狐尾藻的生长和发育,其株高、单株生物量和根孔隙度均高于0 mg/L氨态氮处理,200 mg/L氨态氮处理单株生物量在培养期前15 d增长迅速,然后开始下降。说明施用适宜质量浓度的氨态氮能促进绿狐尾藻的生长发育,但环境中氨态氮质量浓度过高时,长时间胁迫就会产生毒害作用,抑制植物的光合作用和呼吸作用,植物体内叶绿素、可溶性糖含量均降低[12],植物生长发育受到抑制,进而影响其生理机能。
在本研究中,不同质量浓度氨态氮处理的绿狐尾藻根系泌氧速率存在差异。氨态氮浓度从0 mg/L增加到100 mg/L,绿狐尾藻的根系泌氧速率明显增加,表明施用适宜质量浓度的氨态氮有利于提高绿狐尾藻的根系泌氧速率,这可能是因为供应适量氮源有利于绿狐尾藻的快速生长和发育[19]。此外,植物根孔隙度、株高和单株生物量的增长,有利于氧气从上到下的传输,提高根系泌氧速率。Mei等[20]也报道了相似的结果:美人蕉(Canna indica)在50%浓度的废水中培养35 d后,其根系泌氧速率[5.5 μmol/(h·g)]小于在营养液中培养的美人蕉[6.1 μmol/(h·g)]。在本研究中,200 mg/L氨态氮处理培养29 d的绿狐尾藻根孔隙度、株高和根系泌氧速率低于0 mg/L氨态氮处理。200 mg/L氨态氮胁迫下,绿狐尾藻体内丙二醛含量升高,抗氧化酶活性随之升高,破坏其主要生理机能[21],抑制植株的正常生长,影响根系泌氧功能。
绿狐尾藻根系泌氧速率与其单株生物量、株高和根孔隙度显著正相关(P<0.01),表明根系泌氧速率与其自身生长特性有关。植物根系泌氧速率是由植物茎叶光合作用、通气组织结构和根孔隙度等共同决定的。湿地植物茎叶光合作用是体内氧的重要来源,茎叶生物量决定其光合产氧量及通气量[22],即植物地上部生物量越大,其根系泌氧量越多。植物发育程度和通气组织结构随株高增加而完善,其产生和运输氧气的能力增强。根孔隙度的大小直接决定了氧气从根系向外扩散和传输的效能。Bezbaruah等[23]发现,对于根系相似的植物,其地上部分生物量越大,释放的氧气量就越多。王文林等[24]发现,菖蒲成株(株高为61 cm)的根系氧扩散层厚度较幼苗(株高为15 cm)显著增加(P<0.01)。张权等[25]发现,西伯利亚鸢尾、风车草、芦竹和腺柳的根系泌氧速率與其孔隙度呈显著正相关(P<0.01)。但是,马涛等[26]指出凤尾莲根系泌氧速率随着生物量增加而减小。Wang等[27]的研究结果表明,芦苇根系泌氧速率与生物量的相关性较低,与株高呈显著负相关。这可能是因为绿狐尾藻、芦苇和凤尾莲的根系存在差异,绿狐尾藻的不定根和侧根多,氧气从地上部传输至根部的距离近,氧气损耗少,而芦苇和凤尾莲为根茎类植物,不定根较少,根粗壮,氧气从地上部传输至根部距离较远,氧气损耗多[28]。
本試验结果表明,收割处理显著降低了绿狐尾藻的根系泌氧速率。一方面收割处理减少了来源于植物光合作用的氧气,新生枝叶的生长减少氧气在体内的运输量,降低根系释放的氧气量;另一方面收割降低了绿狐尾藻根孔隙度。有研究结果表明,冬季收割芦苇地上部分会降低根系泌氧速率,收割后根系泌氧速率显著低于未收割对照[16]。本研究中,14 d收割一次处理的绿狐尾藻根系泌氧速率高于7 d收割一次处理,收割频率越高,对绿狐尾藻生长的影响越大。高频率的收割会降低绿狐尾藻恢复速度,根系泌氧能力也降低。此外,收割处理也会改变根系泌氧速率与相关参数的相关性,说明采用这些参数评估植物的根系泌氧速率时应考虑植物的生长和管理情况。合理的收割可以去除植物体内的氮、磷等营养物质[29],提高好氧微生物活性,使湿地保持较高的污染物去除效率[30]。因此,在人工湿地运行和管理中,应权衡植物收割策略和湿地污染物去除效率,以保证人工湿地达到最优状态。
参考文献:
[1]VYMAZAL J. Constructed wetlands for wastewater treatment: five decades of experience[J]. Environmental Science & Technology, 2011, 45(1): 61-69.
[2]FITZ W J, WENZEL W W. Arsenic transformations in the soil-rhizosphere-plant system: fundamentals and potential application to phytoremediation[J]. Journal of Biotechnology, 2002, 99(3): 259-278.
[3]VISSER E J W, COLMER T D, BLOM C, et al. Changes in growth, porosity, and radial oxygen loss from adventitious roots of selected mono-and dicotyledonous wetland species with contrasting types of aerenchyma[J]. Plant Cell and Environment, 2000, 23(11): 1237-1245.
[4]吴海明,张建,李伟江,等. 人工湿地植物泌氧与污染物降解耗氧关系研究[J]. 环境工程学报, 2010, 4(9): 1973-1977.
[5]LI Y L, WANG X X. Root-induced changes in radial oxygen loss, rhizosphere oxygen profile, and nitrification of two rice cultivars in Chinese red soil regions[J]. Plant and Soil, 2013, 365(1/2): 115-126.
[6]LAI W L, ZHANG Y, CHEN Z H. Radial oxygen loss, photosynthesis, and nutrient removal of 35 wetland plants[J]. Ecological Engineering, 2012, 39: 24-30.
[7]LAI W L, WANG S Q, PENG C L, et al. Root features related to plant growth and nutrient removal of 35 wetland plants[J]. Water Research, 2011, 45(13): 3941-3950.
[8]NORIO T, KENTARO Y, THIDAR A, et al. Effect of broken dead culms of Phragmites australis on radial oxygen loss in relation to radiation and temperature[J]. Hydrobiologia, 2007, 583(1): 165-172.
[9]INOUE T M, TSUCHIYA K. Interspecic differences in radial oxygen loss from the roots of three Typha species[J]. Limnology, 2008, 9(3): 207-211.
[10]黄丹萍,贺锋,肖蕾,等. 高氮磷胁迫下菖蒲(Acorus calamus Linn.)通气组织和根系释氧的响应[J]. 湖泊科学, 2012, 24(1): 83-88.
[11]刘锋,罗沛,刘新亮,等. 绿狐尾藻生态湿地处理污染水体的研究评述[J]. 农业现代化研究, 2018, 39(8): 1020-1029.
[12]刘少博,冉彬,曾冠军,等. 高铵条件下绿狐尾藻的生理与氮磷吸收特征[J]. 环境科学, 2017, 38(9): 3731-3737.
[13]LIU F, ZHANG S N, LUO P, et al. Purification and reuse of non-point source wastewater via Myriophyllum-based integrative biotechnology: a review[J]. Bioresource Technology, 2018, 248: 3-11.
[14]LUO P, LIU F, ZHANG S N, et al. Nitrogen removal and recovery from lagoon-pretreated swine wastewater by constructed wetlands under sustainable plant harvesting management[J]. Bioresource Technology, 2018, 258: 247-254.
[15]LUO P, LIU F, LIU X, et al. Phosphorus removal from lagoon-pretreated swine wastewater by pilot-scale surface flow constructed wetlands planted with Myriophyllum aquaticum[J]. Science of the Total Environment, 2017, 576: 490-497.
[16]WANG Q, XIE H J, ZHANG J, et al. Effect of plant harvesting on the performance of constructed wetlands during winter: radial oxygen loss and microbial characteristics[J]. Environmental Science and Pollution Research, 2015, 22(20): 7476-7484.
[17]KLUDZE H K, DELAUNE R D, PATRICK W H. Aerenchyma formation and methane and oxygen exchange in rice[J]. Soil Science Society of America Journal, 1993, 57(2): 386-391.
[18]KLUDZE H K, DELAUNE R D, PATRICK W H. A colorimetric method for assaying dissolved oxygen loss from container-grown rice roots[J]. Agronomy Journal, 1994, 86(3): 483-487.
[19]SUN H, WANG W, LI J, et al. Growth, oxidative stress responses, and gene transcription of juvenile bighead carp (Hypophthalmichthys nobilis) under chronic-term exposure of ammonia[J]. Environmental Toxicology and Chemistry, 2014, 33:1726-1731.
[20]MEI X Q, YANG Y, TAM N F Y, et al. Roles of root porosity, radial oxygen loss, Fe plaque formation on nutrient removal and tolerance of wetland plants to domestic wastewater[J]. Water Research, 2014, 50:147-159.
[21]王霁虹,任鹏,马娜,等. 铵态氮对粉绿狐尾藻抗氧化系统的影响研究[J]. 生物化工, 2018, 4(3): 65-68.
[22]YANG Z C, WANG Q, ZHANG J, et al. Effect of plant harvesting on the performance of constructed wetlands during summer[J]. Water, 2016, 8(1): 1-10.
[23]BEZBARUAH A N, ZHANG T C. Quantification of oxygen release by bulrush (Scirpus validus) roots in a constructed treatment wetland[J]. Biotechnology and Bioengineering, 2005, 89(3): 308-318.
[24]王文林,王國祥,万寅婧,等. 光照和生长阶段对菖蒲根系泌氧的影响[J]. 生态学报, 2013, 33(12): 3688-3696.
[25]张权,杨柳燕,高燕,等. 湿生植物根系泌氧能力与其结构相关性研究[J]. 水资源保护, 2016, 32(4): 117-122.
[26]马涛,易能,张振华,等. 凤眼莲根系分泌氧和有机碳规律及其对水体氮转化影响的研究[J].农业环境科学学报, 2014, 33(10): 2003-2013.
[27]WANG Q, CAO Z, HU Y, et al. Season effects on subsurface constructed wetlands performance: role of radial oxygen loss of Phragmites australis[J]. Clean-Soil, Air, Water, 2019,47(8):1800428.
[28]LI Y, WANG X. Root-induced changes in radial oxygen loss, rhizosphere oxygen profile, and nitrification of two rice cultivars in Chinese red soil regions[J]. Plant and Soil, 2013, 365: 115-126.
[29]余红兵,杨知建,肖润林,等. 水生植物的氮磷吸收能力及收割管理研究[J]. 草业学报, 2013, 22(1): 294-299.
[30]QIAN L W, DUAN H, YAN J F, et al. Can multiple harvests of plants improve nitrogen removal from the point-bar soil of lake?[J]. Journal of Environmental Management, 2019, 249: 109371.
(责任编辑:王妮)
