大豆过敏原在低盐固态酱油酿造过程中的降解规律
2020-12-09王梦莉高美须姜小燕支玉香魏芳丽
王梦莉,高美须,*,姜小燕,支玉香,魏芳丽
(1.中国农业科学院农产品加工研究所,北京 100193;2.北京市协和医院,北京 100005)
中国是酱油的主要生产消费国,年产600多万吨,占世界酱油产量的55%以上[1-2],酱油在其他国家和地区的欢迎程度也在逐渐增长。酱油是以大豆、豆粕等为主要原料,辅以小麦、麸皮等淀粉质的材料,经蒸煮、制曲、发酵、灭菌等过程,经过复杂的生物化学反应形成的具有色香味俱全的液体调味料。酱油的发酵工艺主要有高盐稀态、低盐固态和天然晒露法等[3]。低盐固态酱油采用浓度为12~14 °Bé的盐水拌曲,发酵温度在40~50 ℃之间,发酵周期30 d左右[4]。低盐固态发酵由于发酵周期短、蛋白利用率高、出品率稳定等特点,目前是我国酱油行业主要采用的工艺,其产量约占酱油年产量的60%[1]。
酱油中的主要原料大豆和小麦都在世界卫生组织/粮农组织确定的八大过敏食物之中[5]。目前已经从大豆中发现了43种大豆致敏原,分子量在7.0~71 kDa[6]。大豆球蛋白和β-伴大豆球蛋白是大豆中的主要致敏原,分别占大豆种子蛋白质总量50%和25%左右。根据沉积系数,它们常被称为11S和7S组分,因品种不同两者的比值在0.5~1.7之间。β-伴大豆球由α′(71 kDa)、α(67 kDa)和β(50 kDa)亚基组成的。大豆球蛋白分子由5个亚基组成,每一个单聚体亚基都由一个酸性多肽链A(35~43 kDa)和一个碱性多肽B(20 kDa)链通过二硫键连接形成。
发酵可以有效降低豆制品中的致敏性。黄颖[7]研究了包括枯草芽孢杆菌、米曲霉等7种菌对豆粕致敏性的影响,发现米曲霉M1固态发酵豆粕降解大豆致敏原效果较好,大豆总致敏原降解率为 87.39%,β-conglycinin、glycinin的降解率达到97.41%和80.69%。Seo等[8]报道,大豆经过枯草芽孢杆菌发酵后,β-球蛋白亚基、胰蛋白酶抑制剂和Gly m Bd 30 k的含量显著降低,从而改善了豆粕的营养品质。如Yamanishi等[9]将大豆浸泡过夜高压蒸煮后,用纳豆芽孢杆菌模拟纳豆的发酵过程发现,发酵24 h后所有蛋白质均被水解(分子量<10 kDa),并且水解后的肽未显示免疫反应性。
酱油的生产过程中曲霉、酵母菌、乳酸菌等微生物的发酵作用对酱油等发酵食品中大豆致敏原的降解也有报道。酱油酿造过程中原料中的过敏原也被降解为肽和氨基酸,酱油[10-13]中未检测到小麦和主要大豆过敏原(Gly m Bd 30 k和Gly m Bd 28 k)。Son等[14]采用乳酸乳球菌亚种、米曲霉和枯草芽孢杆菌对蒸制大豆进行三步发酵制作豆酱,研究发现发酵后的豆酱没有检测到IgE结合能力,认为没有致敏性,可以供大豆过敏患者食用。邵碧英等[15]在大多数烤鳗酱油样品中没有检测到大豆过敏原。但也有研究发现发酵酱油中仍有致敏的大豆蛋白(相当于大豆粉的10%~30%)。酱油中大豆致敏原的消除是一个复杂的过程,与微生物的发酵以及非酶化学反应生成物等均有关系,虽然酱油中大豆致敏原在发酵过程中逐渐被降解,但是降解的规律以及重点影响降解的阶段还没有被系统的研究。本文就我国低盐固态酱油酿造过程中大豆过敏原降解规律进行了研究,研究酱油酿造过程中工艺关键点对过敏原降解变化的影响,旨在为酱油中过敏原消除奠定科研基础以改善酱油的品质。
1 材料与方法
1.1 材料与仪器
供试样品大豆 购买于北京海淀区幸福超市;乙醇、盐酸、甲醇、冰醋酸、磷酸二氢钠、磷酸氢二钠、氯化钾、氯化钠等 均为分析纯,北京瀚城生物有限公司;磷酸盐缓冲液干粉(phosphate buffered saline,PBS,pH7.2~7.4)2 L装、Tris-HCl缓冲盐溶液(Tris-HCl buffered saline,TBS,pH7.2~7.4)、TBST(Tris-HCl buffer saline with 0.05% Tween 20)、蛋白Marker、30%凝胶储液、辣根过氧化酶(horseradish peroxidase,HRP)标记羊抗兔、HRP标记羊抗人、Bradford蛋白测定试剂盒、二氨基联苯胺显色试剂盒(diaminobenzidine,DAB)等 北京索莱宝有限公司;96孔酶标板 美国Corning公司;酱油菌种 由山东巧媳妇食品有限公司赠予;兔抗大豆多克隆抗体 参照黄颖[7]的方法在农业农村部农产品质量安全收贮运管控重点实验室自制;大豆过敏病人血清 北京协和医院。
国辉FC系列冷冻干燥机 河北国辉实验仪器有限公司;TGL-16A高速冷冻离心机 长沙平凡仪器厂;DYCN-24D型垂直电泳槽、DYCZ-40D转印芯、WD-9405B型水平摇床 北京六一仪器厂;I-mark型酶标仪、1575型洗板机 美国伯乐BIO-RAD公司;电热鼓风干燥箱 上海-恒科学仪器有限公司。
1.2 实验方法
1.2.1 低盐固态酱油的制作 参照《酱油生产实用技术》[16],称取大豆1200 g,面粉300 g,大豆经过30 ℃浸泡3 h,倒出水后,锅内焖3 h,121 ℃灭菌8 min,煮熟的大豆自然冷却至40 ℃。按照0.5%的比重称曲,将曲种和面粉混合均匀之后与大豆混合,将混合好的大豆盛放在长50 cm宽30 cm的通风塑料筐中,以干净的湿纱布(121 ℃灭菌)覆盖表面,在恒温30 ℃、湿度为90%的恒湿培养箱中培养44 h。以酱培中含水量为50%,盐水13 °Bé(含盐量13.5%)计算所需盐水量,加入盐水,于43 ℃保温发酵30 d,三角瓶中保鲜膜密封发酵,成熟酱培加80 ℃水浸泡后4 ℃条件下5000 r/min离心10 min获得上清,上清即为生酱油,80 ℃灭菌30 min后,获得熟酱油。在酱油制备的四个阶段分别取12个样品,即蒸煮后、在制曲阶段制曲14、27、36和44 h的样品,在发酵阶段发酵5、10、17、24和30 d的样品,灭菌前的生酱油和灭菌后的熟酱油样品。所有的制曲和发酵阶段的样品均冷冻干燥后,备用。
1.2.2 蛋白的提取 通过Elvira等[17]描述的方法进行蛋白质提取。1 g冻干粉末加入20 mL提取缓冲液(0.05 mol/L Tris-HCl缓冲液,pH8.2)涡旋混合均匀之后,40 ℃水浴超声70 min,每10 min混匀一次,8 ℃条件下20000×g离心30 min,提取液直接用于后续分析。对每个样品进行至少3次独立的提取。
1.2.3 蛋白质分子质量及主要组分的变化 采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分析酱油酿造过程中蛋白提取液中蛋白组分的变化。可溶性蛋白测定采用Bradford蛋白质定量法。按照Laemmli[18]的方法采用不连续垂直凝胶电泳,凝胶厚度1 mm,选用质量分数为5%浓缩胶,12%分离胶,将提取液稀释至1 mg/mL上样量为15 μL,Marker上样量为5 μL。设定电泳条件为恒压80和120 V,时间为30 min和1 h,待溴酚蓝指示剂到分离胶底部1 cm处,结束电泳,进行剥胶、染色、脱色后拍照。
1.2.4 酱油酿造过程中大豆过敏原抗原性变化
1.2.4.1 免疫印迹法-大豆过敏原IgG结合能力测定 蛋白样品进行SDS-PAGE电泳分离后,夹心法转膜,恒流96 mA电转移120 min,转移完成后取出NC膜。已转印的NC膜用封闭液(含5%的脱脂奶粉的TBST溶液)于4 ℃冰箱封闭过夜,次日取出后用TBST洗涤5次,加入用封闭液1∶50稀释的兔抗大豆蛋白多克隆抗体,室温孵育60 min,用TBST洗涤5次,每次5~10 min。加入1∶1000稀释的HRP标记羊抗兔室温孵育1 h后,用TBST洗膜5次,每次5~10 min,后用TBS洗涤两次,每次5 min。二氨基联苯胺(DAB)避光显色1 min,以蒸馏水洗涤3次,每次5 min以终止反应。显色之后,及时拍照。
1.2.4.2 间接竞争ELISA法测定大豆过敏原抗原性 大豆全蛋白抗原稀释至为1 μg/mL,每孔100 μL,4 ℃包被过夜,次日取出后自动洗板机用PBST(含0.05% Tween 20的PBS)洗涤5次。每孔加入5%脱脂奶粉200 μL,37 ℃封闭2 h,用自动洗板机用PBST洗涤5次。每孔加入50 μL稀释80倍后的蛋白提取液和50 μL 1∶10000稀释的的兔多克隆抗体,无竞争孔不加抗原或样品,37 ℃孵育1 h。洗涤同前。每孔加入100 μL用洗涤液1∶5000稀释的HRP标记的羊抗兔,37 ℃孵育1 h,洗涤。每孔加入100 μL新鲜配制的TMB底物显色液,37 ℃避光孵育15 min,每孔加入2 mol/L H2SO450 μL,终止反应,然后于酶标仪450 nm处测定OD值,绘制曲线。过敏蛋白抑制率的计算公式为:
抑制率(%)=(OD无竞争孔-OD待测样品)/OD无竞争孔×100
1.2.5 酱油酿造过程中大豆过敏原蛋白过敏原性变化 间接竞争酶联免疫法测定酿造过程中大豆过敏原蛋白的过敏原性。试验步骤同上1.2.4.2,其中一抗人血清稀释倍数为1∶2000,二抗稀释倍数1∶5000,抑制率的计算公式同上。
1.3 数据处理
每个样品重复3次,数据分析采用Excel统计分析软件,结果用平均值±标准偏差的形式表示。
2 结果与分析
2.1 酱油酿造过程中蛋白组分变化规律分析
酱油发酵不同时间的蛋白SDS-PAGE如图1所示,所用蛋白标准分子质量范围为14.4~99.4 kDa。由图1可知,大豆中的主要致敏原蛋白是β-伴大豆球蛋白和大豆球蛋白组分,随着发酵的进行,两种主要致敏原逐渐降解。大豆经过蒸煮之后,位于35~43和20 kDa附近的条带都变深,由分子量大小推测为该条带是大豆球蛋白的酸性亚基(35~43 kDa)和碱性亚基(20 kDa)。由SDS-PAGE电泳图(图1)可知,制曲阶段大豆过敏原蛋白条带消失的最为明显,其中β-伴大豆球蛋白中的α′亚基(71 kDa)在制曲14 h时消失,α亚基(67 kDa)在制曲27 h时消失,β亚基(50 kDa)在发酵阶段逐渐消失。由图1可以看出,制曲阶段对于大豆蛋白致敏原的降解影响最大。大豆球蛋白的酸性亚基(35~43 kDa)在制曲之后也消失,但是碱性亚基(20 kDa)存在于酱油酿造的整个阶段,在成品也没有被去除。随着制曲时间的延长,位于碱性亚基上方约22 kDa处出现一条蛋白条带,认为是蛋白降解的缘故而不是新的蛋白形成。在进入发酵阶段,已经消失的大豆球蛋白的酸性亚基及β-伴大豆球蛋白都没有检测到,20 kDa的蛋白条带逐步降解。从电泳图中可以看出,加热灭菌对于大豆球蛋白碱性亚基的减少没有较大影响。

图1 酱油酿造过程中蛋白SDS-PAGE图
2.2 酱油酿造过程中大豆致敏原的IgG结合能力变化分析
酱油发酵过程中大豆致敏原的IgG结合能力如图2所示。由图2可知,在酱油酿造过程中大豆致敏原蛋白的免疫结合能力逐步降低。原料大豆在蒸煮之后,大豆球蛋白的IgG结合能力变化不大,β亚基有增强的趋势,而β-伴大豆球蛋白的α(67 kDa)和α′亚基(71 kDa)的IgG结合能力减弱。在制曲阶段,大豆过敏原蛋白的免疫结合发生较大变化,β-伴大豆球蛋白的α(67 kDa)和α′亚基(71 kDa)亚基在制曲27 h完全失去IgG结合能力,这与电泳结果一致。β亚基(50 kDa)在制曲阶段IgG结合能力呈现波动式降低。大豆球蛋白的酸性亚基27 h时失去IgG结合能力,碱性亚基IgG结合能力变化较小。在发酵阶段,β-伴大豆球蛋白的β亚基(50 kDa)含量持续降低,在发酵17 d时免疫印迹消失,IgG结合能力最低,β亚基(50 kDa)的消失和图1相比出现了延迟,说明虽然蛋白条带在电泳图中不可见,但该条带并没有失去致敏性。另外,在发酵阶段,大豆球蛋白的酸性亚基在进入发酵阶段的10 d时再次具有IgG结合能力,且有逐渐增强趋势,直至发酵结束仍然残留在酱油中。加热灭菌对于大豆球蛋白的酸性和碱性亚基的IgG结合能力的影响较小。其中原料蒸煮和制曲对大豆致敏原抗原性的降低起到关键作用。
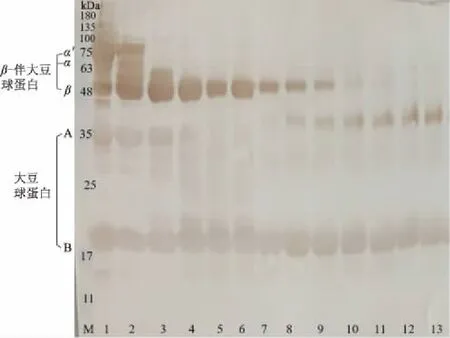
图2 酱油酿造过程大豆过敏原的IgG结合能力的免疫印迹图
2.3 酱油酿造过程中大豆蛋白的抗原性变化规律分析
Western blot是抗原肽和蛋白质的大小定性分析和表征,并不能定量分析过敏原的含量变化,因此还需要用酶联免疫试验进行交叉分析。图3为利用酶联免疫试验检测酱油酿造过程中大豆致敏原抗原性的抑制率变化。由图3可知,酱油酿造过程中大豆过敏原的含量呈现逐渐下降趋势。酱油在蒸煮、制曲、发酵、灭菌等过程过敏原蛋白的致敏性消减了8.13%、39.00%、69.10%和87.06%,灭菌对于大豆致敏原含量的降低也有影响,酱油经过灭菌之后,较未灭菌的样品下降了26.6%。从图3可知,酱油酿造过程中,大豆致敏原蛋的抗原性逐渐降低,其中原料蒸煮和制曲对大豆致敏原抗原性的降低起到关键作用。
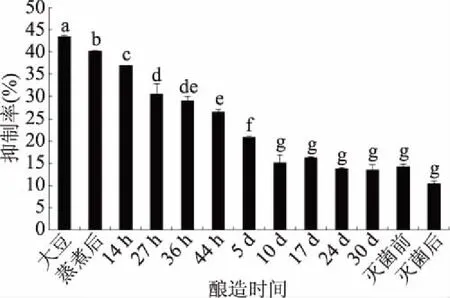
图3 酱油酿造过程中大豆过敏原抗原性变化
2.4 酱油酿造过程中大豆致敏原过敏原性变化分析
通过抑制酶联免疫吸附试验(ELISA)进一步研究了酱油中大豆致敏原是否保留其IgE结合能力。由图4可知,大豆致敏原的过敏原性在蒸煮之后逐渐降低。大豆致敏原在制曲阶段的14~36 h间致敏原性下降的程度最大,之后在发酵阶段保持持续降低趋势,并且在24~30 d出现第二次骤减,由图1可知大豆主要致敏原α(72 kDa)和α′(76 kDa)亚基与球蛋白的碱性亚基的消失,是IgE结合能力骤减的主要原因。大豆过敏原经过蒸煮、制曲、发酵、灭菌等加工过程,大豆蛋白过敏原的IgE结合能力较生大豆分别下降了8.92%、71.66%、92.26%、98.45%。由此可知,蒸煮、制曲、发酵和灭菌都会使得大豆过敏原一定程度上的降低,其中制曲的作用最大。
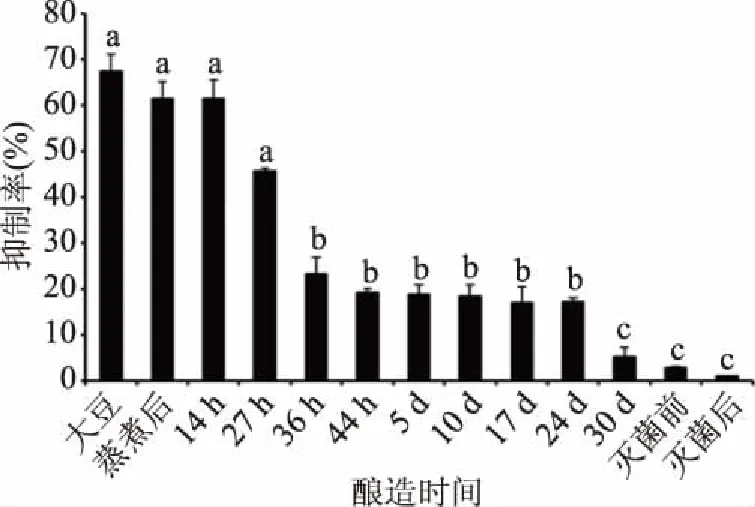
图4 酱油酿造过程中大豆过敏原过敏原性变化
3 讨论
原料大豆经过浸泡吸水膨胀,之后经过121 ℃蒸煮8 min,完成前处理过程。由SDS-PAGE图可知,在酱油酿造的整个过程中,前处理过程(蒸煮)对于大豆过敏原的降解有重要的影响,原料经过蒸煮之后,大豆球蛋白的蛋白条带较原料大豆颜色深,但大豆过敏原的抗原性和致敏原性下降,IgE和IgG结合能力降低。研究发现,热处理如蒸煮之后,过敏原蛋白发生适度变性,次级键被破坏,蛋白结构变的松散以利于酶解;大豆经过浸泡,吸水膨胀,水分子会进入大豆的二、三、四级结构中,在热处理过程中水分子会发生激烈的热运动可以破坏蛋白质的高级结构,构向表位被破坏降低致敏性[19-21]。原料如果润水不足,蒸料时间或温度不够时,会形成未变性的蛋白——N性蛋白,这种蛋白难以被酶水解[22]。蒸煮时间过久就会使蛋白质过度变性,蛋白质的多肽松散紊乱疏水基(烃基)暴露,在疏水作用的驱动下,蛋白质分子相互靠近形成大分子量的聚集体,导致致敏原蛋白的溶解性下降,形成不易被酶解的物质,影响过敏原的降解[23]。可就蒸煮时间和温度润水量对蛋白利用率、氨基酸生成率及过敏原降解率的影响开展进一步研究,以提高蛋白的可利用率,降低大豆致敏性。
制曲是酱油发酵中的关键环节,在酱油酿造个过程中,曲的好坏直接影响发酵中酶系的含量和丰富度,进而影响原料的分解、蛋白利用率和氨基酸生成率[24]。本实验中蒸煮及制曲阶段对蛋白组分变化的影响最大,是过敏蛋白降解及过敏原移除的重要阶段。在制曲阶段观察到的IgE结合能力的降低是由于米曲霉为主的微生物降解大豆中的主要过敏原蛋白β-伴大豆球蛋白和大豆球蛋白所致。SDS-PAGE图中可知在制曲阶段,β-伴大豆球蛋白比大豆球蛋白优先降解,失去过敏原性和抗原性。β-伴大豆球蛋白和大豆球蛋白的结果不同,更容易受外界的影响而发生聚合和解聚,更易被酶解,这可能是大豆球蛋白和伴大豆球蛋白降解速率不同的原因[25]。在制曲阶段剩余的免疫原性最强的亚基是大豆球蛋白的碱性亚基和β-伴大豆球蛋白的β-亚基,因此在制曲阶段可以添加特异性的酶或是酶组合去进一步降解这两种亚基,或是利用复合菌株制曲,利用不同微生物产生的不同酶系降解过敏原,以进一步降低大豆过敏原的致敏性,获得一种低致敏酱油。
酱油后发酵阶段主要是利用制曲阶段产生的酶(果胶酶、纤维素酶、淀粉酶、蛋白酶)进一步进行发酵酶解。大豆蛋白经发酵后可降解为小分子肽段,而这些小分子肽段分子量在低于 20 kDa 时几乎没有致敏性[26]。本实验结果可知,大豆经过预处理、制曲和发酵,大豆致敏原的抗原性已经降低了81%,致敏原性降低了92%,致敏性大幅度降低。Yang等[27]利用干酪乳杆菌、酵母菌和枯草芽孢杆菌混合固态发酵豆粕,发现豆粕的潜在致敏性降低。Song等[26]研究表明,利用植物乳杆菌、双歧杆菌和酵母菌发酵的豆粕可以很大程度上降低大豆蛋白的过敏原性。Hong[28]使用三种微生物乳酸菌、米曲霉和枯草芽孢杆菌的组合来发酵煮沸的大豆,发现发酵产物多是小于10 kDa的氨基酸和多肽,没有检测到过敏性和抗原性。这表明,不同的微生物发酵能够很大程度上降低大豆致敏原的致敏性,但是不同的微生物发酵对于大豆过敏原的降解影响不同。多菌混合制曲对酿造酱油风味成分及感官等影响已经有较多的研究,但对酱油中致敏原降解的影响还未有报道。
除了制曲和发酵过程,灭菌处理和过滤对于致敏原的降低也非常重要。在灭菌之后,抗原性和过敏原性较未灭菌之前均有所降低,这可能是由于可溶性大豆蛋白在灭菌之后变成不溶性的物质被过滤除去所致。Magishi等[29]的研究也发现大豆蛋白在酱醅中并没有完全降解,仍然残留在生酱油中,残留在生酱油中的可溶性大豆蛋白经热处理后变性为不溶性过敏原,并通过过滤处理之后从6个月的发酵液中完全去除。在本研究中,在酱油的成品中仍然残留有大豆致敏原。残留的大豆过敏原具有IgG结合能力,但是监测到IgE的结合能力较IgG结合能力弱,过敏原性大幅度降低[30-31]。综上,酱油发酵过程使得大豆蛋白过敏原的致敏性大幅度降低。
4 结论
本实验跟踪低盐固态酱油酿造过程,探究了酱油酿造过程中大豆致敏原致敏性的变化。酱油中仍旧残留大豆球蛋白的致敏原,但是已经失去过敏原性。在实验室中制备的酱油中大豆致敏原的抗原性和过敏原性分别降低了87.06%和98.45%,致敏性基本被消除,是一种低致敏性的发酵大豆的液体调味品。酱油制备的蒸煮、制曲、发酵和灭菌都会使得大豆过敏原的抗原性和致敏原性降低,其中制曲阶段对过敏原蛋白的降解最为明显,后期可进一步研究在制曲阶段外加酶降解大豆致敏原,或是研究复合菌株制曲来降低大豆致敏原,以研发一种低致敏营养的酱油产品。
