一株抑制轮枝镰孢菌的鼠李糖乳杆菌的筛选及其在玉米防霉中应用
2020-12-09逄晓阳吕加平张书文依胜男郝莉雨许晓曦冷友斌
胡 诚,逄晓阳,吕加平,刘 骞,芦 晶,张书文,依胜男,郝莉雨,许晓曦,*,冷友斌
(1.东北农业大学食品学院,黑龙江哈尔滨 150030;2.中国农业科学院农产品加工研究所,北京 100193;3.黑龙江飞鹤乳业有限公司,北京 100015)
轮枝镰孢菌是一种常见的镰孢霉菌,在生长过程中可产生多种毒素,常常污染粮食、蔬菜和饲料,人畜食用了被这些毒素污染的食物会出现恶心、呕吐的中毒反应,严重的甚至会导致人畜死亡[1-3]。为了防止农作物被霉菌污染引起腐烂,目前常采用的方法是化学防腐,其不仅安全性无法保证,还会导致耐药菌株的大量出现[4-5]。此外也有采用物理防腐的方法,但物理防腐通常存在杀菌不彻底的问题,无法保证农作物的储藏期有效延长[6-7]。在中国已经进入营养健康的大时代背景下,亟待开发绿色安全的新型防霉保鲜剂[8]。
国内外学者很早就开始了绿色防霉保鲜剂的开发工作,先后从传统发酵食品、泡菜、麦芽、小麦储粮、面团等材料中分离了许多有一定防腐抗霉功能的乳酸菌株。如Matei等[8]从腌菜中分离出3株能够显著抑制黄曲霉和黑曲霉菌丝生长和孢子形成的乳酸菌株。Tropcheva等[9]从保加利亚的传统发酵乳制品“katak”中分离出四株具有抗曲霉、镰刀菌、青霉、木霉的短乳杆菌。Lynch等[10]报道了将食淀粉乳杆菌DSM 19280用于切达奶酪防腐,可有效延迟霉菌变质发生的时间6~9 d。Belkacem-Hanfi等[11]从小麦储粮中分离出54株乳酸菌,经过抗霉菌活性筛选,发现植物乳杆菌、草乳杆菌具有显著抑制赭曲霉毒素(OTA)产生及菌株生长繁殖的活性。Ahlberg等[12]分离的乳酸菌可以显著减轻食品或饲料中黄曲霉毒素。在国内,张柏林等[13]首次报道了有关乳酸菌抗真菌活性及其抑制真菌毒素的研究。王海宽等[14]、吕欣等[15]从中国传统发酵制品中筛选出对霉菌有明显拮抗作用的乳酸菌,分别为植物乳杆菌和干酪乳杆菌。李红娟等[16]从传统发酵乳制品中选育得到一株具有优良抗青霉特性的干酪乳杆菌AST18,并应用于乳制品中,取得非常好的抗青霉效果。
目前少有针对轮枝镰孢菌的绿色防霉保鲜剂的相关研究,因此筛选具有良好抑制轮枝镰孢菌性能的乳酸菌并将其应用到农业生产和储藏中,有重要的实际应用价值[17]。本研究从132种乳酸菌菌株中筛选到1株具有明显抑制轮枝镰孢菌生长的菌株,并对该菌的抑菌物质及特性进行了初步研究,以期将其应用于玉米防霉中,为开发抗轮枝镰孢菌的绿色安全防腐剂奠定研究基础。
1 材料与方法
1.1 材料与仪器
132株乳酸菌 由中国农业科学院农产品加工研究所乳品实验室保藏;轮枝镰孢菌JF-5-1(Fusariumverticillium) 由中国农业科学院农产品加工研究所植物病理学实验室保藏;MRS肉汤培养基、MRS固体培养基、PDA培养基、PDB培养基 北京陆桥技术股份有限公司;溶菌酶、胰蛋白酶、木瓜蛋白酶等 美国Sigma公司;TransFast® Taq DNA Polymerase 北京全式金生物技术有限公司;细菌基因组DNA提取试剂盒 天根生化科技有限公司;扩增引物 北京Invitrogen 公司合成;Tween-80 国产分析纯。
LDZX-50KB立式压力蒸汽灭菌器 上海申安医疗器械厂;SK15离心机 美国Sigma公司;SPARK 20M多功能酶标仪 瑞士Tecan公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 日本Takara公司。
1.2 实验方法
1.2.1 乳酸菌的培养及上清液的提取 取冻存的132株乳酸菌菌株进行活化传代培养。按2%的接种量,将已活化至生长对数期的乳酸菌接种于MRS液体培养基,37 ℃培养48 h,经离心(8000 r/min,15 min)收集上清液。将上清液用0.22 μm无菌滤膜过滤[18]。
1.2.2 轮枝镰孢菌JF-5-1孢子悬浮液的制备 按6%的接种量移取FusariumoxysporumJF-5-1种子液至装有100 mL PDB培养基锥形瓶中,在200 r/min、30 ℃条件下的摇床中振荡培养3 d。吸取培养在PDB培养基中FusariumoxysporumJF-5-1菌株200 μL涂布在PDA固体培养基平皿,30 ℃恒温培养3 d左右至长满整个培养皿,用含有0.05%(V/V)吐温80的灭菌水冲洗FusariumverticilliumJF-5-1固体培养皿,采用400目无菌纱布过滤除去菌丝,过滤后的孢子悬浮液使用血球计数板调节孢子浓度至106mL-1[19-20]。
1.2.3 抑制轮枝镰孢菌的乳酸菌筛选
1.2.3.1 乳酸菌的初筛实验 使用双层平板拮抗法筛选对FusariumverticilliumJF-5-1具有拮抗作用的乳酸菌。乳酸菌在下层MRS琼脂培养基划线,37 ℃培养48 h后,上层倾倒15 mL PDA培养基,并吸取200 μL提前制备好的FusariumverticilliumJF-5-1孢子悬浮液于PDA培养基上涂布。30 ℃培养48 h,观察抑菌情况[21]。
1.2.3.2 16S rDNA鉴定 对初筛的乳酸菌进行分析,选取后续实验需要的菌株进行16S rDNA鉴定。具体操作步骤为:乳酸菌DNA的提取→DNA电泳检测→PCR扩增→PCR产物电泳检测→测序→同源性分析[22-23]。
1.2.3.3 抗轮枝镰孢菌的乳酸菌复筛实验 为了更加全面精确的分析出初筛的乳酸菌菌株的抑菌能力,分别采用琼脂柱法和微量稀释法对抑菌活性进行检测。
复筛方法1:琼脂柱法[24]:取10%上清发酵液加入PDA培养基,以纯PDA培养基为对照。用直径6 mm的FusariumverticilliumJF-5-1菌饼置入培养基中心,30 ℃恒温培养并观察,采用十字交叉法测量菌体的直径,当对照组菌体完全铺满时,计算所有培养皿中菌体面积,求出各菌抑菌率。此方法抑菌率计算公式如下:
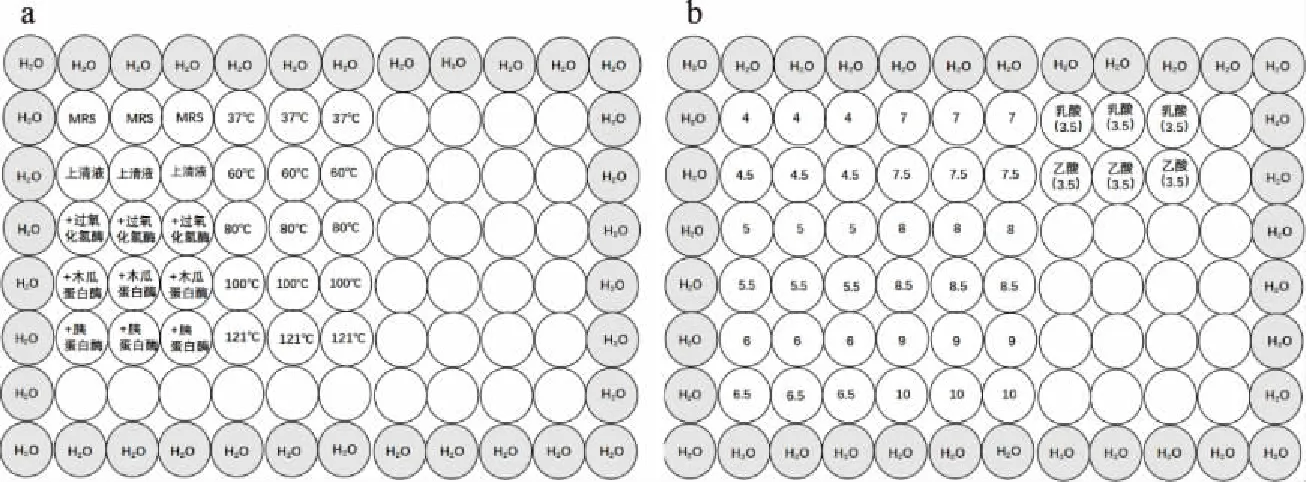
图1 不同条件对抑菌活性影响的实验设计图
抑菌率(%)=(1-样品组菌饼面积/空白组菌饼面积)×100
式(1)
复筛方法2:微量稀释法。参照Gerez等[25]、Zhao等[26]及马欢欢等[27]方法并稍加改进。取80 μL孢子悬浮液,100 μL PDB培养基和20 μL不同乳酸菌的上清液添加到孔板中30 ℃恒温培养,以20 μL MRS肉汤培养基代替乳酸菌的上清液作为对照组。观察每个孔板里孢子的生长情况,并在48 h及以后每隔12 h测量一次抑菌率。此方法抑菌率计算公式如下:
抑菌率(%)=(1-ODLAB/ODMRS)×100
式(2)
式中:ODLAB表示实验组培养时的OD580 nm;ODMRS表示MRS肉汤作为对照培养时的OD580 nm。
结合两种抑菌方法,分析各乳酸菌的抑菌能力,选取最佳菌株及其对比菌株进行后续实验。
1.2.4 目标菌株生长曲线、pH及抑菌效果变化分析 取目标菌株按照2%的接种量37 ℃培养,每间隔6 h测定其上清液OD600、pH及抑菌率。抑菌率测定方法采用1.2.3.3的复筛方法1琼脂柱法。
1.2.5 乳酸菌抑菌成分特性分析 菌株培养液分别经过过氧化氢酶、蛋白酶、不同温度及pH处理后采用微量稀释法[28],分析目标菌株的抑菌物质类别及其对pH和温度的敏感性。外圈每孔加入200 μL无菌蒸馏水封边,以保护内部样品减少误差。具体操作如图1所示。
1.2.5.1 过氧化氢酶处理 在菌株上清液中加入过氧化氢酶,使其终浓度达1 mg/mL,37 ℃水浴24 h。以MRS肉汤培养基和原乳酸菌上清液作为对照。
1.2.5.2 蛋白酶处理 在菌株上清液中分别加入木瓜蛋白酶、胰蛋白酶(1 mg/mL)在最适pH(6.0,8.0)最适温度(55、37 ℃)2 h水浴处理,80 ℃,10 min水浴灭活,处理后将pH调回起点值。以MRS肉汤培养基和原乳酸菌上清液作为对照。
1.2.5.4 pH敏感性实验 将上清液调节pH至2.0、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、10.0。用pH=3.5的乳酸和乙酸调节MRS肉汤培养基,以及MRS肉汤培养基和原乳酸菌上清液作为对照。
1.2.6 目标菌株的最小抑菌浓度(MIC)测定 采用两倍稀释肉汤法测定乳酸菌菌株培养液对FusariumverticilliumJF-5-1的MIC[28]。将菌株上清液真空冷冻干燥,用PDB液体培养基将粉末稀释定容至5 mL,终浓度为32.0、16.0、8.0、4.0、2.0、1.0、0.5、0.25 mg/mL,以PDB培养基不加粉末为对照组。分别加入100 μL、106CFU/mL的FusariumverticilliumJF-5-1孢子悬浮液,30 ℃恒温摇床培养24 h后肉眼观察试管无混浊现象的最低浓度为菌株的MIC。
1.2.7 目标菌株在玉米防霉中的应用 在100 mL锥形瓶中放入10 g新鲜玉米粒,再分别加入5 mLFusariumverticilliumJF-5-1孢子悬浮液+5 mL灭菌水(a)、10 mL灭菌水(b)、5 mLFusariumverticilliumJF-5-1孢子悬浮液+5 mL乳酸调节pH=3.5的MRS(d)、5 mL灭菌水+5 mL乳酸调节pH=3.5的MRS(d)、5 mLFusariumverticilliumJF-5-1孢子悬浮液+5 mL菌株48 h发酵上清液(e)以及5 mL菌株48 h发酵上清液+5 mL灭菌水(f)浸泡玉米粒30 ℃,24 h后倒出水分,将玉米粒放入平皿中,每日分别使用灭菌水、pH=3.5的MRS和上清液喷玉米粒表面,观察霉菌生长情况并拍照。
1.3 数据处理
所有实验数据采用SPSS 18.5和Microsoft Excel 2016软件进行统计处理与作图分析。各实验均平行重复3次,试验结果以平均值±标准差表示。
2 结果与分析
2.1 抗轮枝镰孢菌的乳酸菌初筛分析
将双层平板拮抗法得到的结果通过对抑菌区域大小分为“+++”、“++”、“+”、“-”四个等级。具体划分依据如下:+++:抑菌面积占培养皿面积大于50%;++:抑菌面积占培养皿面积25%~50%;+:抑菌面积占培养皿面积小于25%;-:无抑菌区域。初筛结果发现(图2),抑菌能力为“+++”的共有17株(13%),抑菌能力为“++”的共有58株(44%),抑菌能力为“+”的共有46株(35%),抑菌能力为“-”的共有11株(8%)。
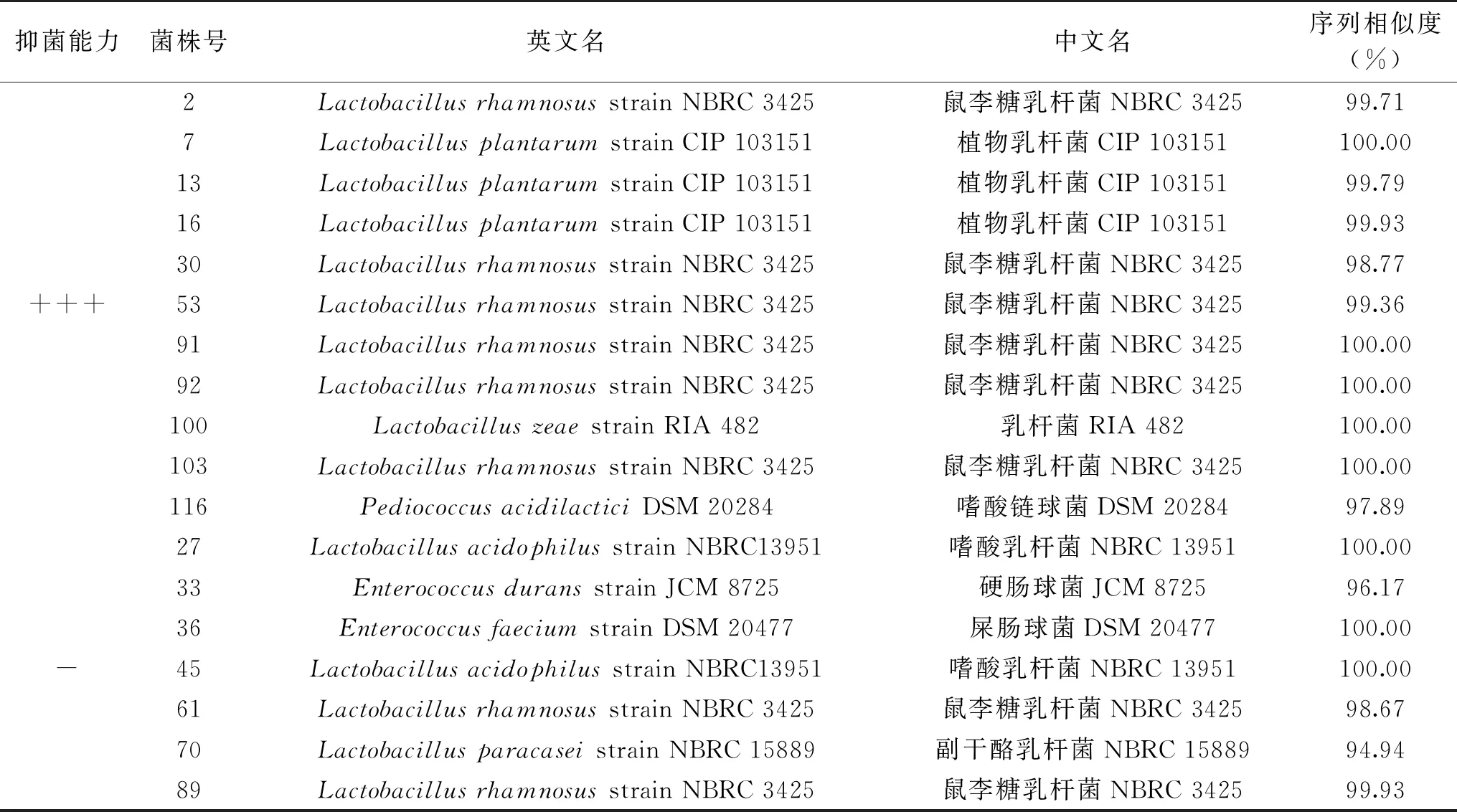
表1 待测菌株测序结果
图2 不同抑菌能力的抑菌效果对比
2.2 初筛乳酸菌的16S rDNA序列同源性鉴定
对初筛抑菌能力为“+++”和“-”的乳酸菌提取基因组DNA,PCR扩增其16S rDNA序列。将PCR扩增产物测序后,通过BLAST程序与NCBI数据库中已报道的菌株序列进行比对分析。其鉴定分析结果如下:
相对于其他施工技术,帷幕灌浆技术操作较为方便。在开展帷幕灌浆技术的过程中,必须充分结合施工方案,在合理的位置进行钻探和灌浆。随着时间的延续,水泥会完成凝固,凝固的水泥和周围的泥土形成坚硬的保护物,也就是形成了效果较好的帷幕防渗系统。帷幕灌浆技术具有以下特点:适用范围广、施工成本低、施工成果佳。
通过分析发现抑菌效果优异的菌株中主要以鼠李糖乳杆菌和植物乳杆菌为主。而抑菌能力为“-”的菌株则种属各异,但未发现有植物乳杆菌无抑菌性。考虑到后期计划用组学技术找到亲缘关系极相近的两种乳酸菌进行差异代谢物分析,经过预实验,选用鼠李糖乳杆菌进行后续复筛实验。
2.3 抗轮枝镰孢菌的乳酸菌复筛实验
通过对鼠李糖乳杆菌2、30、53、61、89、91、92、100和103号菌株进行复筛,选取最终目标菌株。
2.3.1 琼脂柱法测定 其抑菌率利用琼脂柱法进行抑菌能力测定,通过十字交叉法测量其直径,并通过公式计算抑菌率,结果见表2。
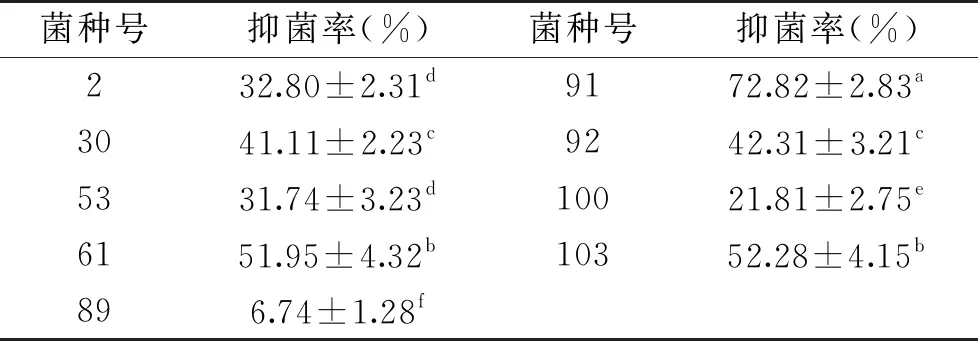
表2 琼脂柱法测定不同菌株抑菌效果
通过表2分析91号菌株抑菌率最高,为72.82%。89号菌株抑菌率最低,无明显抑菌性,抑菌率仅为6.74%。
2.3.2 微量稀释法测定其抑菌率 通过微量稀释法加入不同上清液后观察微孔内的孢子生长情况,在24 h时对照组已经浑浊,89号观察到有霉菌零星长出,48 h时,2、53、61和89号均有霉菌长出,其中89号的霉菌数量最多,但因其附着于底且并未铺满,所以并没有直观反映在吸光度上。在72 h时89号菌霉菌已铺满底部,孔内较为浑浊。84 h时,仅有2、91和100号菌株未有霉菌出现,其他孔内均有霉菌出现,部分孔内白色菌丝长于液体表面。将所有数据进行汇总,如表3所示。
通过表3可看出在48 h时,抑菌率均在78%~84%之间,在72 h时89抑菌率降为66.83%,96 h时仅有2、91以及100号三株菌抑菌率仍在80%以上。故此方法表明2、91和100号展现出了更加良好的抑菌性。
根据两种方法复筛,综合观察分析,91号菌株抑菌效果最为显著(P<0.05)并且效果稳定,重复性较好,故选用91号菌株进行后续实验。
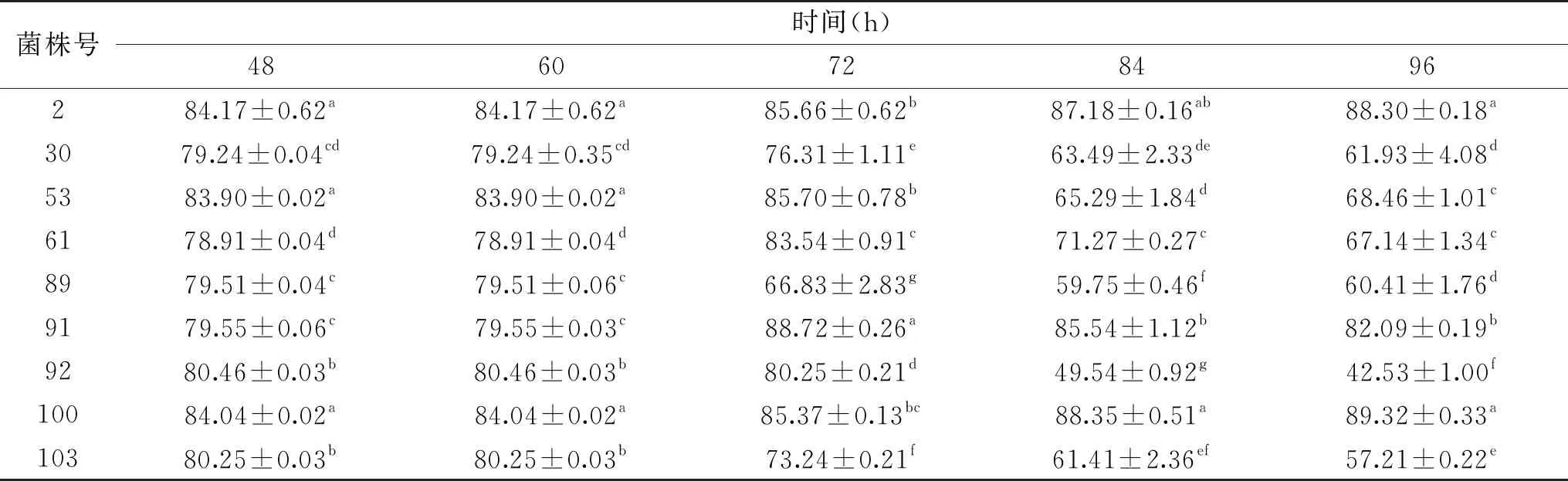
表3 不同菌株上清液的抑菌率
2.4 91号菌株生长曲线及不同时间抑菌率的变化
通过对91号菌株不同发酵时间OD值和pH的测定绘制其生长和pH变化曲线如图3所示。
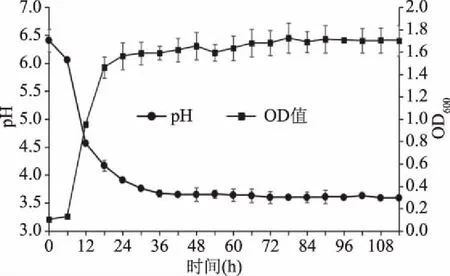
图3 91号菌株的生长和pH变化曲线
由图3可以看出,91号菌株在培养6 h后进入对数生长期,OD600迅速增加,pH迅速减小,至18 h逐渐进入稳定期,最终pH降至3.59并趋于稳定,OD600值趋于1.71。
对不同发酵时间点的抑菌率进行测定结果如图4所示,在6 h时抑菌能力微弱,12和18 h随着乳酸菌进入对数生长期,分泌大量代谢物,抑菌率升至52.0%和55.2%。在第30~66 h时间段,抑菌率变化在70.4%~74.4%之间。在第72~108 h之间,抑菌率变化在76.8%~82.1%之间。

图4 91号菌株不同发酵时间抑菌能力变化情况
2.5 91号乳酸菌抑制轮枝镰孢菌的抑菌成分初步分析
对乳酸菌上清液分别进行过氧化氢酶处理、蛋白酶处理、温度调节及调节pH,对上清液里的抑菌成分及特性进行初步分析。图5、图6和图7为不同处理下48 h时的OD580值。
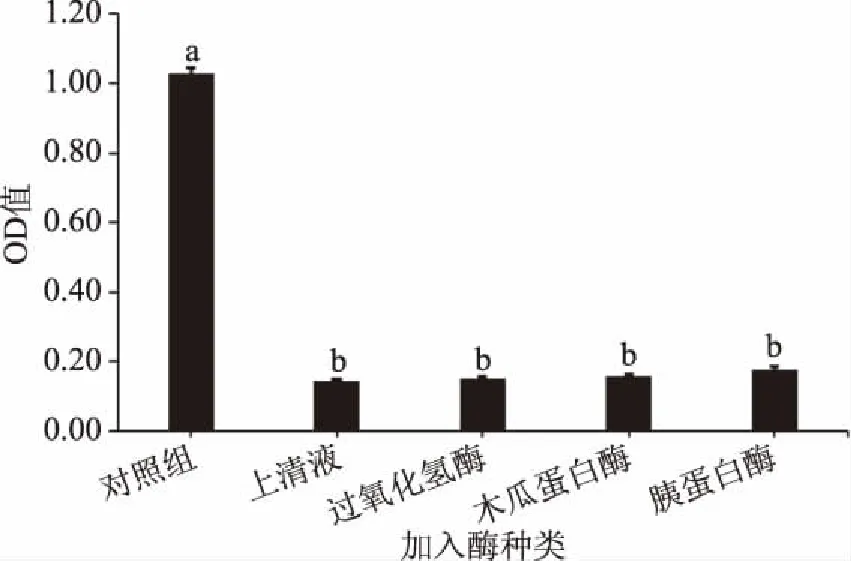
图5 91号上清液的不同酶处理对抑菌效果的影响
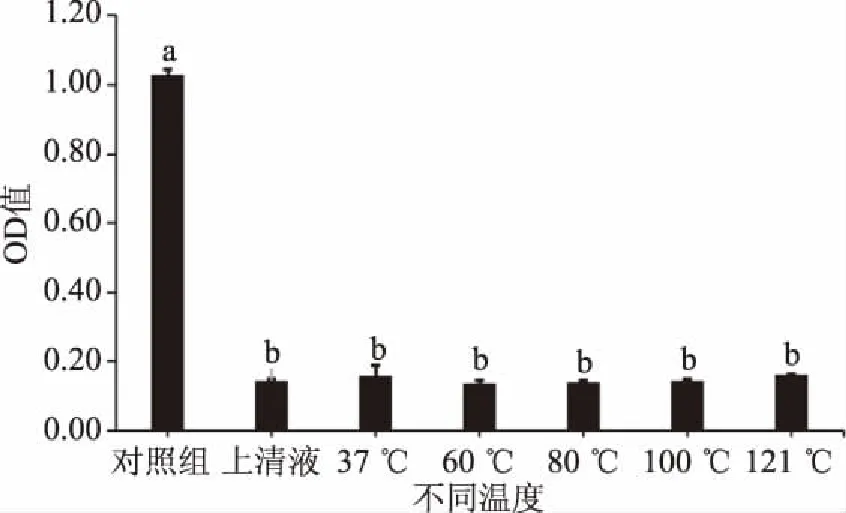
图6 91号上清液的不同热处理对抑菌效果的影响
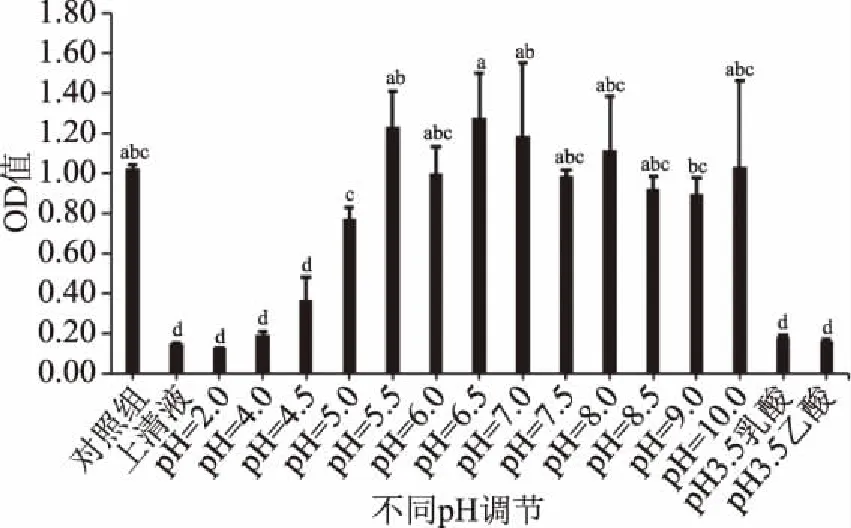
图7 91号上清液的不同pH处理对抑菌效果的影响
由图5经分析数据可知,91号菌株上清液的抑菌率为85.9%。而添加过氧化氢酶对抑菌率无影响(与上清液相比),证明上清液中抑制轮枝镰孢菌的物质并不是过氧化氢。分别用木瓜蛋白酶和胰蛋白酶处理后观察上清液抑菌活性,发现蛋白酶处理后未对抑菌活性产生较大影响,由图5可知加入蛋白酶的OD580值与原上清液无显著性差异。故上清液中没有对木瓜蛋白酶与胰蛋白酶敏感的蛋白类物质。
在不同温度热处理实验中,分别在37、60、80、100以及121 ℃处理30 min后,观察抑菌活性。结果图6所示,热处理并未影响其抑菌性,抑菌率均在84%~87%之间,证明上清液中含有能够耐高温的抑菌物质。抑菌物质的稳定性较好,这和杜静芳等[28]筛选的可以抑制阪崎肠杆菌的乳酸菌研究结果一致。
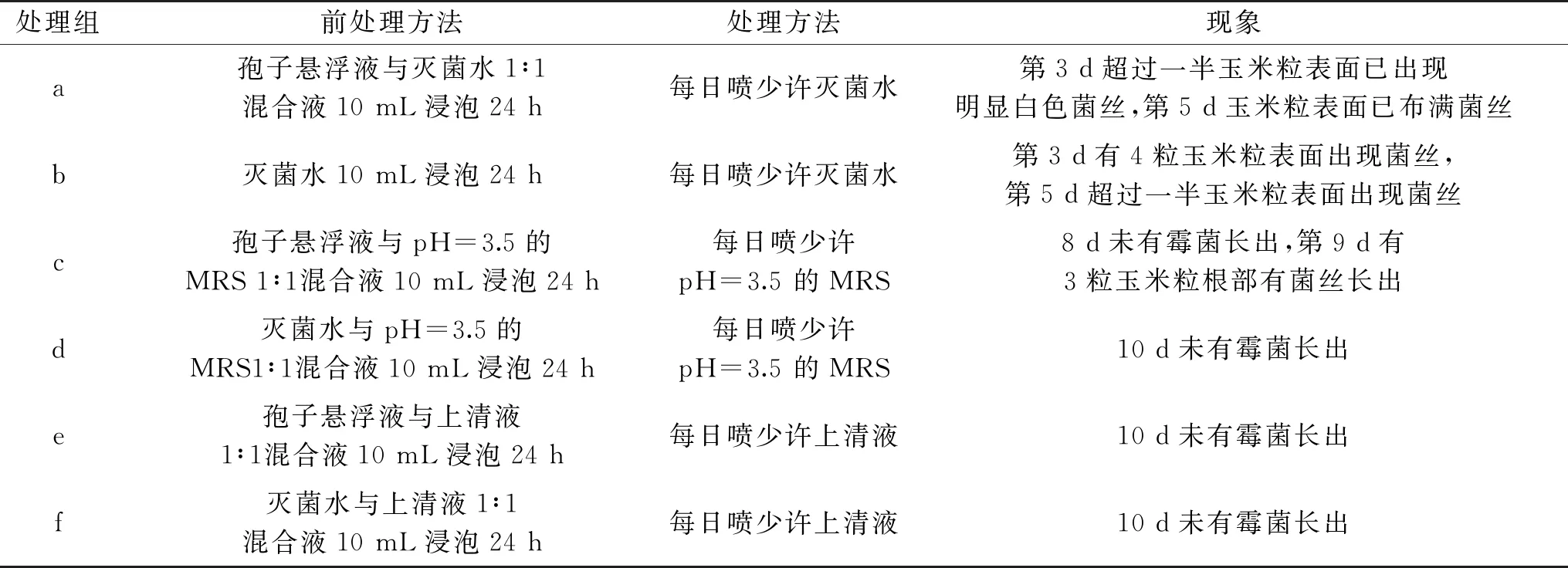
表4 不同处理组对玉米储存的影响
由图7经分析数据可知,通过将91号菌株上清液pH调至4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、10.0以及用乳酸和乙酸调节灭菌水至pH=3.5对照,发现在pH=4.5时,抑菌活性受到影响,抑菌率降为64.1%、pH=5时,抑菌率急速下降为25.0%,当pH大于等于5.5时,91号菌株抑菌活性全部丧失。通过乳酸和乙酸调节MRS培养基至pH=3.5发现48 h无浑浊现象,未有孢子长出,抑菌效果显著。这与Muhialdin等[29]的研究结果相似。证明抑菌物质受pH变化影响较大,故推测上清液中可能含有酸类抑菌物质。
2.6 91号菌株的MIC值
将乳酸菌上清液冻干后稀释定容至相应浓度,以PDB培养基不加粉末为对照组。各浓度培养24 h后肉眼观察试管有无浑浊现象,观察发现在8 mg/mL及以上浓度试管均清澈透明,4 mg/mL略有浑浊,2 mg/mL及以下有明显浑浊,菌丝生长明显。故确定8 mg/mL为91号菌株对FusariumverticilliumJF-5-1的最小抑菌浓度。
2.7 91号菌株在玉米防霉中的应用
实验结果如表4所示,在第3 d,a组和b组均出现不同情况的白色菌丝出现,第3 d如图8所示。c组第9 d根部有菌丝长出,而d组、e组和f组10 d仍未有霉菌长出。总体来说,抑菌效果较为明显,并且证明了乳酸可以抑制玉米粒霉菌的生长,但上清液中含有其他抑菌物质有待进一步发掘。Muhialdin等[30]使用从植物乳杆菌TE10提取的多肽来抑制黄曲霉在玉米新鲜种子上的生长,研究表明加入多肽的抑制组7 d后仍无孢子和菌丝生长,同样证明了乳酸菌对玉米防腐的应用潜力。

图8 玉米粒3 d后霉菌生长情况
3 结论
生物防控是以安全性为首要特征的一类研究领域,而用乳酸菌来有效抑霉也是当今的研究热点之一。本研究筛选出的91号菌株具有良好的抑制轮枝镰孢菌的能力,经过16S rDNA鉴定菌株为鼠李糖乳杆菌(Lactobacillusrhamnosus)。该菌株已经在中国微生物菌种保藏管理委员会普通微生物中心做了菌株的专利保藏,菌株保藏号为CGMCC No.18210。通过过氧化氢酶处理,蛋白酶处理,温度调节及pH调节对91号乳酸菌上清液进行处理研究,初步推测其抑菌成分主要为有机酸,上清液的最小抑菌浓度为8.0 mg/mL。添加91号菌株48 h发酵上清液可抑制玉米中霉菌生长10 d,延长玉米储藏期。下步将通过分离纯化方法及组学技术对具体抑菌物质及抑菌机理进一步深入研究,为探究出一种新型安全有效的抑霉、控霉生物防控方式奠定基础。将91号菌株应用在玉米防霉中可显著抑制轮枝镰孢菌的生长,延缓玉米的腐败变质,保障玉米的质量和货架期,减少霉菌毒素对人体的危害,从而保证我国国民的健康水平,具有很广阔的应用前景。
