UFP-101对脓毒症大鼠心功能及心脏HMGB1、TLR-4蛋白表达的影响
2020-12-09王一迪韩毅李占峰陈司坤
王一迪 韩毅,2 李占峰 陈司坤
(山西医科大学 1麻醉学系,山西 太原 030001;2第二医院麻醉科)
脓毒症是指明确或可疑的感染引起的全身炎症反应综合征。严重脓毒症是指脓毒症伴有其导致的器官功能障碍和(或)组织灌注不足〔1〕,会引起心功能障碍,主要表现为心室扩张,心肌顺应性减低,对液体复苏和儿茶酚胺刺激的反应性下降等,是引起脓毒症患者死亡的核心原因之一〔2〕。孤啡肽(N/OFQ)是孤儿阿片样受体(ORL1)的内源性配体〔3〕,ORL1受体主要分布于人类的中枢神经系统(CNS)且在人类和大鼠心室肌及主动脉内皮细胞内也有表达〔4,5〕。研究证明〔6〕N/OFQ系统在脓毒症患者体内被激活,而内源性N/OFQ受体拮抗剂(UFP-101)可以提高脓毒症大鼠存活率,调节此病理状态下大鼠免疫系统〔7〕。但内源性N/OFQ是否具体会影响脓毒症的大鼠心功能以及相关机制尚不可知。高迁移率蛋白家族(HMG)B1作为一种脓毒症晚期炎症介质,与Toll样受体(TLR)4结合促进炎症因子表达上调〔8〕,并且会促进脓毒性心功能障碍〔9〕。本研究旨在探究UFP-101对不同时间段脓毒症大鼠心肌组织内HMGB1及TLR4的基因分子水平调控及对心功能的影响。
1 材料与方法
1.1材料 60只健康成年雄性SD大鼠,6~8周龄,体重250~280 g,购自山西医科大学动物研究中心。本实验中动物处置方法符合动物伦理血标准并经过山西医科大学麻醉学系实验动物福利伦理审批。实验试剂:UFP-101(英国Tocris Cookson公司);白细胞介素(IL)-6,肿瘤坏死因子(TNF)-α,HMGB1的酶联免疫吸附试验(ELISA)试剂盒(武汉博士得生物有限公司);GAPDH一抗(英国Abcam公司),兔HMGB1抗体(北京博奥森生物技术有限公司),兔TLR4多克隆抗体(北京博奥森生物技术有限公司),羊抗兔HRP-IgG二抗(英国Abcam公司),总 RNA 提取试剂盒(9767)、逆转录试剂盒(RR047A)及扩增试剂盒(RR820A)均购于日本Takara公司。3-实验仪器:BL-420N生物信息采集系统(成都泰盟),酶标仪(Thermo公司),ChemiDoc XRS凝胶成像分析系统(Bio-Rad公司),MX3005P实时荧光定量PCR仪(上海拜力生物科技有限公司)分光光度计(UV-2800H,上海尤尼柯公司)。
1.2实验分组 60只大鼠随机分为三组:UFP-101组(U组)、盲肠结扎穿孔(CLP,C组)组与假手术(S)组,其中每组中随机平均分为两个时间段(CLP术后12 h,24 h)组,每个时间段10只。开始试验之前,所有SD大鼠保持1 w静养,可自由饮水、进食,本研究严格按照实验动物伦理规定开展。
1.3建模与给药方式CLP法建模方式 术前大鼠均保持6 h禁食状态,腹腔内注射350 mg/kg 10%的水合氯醛(批准文号:国药准字H37022673 生产厂家:青岛宇龙海藻有限公司),体位取仰卧位,将大鼠头部及四肢固定好,选择在大鼠中下腹部位置的作出一个手术切口,长度控制在1 cm左右,腹腔内所有脏器均暴露,对肠系膜行游离处理,经仔细探查之后将盲肠找到;在和盲肠根部距离1.5 cm的位置对盲肠根部行环形结扎处理;结扎远端采用18号针头行1次贯通穿刺处理,将少量粪便挤出,肠段行还纳处理,并将大鼠腹膜及皮肤依次缝合好。
给药方式:U组采用CLP建模法,术后立即经腹壁皮下注射0.03 mg/kg〔7〕负荷量的UFP-101,术后每隔6 h以同样的方式注射等量的UFP-101,其中CLP术后12 h大鼠给药3次,CLP术后24 h大鼠给药5次。S组对盲肠进行探查之后,便马上将腹壁切口缝合好,C组则采用CLP建模法,S组和C组大鼠同U组大鼠方式经腹壁皮下注射等量生理盐水。
1.4相关指标测定方式
1.4.1血流动力学指标 分别用25%乌拉坦以5 ml/kg负荷量给各组CLP术后12 h,24 h大鼠腹腔注射麻醉,并行右侧颈动脉插管直至左心室,连接生物采集系统,记录心功能数据。
1.4.2ELISA检测血清IL-6、TNF-α与HMGB1 各组大鼠心功能采集完成后被处死,取5 ml腹主动脉血,1 500 r/min离心15 min,获取血清,行乙二胺四乙酸(EDTA)抗凝,保存在-80℃的环境中;血清IL-6、TNF-α及HMGB1均采用ELISA试剂盒法测定,各项操作均严格按照试剂盒说明书进行;各物质的光密度值均采用酶标仪进行测定,将标准曲线建立,并对血清中各种物质的含量进行计算。
1.4.3Western印迹检测HMGB1,TLR4的蛋白表达水平 各组大鼠被处死后,开胸取大鼠心脏,用4℃生理盐水冲洗,平均分为两份,分别放入高压蒸汽灭菌的EP管中-80℃保存。取50 mg左右组织进行蛋白提取,二喹啉甲酸(BCA)定量法检测蛋白浓度后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),转膜,封闭2 h,一抗(稀释浓度均为1∶1 000)孵育过夜,二抗(1∶16 000稀释)孵育1 h,TBST缓冲液清洗后用Quantity One图像分析软件测定各蛋白条带灰度值,取HMGB1,TLR4条带灰度与其相应内参GAPDH条带灰度比值作为蛋白表达指标。
1.4.4RT-PCR检测HMGB1,TLR4的mRNA水平 取20 mg左右组织进行mRNA提取,利用紫外可见分光光度计检测mRNA纯度,逆转录合成cDNA。将合成的引物cDNA进行PCR,采用2-ΔΔCt法对目的基因进行相对定量分析。引物序列见表1。

表1 利用RT-PCR技术检测的蛋白及内参引物序列
1.5统计学分析 采用SPSS23.0软件进行方差分析,LSD-t检验。
2 结 果
2.1术后各时期血流动力学指标对比 各组大鼠LVEDP,LVSP,MAP,HR,+dP/dt,-dP/dt等心功能指标在CLP术后24 h比术后12 h有所下降。与S组相比,C组与U组术后12h,24h的LVEDP,LVSP,MAP,HR,+dP/dt,-dP/dt均明显下降,但U组较C组明显上述指标增高(P<0.05)。UFP-101在大鼠CLP术后的应用对脓毒症大鼠的心功能有所改善。见表2。
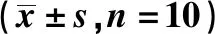
表2 3组SD大鼠术后各时期血流动力学指标对比
2.2术后12、24 h各组IL-6、TNF-α与血清HMGB1变化情况 U组、C组术后12 h IL-6和TNF-α的血清浓度高于术后24 h(P<0.01),U组和C组血清IL-6和TNF-α浓度在术后各时间段较S组明显上升(P<0.01),但U组较C组各时间段血清IL-6和TNF-α浓度明显下降(P<0.01)。U组和C组血清HMGB1浓度术后24 h较术后12 h明显升高(P<0.01),而S组无明显变化,U组和C组术后各时间段血清HMGB1浓度较S 组明显升高(P<0.01),但U组较C组各时间段血清HMGB1浓度明显降低(P<0.01)。见表3。
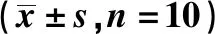
表3 CLP术后12 h,24 h各组大鼠血清IL-6、TNF-α与HMGB1变化
2.3术后12 h,24 h各组大鼠心肌组织内HMGB1,TLR4的蛋白及mRNA表达水平比较 术后12、24 h,C组,U组大鼠心肌组织HMGB1,TLR4蛋白表达水平及mRNA相对水平均明显高于S组(P<0.05),且U组上述指标水平也明显低于C组(P<0.05)。见图1,表4。
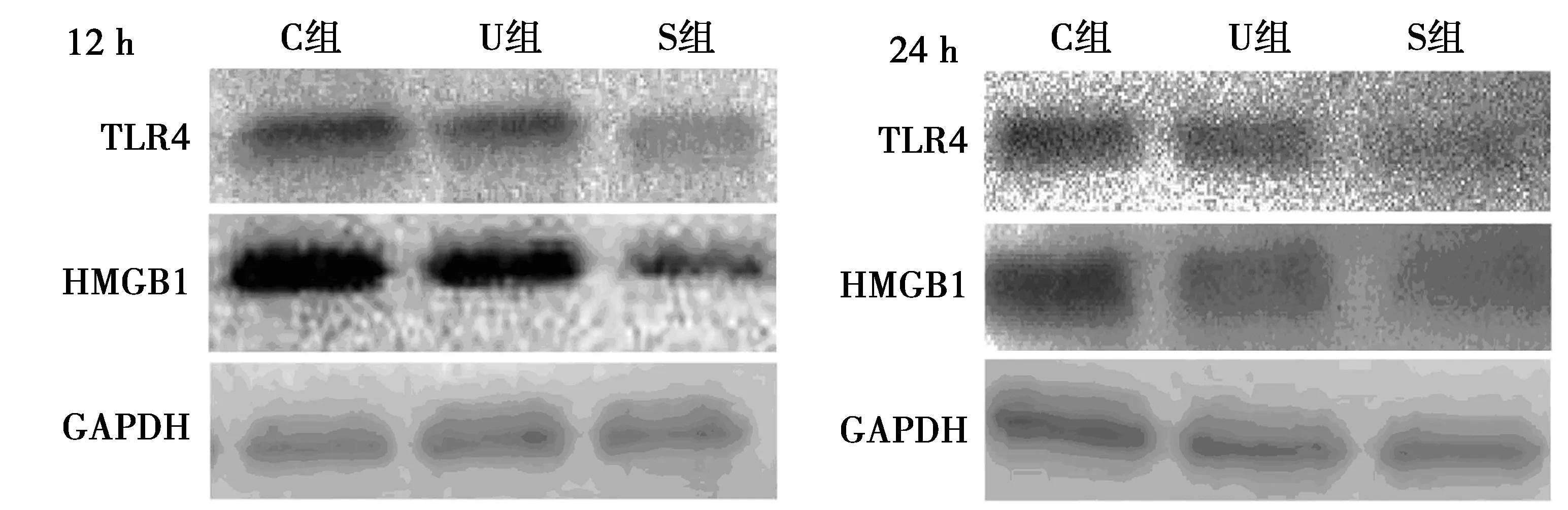
图1 术后12、24 h Western印迹检测各组大鼠心肌组织TLR4及HMGB1的相对表达
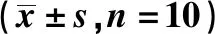
表4 术后12、24 h各组大鼠心肌组织HMGB1,TLR4蛋白及其mRNA相对表达比较
3 讨 论
严重的脓毒症的特点为血流动力学的改变和一个或多个器官的功能性衰竭,约有40%的脓毒症患者可合并心肌抑制〔10〕,心功能的衰竭使脓毒症患者的病死率增加2倍左右。脓毒症引发的心功能障碍病理原因很多,一氧化氮(NO)、氧自由基的过度产生,TNF-α、IL-1β、IL-6〔11,12〕等炎症因子对心肌组织的浸润都是导致心肌抑制的重要因子。本研究说明,UFP-101可能降低脓毒症大鼠整体炎症反应,并且对其心功能有保护作用。
关于UFP-101以上对脓毒症大鼠保护作用其机制可能如下,N/OFQ及其受体在外周血中性粒细胞内表达,炎症反应过程中中性粒细胞对N/OFQ的释放增多,这些N/OFQ可促进中性粒细胞和单核细胞的趋化,并且促进炎症因子的释放〔13〕,间接抑制心肌功能。N/OFQ也可能直接调节心血管系统,大鼠心肌细胞中有OLR1的表达,外源性给予N/OFQ 会剂量依赖性地降低心脏的舒缩功能,部分原因是因为N/OFQ作用其受体后抑制心肌细胞L型钙电流〔14〕。UFP-101不仅阻断N/OFQ对心脏的直接抑制作用并且降低其对炎症细胞的趋化作用,抑制炎症因子的释放从而保护心脏功能。
HMGB1,TLR4通路近年来成为新的抗炎治疗研究靶点,不同于其他炎症因子,HMGB1受到内毒素及其他炎症因子刺激后开始释放,入血浆的时间在8 h后,属于晚期炎症介质〔15〕。HMGB1含有两个可折叠的DNA结合区:A box和B box〔16〕,其中B box 含有促炎症的结构域,HMGB1能通过与TLR4受体作用激活下游核因子(NF)-κB通路〔17〕,进而促进炎症因子的表达增加患体的器官损伤及死亡的风险。研究证明HMGB1可以在内毒素刺激下由活心肌细胞释放,并且可能通过旁分泌作用于相邻心肌细胞TLR4受体降低心肌收缩能力〔18〕。本研究说明UFP-101对心肌组织HMGB1和TLR4有下调作用,也有可能降低了浸润心肌组织的免疫细胞所表达的HMGB1,这一效应能够降低HMGB1-TLR4-NF-κB通路激活的促炎作用及对心功能的损伤作用〔19〕。UFP-101调控心肌组织及循环系统内的TLR4,HMGB1的机制可能性很多,其中内源性N/OFQ受体所激活的下游蛋白激酶(PK)C及细胞外调节蛋白激酶(ERK)1/2通路〔20〕,有可能对HMGB1,TLR4蛋白〔21〕产生上调作用,而UFP-101通过阻断N/OFQ的下游作用,至少部分引起HMGB1,TLR4的下调,进而对浓度症大鼠炎症反应及心功能起到缓解保护作用。
