细胞增殖上调因子促进神经胶质瘤细胞增殖的潜在机制
2020-12-09冯涛杨霄鹏李富强刘前白银雪
冯涛 杨霄鹏 李富强 刘前 白银雪
(1南阳医学高等专科学校第一附属医院神经内科,河南 南阳 473058;2郑州大学第二附属医院神经内科)
神经胶质瘤是一种发病率和死亡率均较高的原发性中枢神经系统肿瘤,其发生和发展的分子机制并不完全清晰,研究其发病的可能机制对防治神经胶质瘤具有重要意义。细胞增殖上调因子(URGCP)又称为上调基因(URG)4,可通过调控胞内基因的表达参与肿瘤细胞的增殖、侵袭和凋亡等生理过程,与消化系统、内分泌系统和呼吸系统等肿瘤的发生发展均密切相关〔1~3〕。然而,目前发现URGCP在神经系统肿瘤神经母细胞瘤中的研究较多,而在胶质瘤的研究较少〔4,5〕。因此,本研究通过检测URGCP在胶质瘤细胞中的表达,构建URGCP沉默或过表达的胶质瘤细胞,观察其对细胞增殖的影响及其可能的分子机制。
1 材料与方法
1.1细胞和试剂 人正常星形胶质细胞株NHA购于美国ScienCell研究实验室,神经胶质瘤细胞株A172、U251和U87购于中科院上海细胞库。RPMI1640培养基购于美国Gibco公司,URGCP-siRNA和阴性对照序列Scrambled siRNA及pcDNA3.0-URGCP重组质粒及pcDNA3.0空载体质粒购于美国Ambion公司。总蛋白提取试剂盒和脂质体2000转染试剂购于美国Invitrogen公司,二辛可宁酸蛋白检测试剂盒购于美国Pierce 公司。URGCP抗体(1∶1 000)购于美国Abcam公司,胰蛋白酶、胎牛血清、MTT试剂和GAPDH抗体(1∶1 000)购于美国Sigma公司,IκBα抗体(1∶500)、细胞周期蛋白(Cyclin)D1抗体(1∶500)、CyclinE1抗体(1:800)、核转录因子(NF)-κB/p65抗体(1∶500)和羊抗兔/鼠IgG二抗(1∶2 000)均购于美国Santa cruz 公司,p-IκBα抗体(1∶1 000)购于美国Cell Signaling公司。
1.2细胞培养 以37℃水浴解冻复苏储存的NHA、A172、U251和U87细胞,采用含10%灭活胎牛血清的RPMI1640培养基,于5%CO2、37℃饱和湿度的细胞培养箱内培养。每2 d换液培养,待细胞几乎铺满培养瓶底时,加入0.25%胰蛋白酶消化传代。收集第3~5代对数生长期细胞进行实验。
1.3Western印迹检测 收集生长良好的NHA、A172、U251和U87细胞,以总蛋白提取试剂盒提取各种细胞的总蛋白,并采用二辛可宁酸蛋白检测试剂盒进行定量。取适量蛋白加入等体积上样缓冲液,置于沸水浴中变性5~10 min。取变性蛋白60 μg行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)。蛋白分离结束后,采用转膜仪转膜。将带有蛋白样品的聚偏氟乙烯(PVDF)膜浸入封闭液(含50 g/L去脂奶粉)封闭处理1~2 h。封闭液洗膜后,加入特异性一抗4℃下孵育24 h。再以封闭液洗膜后,加入辣根过氧化酶标记的二抗于37℃下反应1 h。以二氨基联苯胺显影后,以GAPDH作内参,凝胶成像系统拍照分析目的蛋白的灰度值。后续实验中对CyclinD1和CyclinE1蛋白及NF-κB信号通路相关蛋白的检测亦采用上述方法。
1.4细胞转染 转染前1 d,将长势良好的U87细胞和A172细胞以每孔106个接种至6孔板上,于细胞培养箱中常规培养24 h。根据转染试剂脂质体2000说明书将URGCP-siRNA和Scrambled siRNA转染至U87细胞中,分别标记为siURGCP组、Scrambled组,并以只加入脂质体2000的U87细胞作为空白1组。同样方法将pcDNA3.0-URGCP和pcDNA3.0质粒转染至A172细胞中,并标记为URGCP组、Vector组,同时设置只加入转染试剂的A172细胞为空白2组。两种细胞均在转染6 h后,更换新鲜培养基,再于细胞培养箱内培养。48 h后,收集各组细胞,采用Western印迹检测URGCP的表达情况。
1.5细胞增殖实验 收集对数生长期的各组细胞,以每孔104个细胞种植到96孔板上,每组设置6个复孔。设置24、48、72和96 h 4个检测时间点,分别培养至所需时间点后,取出培养板,每孔加入20 μl、5 g/L MTT溶液,常温下反应4 h后,加入150 μl二甲基亚砜震荡反应10 min,以酶标仪检测细胞在450 nm处的吸光(OD)值,将对照组细胞的活力设为1,实验组细胞活力=实验组OD值/对照组OD值。根据细胞活力绘制生长曲线。
1.6克隆形成实验 收集对数生长期的各组细胞,以每孔2 ml细胞悬液(细胞浓度为600个/ml)接种至6孔细胞板上。置于细胞培养箱中常规培养10 d。采用磷酸缓冲液洗涤后,每孔加1 ml 4%多聚甲醛固定10 min。再加入1 ml结晶紫染色10 min。洗涤晾干后,显微镜下观察拍照,统计克隆数即大于50个细胞的集落个数。
1.7统计学分析 采用SPSS22.0软件进行t检验、单因素方差分析。
2 结 果
2.1URGCP在胶质瘤细胞中的表达 URGCP蛋白在神经胶质瘤A172、U251和U87细胞中的表达水平(0.34±0.03、1.02±0.1、1.23±0.12)依次增大,且均明显大于正常星形胶质NHA细胞(0.15±0.02,P<0.05)。见图1。
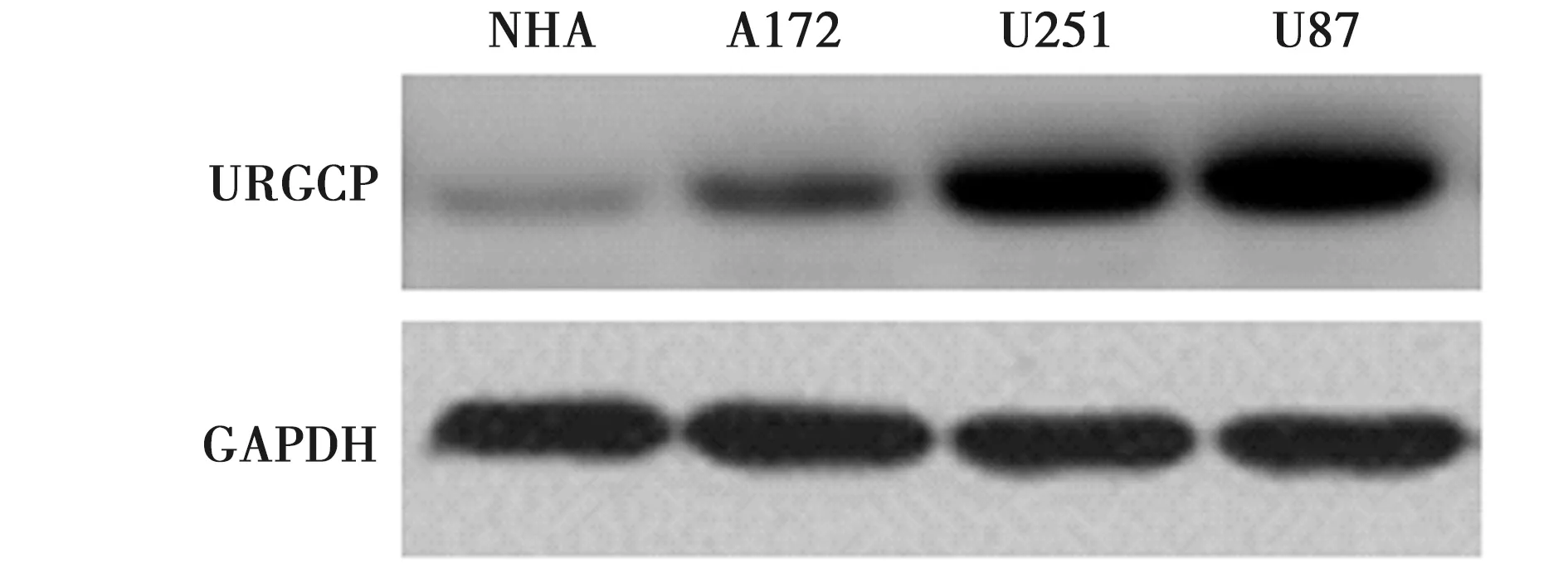
图1 URGCP在胶质瘤细胞中的表达
2.2构建沉默URGCP的U87细胞和过表达URGCP的A172细胞 转染URGCP-siRNA后,U87细胞中URGCP蛋白表达水平(0.22±0.02)较空白1组(0.83±0.08)明显降低(P<0.05),而转染Scrambled siRNA后,U87细胞中URGCP蛋白表达水平(0.79±0.08)与空白组差异无统计学意义(P>0.05);同时,在转染pcDNA3.0-URGCP的A172细胞中URGCP蛋白表达(0.76±0.08)较空白2组(0.35±0.04)明显升高(P<0.05),而转染pcDNA3.0质粒的A172细胞中URGCP蛋白表达(0.34±0.03)与空白2组相比差异无统计学意义(P>0.05)。见图2。
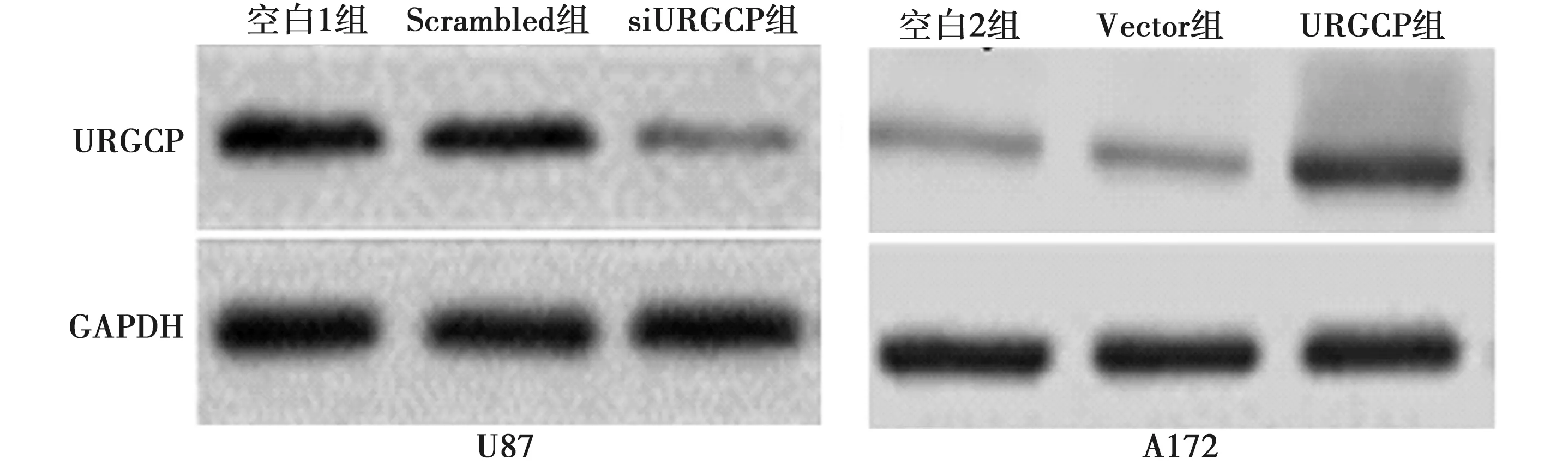
图2 URGCP在U87细胞和A172细胞中的表达
2.3沉默URGCP抑制U87细胞增殖 MTT检测0、24、48、72和96 h作用时间下空白1组细胞的相对活力分别为0.20±0.02、0.42±0.05、0.65±0.07、0.89±0.09、1.21±0.13,Scrambled组分别为0.22±0.02、0.38±0.04、0.60±0.07、0.85±0.09、1.14±0.13,siURGCP组为0.21±0.02、0.32±0.03、0.39±0.04、0.44±0.04、0.47±0.05。比较24、48、72和96 h同一作用时间发现,siURGCP组细胞的相对活力较空白1组明显降低(P<0.05),而Scrambled组与空白1组相比未见明显改变(P>0.05)。同时,克隆形成实验得到,siURGCP组细胞的克隆数明显低于空白1组(39.24±2.14 vs 113.54±6.58,P<0.05),而Scrambled组(109.13±5.32)与空白1组相比差异无统计学意义(P>0.05)。见图3。
2.4过表达URGCP促进A172细胞增殖 MTT检测各组A172细胞的相对活力发现,0、24、48、72和96 h作用时间下,空白2组细胞的相对活力分别为 0.21±0.02、0.27±0.03、0.35±0.04、0.46±0.05、0.55±0.06,Vector组分别为0.21±0.02、0.24±0.03、0.32±0.03、0.42±0.04、0.51±0.05,URGCP组分别为0.22±0.02、0.38±0.04、0.54±0.05、0.79±0.08、1.04±0.11。同一作用时间下(24、48、72和96 h)比较发现,在A172细胞中过表达URGCP后,与沉默URGCP抑制U87细胞增殖的结果相反,URGCP组细胞活力显著增强(P<0.05);同时,URGCP组细胞的克隆数明显大于空白2组(129.60±12.54 vs 67.24±5.32,P<0.05)。与空白2组相比,Vector组细胞活力及克隆数(64.57±6.18)差异无统计学意义(P>0.05)。见图3。

图3 各组U87、A172细胞的克隆情况
2.5沉默URGCP抑制U87细胞中CyclinD1和CyclinE1表达 空白1组与Scrambled组CyclinD1、 CyclinE1蛋白表达水平差异无统计学意义(0.97±0.10 vs 1.01±0.11,1.25±0.13 vs 1.31±0.13,P>0.05),但siURGCP组(0.32±0.03、0.15±0.02)较空白1组均明显降低(P<0.05)。在A172细胞中,与空白2组相比,Vector组细胞中CyclinD1、 CyclinE1蛋白表达水平差异无统计学意义(0.25±0.03 vs 0.32±0.03,0.15±0.02 vs 0.12±0.01,P>0.05),而URGCP组(0.62±0.05、0.78±0.08)显著高于空白2组。见图4。
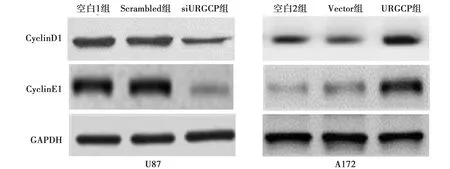
图4 URGCP对CyclinD1和CyclinE1蛋白表达的影响
2.6沉默URGCP抑制U87细胞中NF-κB通路 在U87细胞中,空白1组、Scrambled组和siURGCP组中p-IκBα蛋白的相对表达水平分别为1.35±0.14、1.28±0.13、0.22±0.02;IκBα分别为0.97±0.11、0.92±0.09、1.01±0.10;细胞质中NF-κB/p65表达水平分别为0.32±0.03、0.37±0.04、0.81±0.08,而细胞核中NF-κB/p65表达水平分别0.87±0.09、0.91±0.09、0.33±0.03。可见,沉默URGCP表达使U87细胞中 p-IκBα和胞核NF-κB/p65表达降低(P<0.05),而使胞质NF-κB/p65表达升高(P<0.05)。在A172细胞中。空白2组、Vector组和URGCP组细胞中p-IκBα蛋白的相对表达水平分别0.12±0.01、0.15±0.02、0.57±0.06,IκBα分别为0.31±0.03、0.28±0.03、0.32±0.03,胞质NF-κB/p65分别为0.55±0.05、0.53±0.05、0.29±0.03,胞核NF-κB/p65分别为0.52±0.05、0.61±0.06、1.06±0.11。见图5。
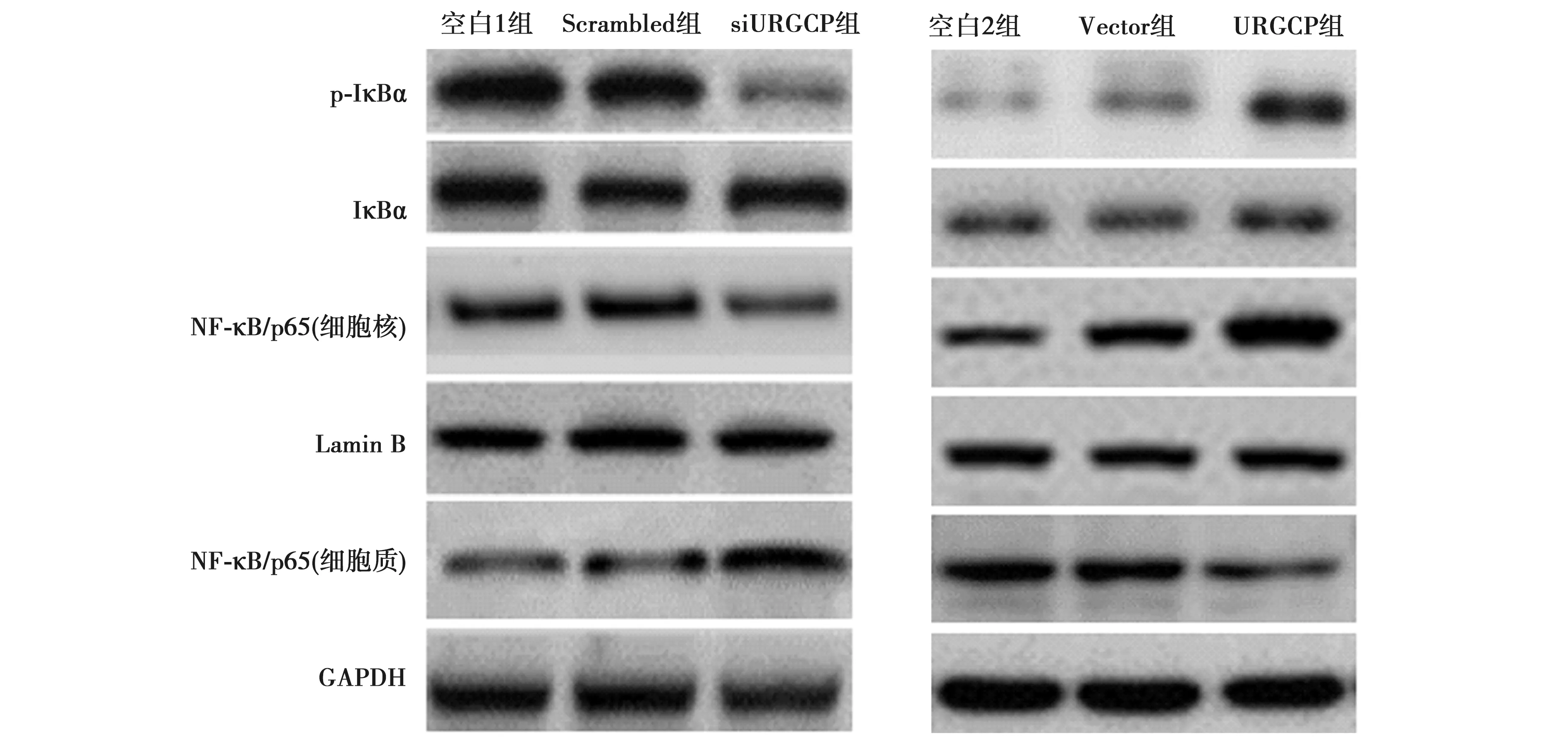
图5 URGCP对NF-κB信号通路的影响
3 讨 论
URGCP是一种定位于7q13染色体可编码922个氨基酸的肿瘤相关基因,在多种肿瘤细胞或组织中高表达,且与患者预后不良关系密切〔6,7〕。URGCP已被证实在鼻咽癌和宫颈癌组织或细胞中表达上调,与临床分期、肿瘤大小和淋巴结转移等有关,URGCP高表达的患者预后较差〔8,9〕。URGCP作为一种促癌基因,在肿瘤的多种生物学功能如血管生成、化疗药物耐药、细胞增殖、转移和凋亡等中发挥重要的调控作用〔10〕。在肝癌中,URGCP可通过激活NF-κB信号通路促进癌细胞的血管生成〔11〕;URGCP过表达增加了顺铂诱导膀胱癌细胞凋亡的能力,并促进了抗凋亡基因Bcl-2、生存素(survivin)、髓样细胞白血病(MCL)-1和LIP的表达〔12〕;抑制URG4的表达可通过下调CyclinD1、β-catenin 及c-myc的表达抑制宫颈癌小鼠的生长〔13〕;URGCP通过NF-κB活化增强基质金属蛋白酶(MMP)-9表达促进了非小细胞肺癌(NSCLC)细胞的侵袭、迁移和远处转移,而下调URGCP则抑制了这些恶性特征〔14〕。可见,URGCP基因与多种肿瘤的发生发展密切相关,干扰其表达有望成为肿瘤治疗的新靶点。然而,目前URGCP与胶质瘤的研究较少,其对胶质瘤的调控机制尚不明确。因此,本研究通过体外细胞实验初步观察URGCPP对胶质瘤细胞增殖的影响。本研究结果提示,URGCP可能在胶质瘤的发生发展过程中发挥重要的促进作用。CyclinD1和CyclinE1均是细胞周期调控蛋白,在细胞从G1期进入到S期时发挥重要的促进作用;同时CyclinD1也是导致细胞增殖失控的原癌基因,两者在胶质瘤细胞的增殖过程中发挥着重要的调控作用〔15,16〕。NF-κB信号通路是一种与多种肿瘤包括胶质瘤发展密切相关的转录调控通路〔17,18〕。当受到外界刺激时,胞质内IκBα可被磷酸化,从NF-κB/p65与IκBα形成的复合物中降解,从而激活NF-κB/p65进入细胞核,通过调控相关基因如CyclinD1和CyclinE1等参与调控细胞增殖过程〔19,20〕。已有研究〔11,21〕证实下调URGCP可诱导细胞周期阻滞,抑制NF-κB信号通路的活化。本研究通过检测胶质瘤细胞中CyclinD1、CyclinE1、IκBα、p-IκBα和胞核内外NF-κB/p65蛋白的表达,以评价URGCP促进胶质瘤细胞恶性增殖的分子机制,研究结果提示,URGCP可能通过激活NF-κB信号通路促进了胶质瘤细胞的恶性增殖。
综上,URGCP在神经胶质瘤细胞中表达升高,可通过激活NF-κB信号通路促进癌细胞的增殖。本研究仅从体外细胞水平上评价了URGCP对胶质瘤的促增殖作用,后续有待从体内动物实验进一步验证。
