瞬时无波比的理论及应用
2020-12-09孙宇彤刘健
孙宇彤 刘健
作者单位:100032 北京,北京大学人民医院心内科
当冠心病患者存在一支或多支血管的影响血流动力学的狭窄时,需要对其进行血运重建。2018年欧洲心脏病学会(European Society of Cardiology,ESC)及欧洲心胸外科协会(European Association for Cardio-Thoracic Surgery,EACTS)关于心肌血运重建的指南[1]认为,没有缺血的证据时,建议采用冠状动脉生理学指标血流储备分数(fractional flow reserve,FFR)或瞬时无波比(instantaneous wave-free ratio,iFR)来评估存在中度狭窄的冠状动脉血流动力学情况(Ⅰ类推荐)。将压力导丝推进至狭窄病变远端,然后给予腺苷,测量充血时跨病变的压力梯度,即为FFR。许多大型临床试验已经证明了其在评估影响血流动力学狭窄方面的价值优于冠状动脉造影,可以优化临床结果[2-4]。但FFR的准确性面临着操作过程复杂、术中及术后并发症、生理学等因素的限制[5]。在这种情况下,iFR这一无需应用充血药物即可获得的生理学指标诞生了。在心脏舒张期中的无波期(此时的微循环阻力是稳定且最小的)测得的跨冠状动脉病变的压力梯度,即为iFR[6]。目前研究结果证明,iFR的诊断准确性与FFR相似,且术后不适少、操作便捷、评估复杂病变更准确[6-10]。笔者主要对iFR的背景、理论基础、临床应用与未来展望进行阐述。
1 iFR 的背景
iFR是在FFR的理论基础上诞生的、无需血管扩张剂即可获得的、可以避免FFR诸多不足的冠状动脉生理学指标。因此,探讨iFR的背景一定要从FFR说起。FFR这个指标诞生于20世纪90年代,其理论基础是Pijls等[11]提出的Ohm法则(V=IR,V是电压差,I是血流,R是阻力)。Ohm法则认为,冠状动脉内阻力稳定且最小时,冠状动脉压力和血流之间存在比例关系,此时测定跨狭窄处的压力降低水平即可反映心肌供血的减少情况。然而,自然状态下的冠状动脉内阻力并非稳定不变,而是在心动周期中以相位模式波动(类似于交流电路中的电阻)。这种波动是心肌和微循环在收缩期(冠状动脉压力升高,压迫微循环的血管)和舒张期(冠状动脉压力降低,此时微循环起减压作用)互相影响造成的[12]。为了排除这些影响,使用血管扩张剂令冠状动脉达到最大充血状态,此时微循环血流量最大,冠状动脉内阻力稳定且最小。FFR即为此时的远端平均压力(mean distal stenosis pressure,Pd)与主动脉平均压力(mean aortic pressure,Pa)之比。大量临床试验如DEFER研究及其5年、15年随访结果[2,13-14]、FAME研究[3]、FAME2研究[4]均证明了FFR的准确性及临床价值。但因为腺苷价格昂贵、禁忌证多(哮喘、慢性阻塞性肺疾病、心动过缓)以及其诱发胸痛的可能性, FFR的应用仍十分受限(图1)。
2 iFR 的理论基础

如果可以在自然的心动周期中找到冠状动脉内阻力稳定且最小的时期,便可以省去血管扩张剂及计算过程。ADVISE研究[6]在心脏舒张期中识别出这样一个特定时期,将之定义为“无波期”,并提出了无需血管扩张剂即可在无波期中测定的iFR。研究在使用腺苷前后,分别测量冠状动脉内波强、压力、阻力、分离压,在波强和微循环压力为零时,通过波强分析确定后向减压波之后的无波期(开始于舒张期的25%,结束于舒张期结束前5 ms,图2 A和图2 B),此时自然状态下阻力最小(图2 C),冠状动脉内压力和血流为成比关系(图2 D)。在至少5个心动周期中的无波期(图3 A和图3 B)测量狭窄远端平均压力(Pd wave-free period)与主动脉平均压力(Pa wavefree period)之比,即为iFR(图3 C),计算公式是:iFR=Pd wave-free period/Pa wave-free period[7]。

图2 无波期的定义[6] A. 注射腺苷后冠状动脉内波强;B. 分离压力;C. 冠状动脉内阻力;D. 冠状动脉内压力和血流速率;灰色背景所示为无波期
3 关于iFR 准确性的研究
诸多结果已经证明了iFR与FFR诊断准确性相似。从理论角度来说:ADVISE研究[6]证明了iFR与FFR强相关(r=0 .90,与FFR=0.80对应的iFR值是0.83,曲线下面积是 93%)。ADVISE注册研究[7]的结论是iFR与FFR的一致性好,诊断准确性较高(与FFR=0.80对应的iFR=0.89,曲线下面积是 86%)。北京大学第三医院最近发布的一项研究收集了60例患者(80支冠状动脉)的109组FFR和iFR数据,也发现了二者间的强相关关系(r=0.780,P<0.001)[15]。近年也有许多关于iFR的临床试验,DE FINE-FLAIR研究[9]纳入2492例冠心病患者,以1∶1的比例分别进行iFR和FFR指导的血运重建。基本终点是1年后主要不良心血管事件(major adverse cardiovascular events,MACE),包括全因死亡、非致死性心肌梗死、计划外血运重建。1年后iFR组1148例患者中的78例(6.8%)和FFR组1182例患者中的83例(7.0%)出现了上述终点事件(P=0.78),两组临床结局差异无统计学意义。SWEDE-HEART研究[10]入组2037例患有稳定性冠心病(stable coronary artery disease,SAD)或急性冠状动脉综合征(acute coronary syndrome,ACS)的患者,随机分为iFR和FFR指导血运重建组。主要终点是术后12个月的MACE,结果是各组间MACE发生率的差异无统计学意义,证明了无论在SAD还是ACS患者中,iFR均不劣于FFR。
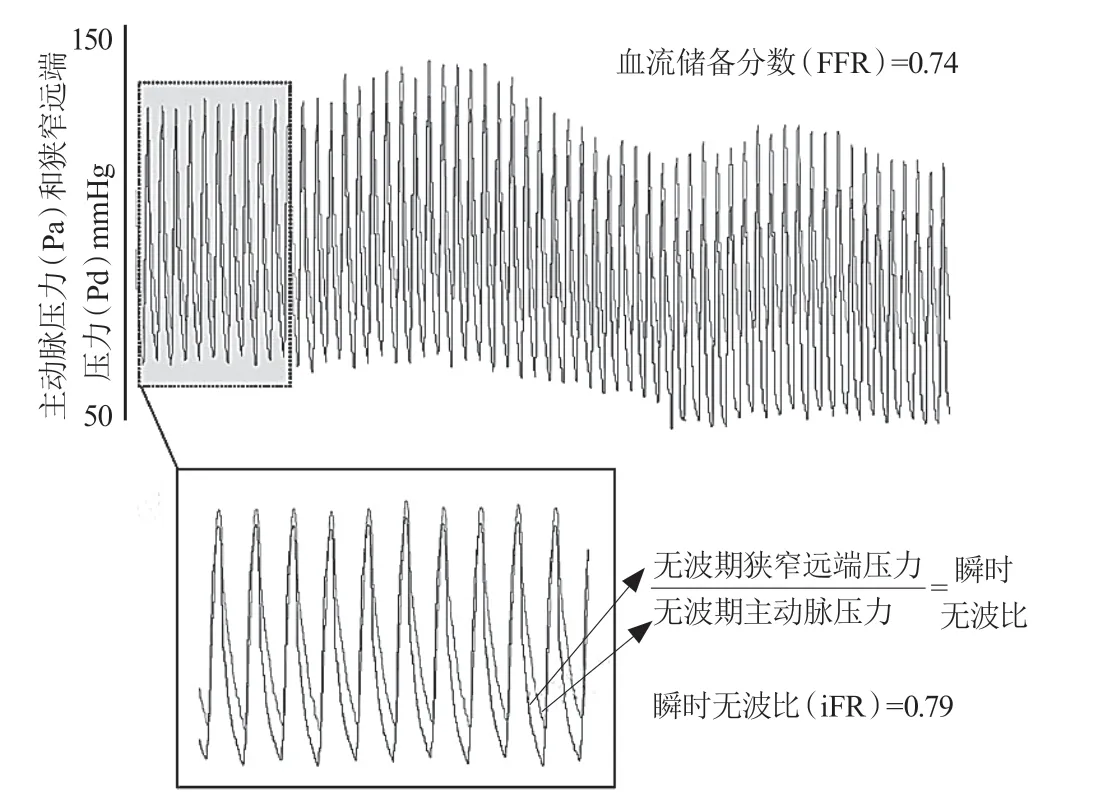
图3 瞬时无波比测量示意图[7]
相比于FFR,iFR内在变异更小,在特殊情况下更稳定。在重复测量中,FFR的平均差异是(0.01±0.04)[16],iFR的平均差异是(0.0005±0.0020),差异无统计学意义(P=0.78)[6]。此外,iFR不受心率、收缩压、舒张压影响,在早搏或血压变化较大的患者中都比较准确。
iFR还具有术后并发症少、操作更便捷的优势。DEF INEFLAIR研究[9]中,iFR组中位操作时间是40.5 min,FFR组是45.0 min,差异有统计学意义;术后,iFR组的39例(3.1%)患者和FFR组385例(30.8%)患者出现了胸痛、呼吸困难等不适,差异有统计学意义;除此,FFR组的8例患者出现支气管痉挛、心室颤动等严重不良反应,而iFR组仅有1例患者出现这种情况。SWEDE-HEART研究[10]中,iFR组中3.0%和FFR组68.3%的患者有术后胸痛的症状 ,差异有统计学意义。
4 iFR 的临床应用
4. 1 iFR指导冠心病的内科治疗
4. 1. 1 iFR指导延迟血运重建 目前指南推荐在生理学指导下进行冠状动脉血运重建,主要是因为相比于造影,冠状动脉生理学指标可以更准确地评估狭窄处的血流动力学变化情况,并据此决定行即刻血运重建或延迟血运重建。在治疗非罪犯病变方面,最近的DEFINE-FLAIR和SWEDEHEART研究的混合分析对接受FFR/iFR指导的血运重建的SAD和ACS患者的1年临床结果进行了研究[17]。试验纳入4529例冠状动脉中度狭窄患者,根据生理学检查类型(iFR或FFR)和临床表现(SAD或ACS)进行分组,对ACS患者只评估非罪犯病变,主要终点为MACE。结果是iFR组2240例中的1119例(50.0%)、FFR组2246例中1015例(45.2%)进行了延迟血运重建(P<0.01);无论是基于iFR还是FFR的延迟治疗,1年后的MACE发生率都很低(约4%);除此,FFR指导的延迟血运重建的患者中,ACS患者比SAD患者预后差,而iFR组无明显差异。结论是基于iFR或FFR对SAD和ACS患者的非罪犯病变进行延迟血运重建都是安全的;而且,用iFR指导ACS非罪犯病变血运重建的效果可能更好。iFR评估ACS罪犯病变的效果尚不明确。但理论上说,急性期罪犯病变处的静息血流减少,此时iFR的评估效果并不准确。总之,在SAD患者中应用iFR进行延迟血运重建比较安全,而在ACS患者中,不论是评估非罪犯病变还是罪犯病变,iFR的有效性都尚有争议。在更大的临床研究提供明确结果之前,解释大面积心肌梗死的iFR或诊断阈值(≤0.89)附近的iFR时,应采取谨慎态度。
4. 1. 2 iFR评估多血管病变 目前关于iFR的研究主要针对单支血管病变患者展开。而最近的DEFINE-REAL试验[18]是一项探究iFR对多血管病变者临床决策影响的前瞻性观察性研究。研究纳入来自18家中心的484例患者,其血管造影均显示冠状动脉狭窄>40%,且存在多血管病变。研究者先根据血管造影和临床信息预测患者的治疗方案,然后进行FFR或iFR检查,以此确定最终的治疗策略。结论是iFR使研究者可以观察更多的血管,从而改变原本治疗策略,降低主要围术期事件发生率。
4. 1. 3 iFR评估复杂病变 用FFR评估串联、弥漫病变的生理学情况比较困难。这是因为充血状态下通过一处狭窄的血流受到另一处狭窄的限制[19]。而静息状态下,血流在整个狭窄区域几乎是稳定的[20]。因此,用iFR评估整个血管中的压力变化比较现实。2014年, Nijjer等[21]发表了关于iFR回撤技术的研究。该研究在29例存在冠状动脉串联或弥漫病变的患者中,用计算机实时跟踪压力导丝的运动,获得手动回撤数据,进行离线分析,再将其与造影结合,绘出血管生理图,显示每个狭窄处的iFR下降情况。这是基于iFR的虚拟经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)的首个在体研究,其预测PCI术后iFR的准确性较好,偏差无显著性。然而,由于需要离线分析iFR,该技术应用于临床比较困难。2018年的GRADIENT研究[22]是第1项通过在体、线上分析回撤曲线,预测PCI术后iFR,分析回撤技术对治疗影响的多中心研究。研究纳入128例存在串联或弥漫病变的冠状动脉中度狭窄患者(134处狭窄)。术者在单独造影及回撤分析后分别给出治疗策略;并与PCI术后的实测iFR对比(图4)。术后iFR的预测值是(0.93±0.05),实测值是(0.92±0.06),误差仅为(1.4±0.5)%。对比以造影为基础的治疗方案,iFR回撤技术改变了52处血管的干预措施,显示的病变数量[(-0.18±0.05)病变/血管,P=0.0001]更少,长度[(-4.4±1.0)mm/血管,P<0.0001]更短。因此,在串联和弥漫性冠状动脉疾病中,用iFR回撤预测PCI的生理结果准确性好;与单纯造影相比,近1/3的患者改变了血运重建方式。iFR回撤技术能更准确地识别弥漫、串联等复杂病变,帮助实时评估多种虚拟支架策略的效益,以最少的支架获得最大的疗效。与iFR完全集成的虚拟PCI技术标志着冠状动脉生理学新领域的诞生,预示着其从单纯验证PCI的合理性向指导PCI的转变。
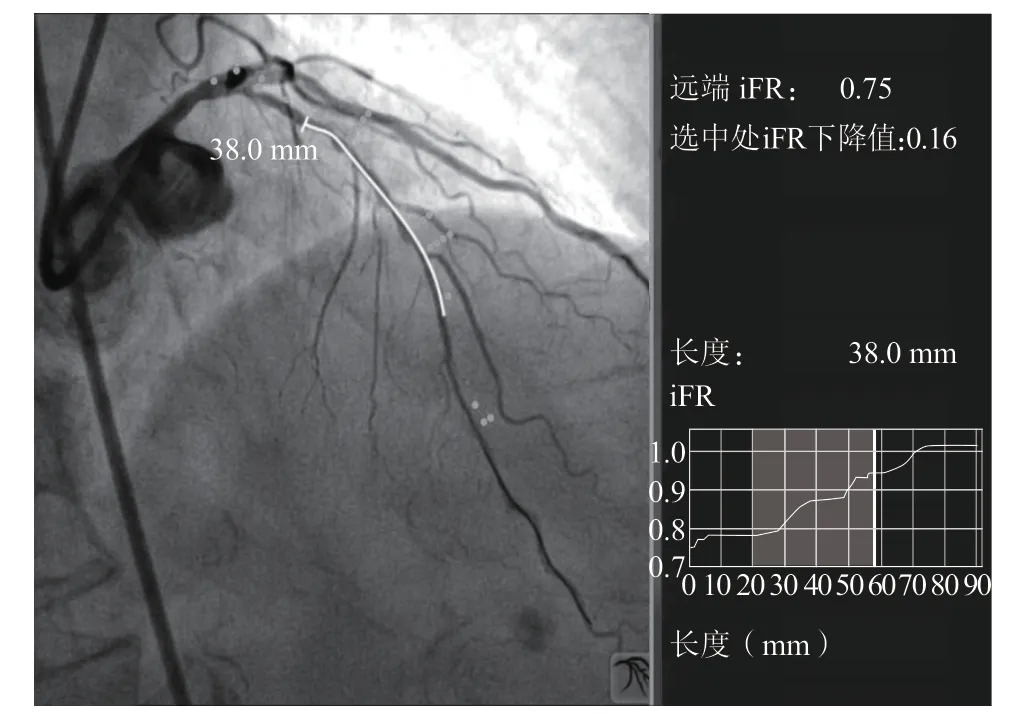
图4 通过回撤技术预测PCI术后iFR示意图[22]
4. 2 iFR指导冠状动脉旁路移植术(coronary artery bypass grafting,CABG)
一项小样本研究回顾性分析了109例行CABG的患者,随机分为FFR/iFR指导组和造影指导组[23]。结果是FFR组和 iFR组静脉移植率(85.7%比76.8%,P<0.05)和三支血管吻合率明显增高(85.7%比74.7%,P<0.05),左前降支移植率低于造影组(7.1%比29.5%,P<0.05),左回旋支移植率高于造影组(28.6%比9.5%,P<0.05);18个月后MACE发生率和心绞痛发生率较造影组也有减少趋势。这说明,冠状动脉生理学可以指导CABG。虽然目前这方面临床试验仍然较少,但由于iFR与血流的关系比FFR更加密切,以及原有血管与移植血管长期竞争血流的关系,用iFR评估拟行CABG的血管可能是更好的方式。
4. 3 iFR在冠心病合 并瓣膜病患者中的应用
2018年,一项研究纳入95例冠状动脉中度病变合并主动脉狭窄的患者(116条血管),将iFR、FFR与心肌灌注成像进行比较[24]。结果是iFR与FFR具有相关性,二者与心肌灌注成像的相关性均良好。这项研究证明,在冠心病合并主动脉狭窄患者中,iFR仍具有准确诊断缺血的价值。
目前关于iFR这一指标仍有许多问题尚未明确:(1)无论是罪犯病变,还是非罪犯病变,其血流动力学稳定问题尚有争议,iFR的准确性仍需进一步研究。(2)目前关于iFR的临床试验尚不足,回撤技术及其在冠心病合并其他疾病患者群中的应用价值尚需验证。(3)iFR诊断缺血的阈值仍需探讨。虽然诸多大型临床研究采取FFR≤0.80和iFR≤0.89作为诊断缺血阈值[9-10],但当以更为准确的缺血金标准为参考时,阈值也随之发生变化(FFR≤0.75、iFR≤0.86)[8,25],由此也带来了生理学灰区:FFR 0.75~0.80,iFR 0.86~0.93是否需行血运重建的讨论[7,26-28]。除此iFR的临床应用也有更广泛的发展空间,与机器学习、人工智能相结合的冠状动脉生理学将是未来热点。这种方法不仅可以提高生理学数据质量[29],还可以对血管重建进行智能分辨(在同一支血管内,对影响血流动力学的病灶行PCI术,而弥漫性压力损失的区域仅给予药物治疗),从而达到精准诊断的目的。
作为比血流储备分数更准确、便捷的冠状动脉生理学指标,iFR的诞生给临床医师带来了许多的机遇,也给患者减轻了经济负担,减少了术后不适。但其理论和临床应用还有许多的发展空间,这些都需要我们进行更深入的研究和探讨。
