卵圆细胞恶性转化相关差异性甲基化基因的筛选及验证
2020-12-08汪鑫闫亮亮安然程亚王恒毅
汪鑫,闫亮亮,安然,程亚,王恒毅
作者单位:安徽医科大学第一附属医院,a急诊外科,b 风湿免疫科,安徽 合肥230032
肝细胞癌(hepatocellular carcinoma,HCC)是我国最常见且恶性程度最高的肿瘤之一,占我国癌症死亡率的第2位[1]。肝癌的发病机制仍不十分清楚。卵圆细胞(oval cell)是一类定植于胆管的核圆少浆的上皮细胞,在特定的疾病或病理生理条件下,可被激活并增殖[2-3]。其被认为是肝脏前体干细胞,具有肿瘤干细胞的特征。在致癌因素作用下,卵圆细胞高速增殖,基因组结构不稳,分化失控,继而发育停滞,恶性转化为肝癌细胞[4-5]。但卵圆细胞恶性转化的调控机制仍未阐释清楚。
我们将肝细胞癌基因HBV X(HBX)转染大鼠肝卵圆细胞(LE6细胞系)后发现:转染HBX卵圆细胞(HBX-LE6)发生了恶性转化,在动物模型中,HBX-LE6细胞在肝内形成间质瘤细胞和肝癌细胞组成的肝癌肉瘤[6-7],但致癌因素诱导卵圆细胞恶性转化的表观遗传学机制尚未阐明。根据表观遗传致癌假说,致癌因素的暴露能改变细胞的表观遗传学模式,进而引起基因活性和细胞表型的改变,引发原癌基因的活化和肿瘤抑制基因灭活,最终导致肿瘤的发生。DNA甲基化(DNA methylation)是目前研究最为广泛的表观遗传现象。低甲基化造成肿瘤细胞基因组的不稳定,并促使致癌基因活化。抑癌基因的高甲基化可以直接抑制其表达或基因沉默,引起细胞恶变,最终导致肿瘤的发生。
本研究于2017年1月至2018年5月首先利用简化甲基化测序(Reduced representation bisulfite sequencing,RRBS)对发生恶性转化的卵圆细胞HBXLE6与正常LE6细胞进行甲基化测序,获得差异性甲基化区域(Differentially methylated region,DMR),通过基因注释获得相关差异性甲基化基因(Differentially methylated gene,DMG),并进行验证,探索DNA甲基化参与卵圆细胞恶性转化的表观遗传学机制。
1 材料与方法
1.1材料卵圆细胞购于美国标准菌库(马纳萨斯,弗吉尼亚州),TRIzol试剂盒购于美国Invitrogen公司,SYBR Green和HiScript IIQ RT SuperMix购于南京诺唯赞生物技术有限公司,qPCR引物核酸序列由上海生物工程有限公司合成,多克隆抗体和二级抗体均购于于北京博奥森生物公司,甲基化试剂盒和甲基化抑制剂5-Aza-CdR购于Zymo Research公司。
1.2方法
1.2.1 分组 HBX+LE6组:稳定表达HBX的恶性转化后卵圆细胞;LE6组:正常大鼠卵圆细胞LE6;5-Aza-CdR+HBX-LE6组:培养基中加入5-Aza-CdR处理72 h后的HBX-LE6卵圆细胞。
1.2.2 高通量甲基化测序 通过Illumina HiSeqTMPE125/PE150系统获得原始图像,数据文件经CASAVA碱基识别(Base Calling)分析转化为测序读段(Sequenced Reads)。使用BiSeq软件(1.6版)识别DMR。使用MethylKit软件(1.0.0版)计算差值甲基化的P值。DMR标准阈值为P<0.05,甲基化率差异大于10%。对DMR进行区域、基因注释,获得差异性甲基化相关基因及DMR在基因功能区域的定位。
1.2.3 实时定量聚合酶链反应(Real-time qPCR)检测 (1)反应体系:SybrGreen Mixture 12.5µL,互补DNA(cDNA)模板2.5µL,正向引物(10µmol/L)0.5µL,反向引物(10µmol/L)0.5µL,双蒸馏水(ddH2O)9µL,总体积为25µL。(2)反应条件:95℃预变性2 min,95 ℃变性25 s,退火时间25 s,72 ℃延伸45 s,共45个循环。Real-time qPCR引物序列见表1。
1.2.4 蛋白质印迹法(Western Blot)检测 以β-肌动蛋白(β-actin)作为内参对照,细胞用细胞裂解液处理,在冰浴中匀浆。用BCA法蛋白定量。采用凝胶成像分析系统计算目的条带的积分光密度、根据目的条带的灰度值与内参照β-actin的灰度值之比值行定量分析。

表1 实时定量聚合酶链反应(Real-time qPCR)引物核酸序列
1.2.5 甲基化特异性聚合酶链反应(methylation specific polymerase chain reaction,MSP)检测 (1)引物序列:甲基化特异性引物M-forward 5’-GTTCGTCGTCGT TTTTTAGGC-3’,和M-reverse5’-AAAAACCAACG ACCCCCGCG-3’,非甲基特异性引物为U-forward,U-forward5’-AGT TTGTTGTTGTTTTTTAGGTGG-3’,和 U-reverse 5’-AAAAAACCAACAA CCCCCACA-3’,扩增片段均为108 bp。(2)反应体系:10×PCR Buffer 2 µL,dNTP mix(2.5 mmol/L dNTP)1.6µL,正向引物(10µmol/L)0.4µL,反向引物(10µmol/L)0.4µL,修饰后的DNA 2µL,DNA聚合酶0.1µL,去离子水13.5µL,总体积20µL。(3)反应条件:95℃预变性5 min,94℃变性30 s,甲基化特异性引物58℃退火30 s,非甲基化特异性引物54℃30 s,然后72℃延伸30 s,共35个循环,最后72℃延伸6 min反应完成。
1.3统计学方法数据分析采用SPSS 17.0软件,正态分布资料以表示,两组间比较采用两独立样本t检验,多组间比较采用单因素方差分析。对于DMR 的鉴定,采用软件 BiSeq(1.6.0)、methylKit(1.0.0)进行检验。以P<0.05为差异有统计学意义。
2 结果
2.1高通量甲基化测序结果HBX和HBX-LE6细胞共筛选出1 434个DMR。其中高甲基化623个(位于启动子128个),低甲基化811个(位于启动子216个)。通过DMR基因注释,共筛选DMG 1 987个。并按统计显著性排序,列出了前20位明显高甲基化DMR和DMG,见表2。
2.2 Real-time qPCR检测结果SMARCB1、CYLD、ZBTB16、USP18在HBX-LE6组中的mRNA表达量相对值较LE6组均显著下调。SMARCB1高甲基化被5-Aza-CdR抑制后,5-Aza-CdR+HBX-LE6组中的mRNA表达较抑制前HBX-LE6组显著上调(P<0.05)。见表3,4。
表4 LE6、HBX-LE6和5-Aza-CdR+HBX-LE6三组中SMARCB1、CYLD、ZBTB16、USP18的相对表达量比较/

表4 LE6、HBX-LE6和5-Aza-CdR+HBX-LE6三组中SMARCB1、CYLD、ZBTB16、USP18的相对表达量比较/
注:HBX-LE6为转染肝细胞癌基因HBV X(HBX)发生恶性转化的大鼠肝卵圆细胞,LE6为正常大鼠肝卵圆细胞,5-Aza-CdR+HBXLE6为培养基中加入5-Aza-CdR处理72h后的HBX-LE6卵圆细胞,SMARCB1为SWI/SNF染色质重塑复合物,CYLD为肿瘤抑制因子,ZBTB16为含16的锌指和BTB结构域蛋白,USP18为泛素特异性蛋白酶18基因。与HBX-LE6组比较,aP<0.05
USP18 4.50±0.43 2.09±0.18 2.09±0.13 0.300 0.724组别LE6 HBX-LE6 5-Aza-CdR+HBX-LE6 F值P值重复次数3 3 3 SMARCB1 7.34±0.11 2.57±0.29 7.31±0.12a 4 018.000<0.001 CYLD 7.30±0.27 3.44±0.13 3.5±0.08 0.138 0.874 ZBTB16 7.01±0.06 1.29±0.32 1.33±0.09 0.600 0.586

表2 转染肝细胞癌基因HBV X(HBX)发生恶性转化的大鼠肝卵圆细胞HBX-LE6与正常大鼠肝卵圆细胞LE6间位于启动子差异性高甲基化区域列表(前20位)
表3 实时定量聚合酶链反应(Real-time qPCR)分别检测HBX-LE6与LE6两组中USP18、MAP3K6、SMARCB1、EGFR、CYLD、RNF39、ZBTB16、HOXD8的mRNA相对表达量/
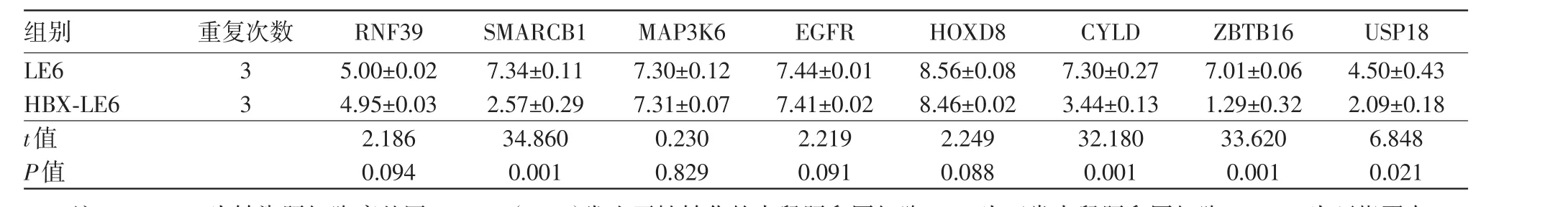
表3 实时定量聚合酶链反应(Real-time qPCR)分别检测HBX-LE6与LE6两组中USP18、MAP3K6、SMARCB1、EGFR、CYLD、RNF39、ZBTB16、HOXD8的mRNA相对表达量/
注:HBX-LE6为转染肝细胞癌基因HBV X(HBX)发生恶性转化的大鼠肝卵圆细胞,LE6为正常大鼠肝卵圆细胞,RNF39为环指蛋白39,SMARCB1为SWI/SNF染色质重塑复合物,MAP3K6为有丝分裂原活化蛋白激酶激酶激酶6,EGFR为表皮生长因子受体,HOXD8同源异型盒基因D8,CYLD为肿瘤抑制因子,ZBTB16为含16的锌指和BTB结构域蛋白,USP18为泛素特异性蛋白酶18基因
USP18 4.50±0.43 2.09±0.18 6.848 0.021 LE6 HBX-LE6 t值P值3 3 5.00±0.02 4.95±0.03 2.186 0.094 7.34±0.11 2.57±0.29 34.860 0.001 7.30±0.12 7.31±0.07 0.230 0.829 7.44±0.01 7.41±0.02 2.219 0.091 8.56±0.08 8.46±0.02 2.249 0.088 7.30±0.27 3.44±0.13 32.180 0.001 7.01±0.06 1.29±0.32 33.620 0.001组别 重复次数RNF39SMARCB1MAP3K6EGFRHOXD8CYLDZBTB16
2.3蛋白质印迹法检测结果USP18、ZBTB1、CYLD的蛋白表达在三组间差异无统计学意义(P>0.05)。与LE6相比,SMARCB1在HBX-LE6中的蛋白表达下调,SMARCB1高甲基化被5-Aza-CdR抑制后,其蛋白表达显著上调(P<0.001)。见图1、表5。
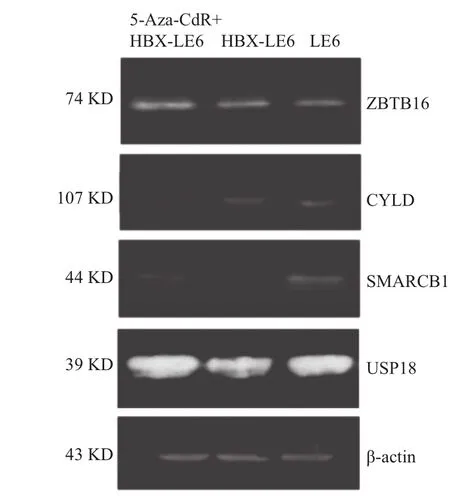
图1 蛋白质印迹法检测5-Aza-CdR+HBX-LE6、HBX-LE6、LE6三组中ZBTB16、CYLD、SMARCB1、USP18的蛋白表达
表5 LE6、HBX-LE6、5-Aza-CdR+HBX-LE6三组中SMARCB1、CYLD、ZBTB16、USP18的蛋白表达比较/

表5 LE6、HBX-LE6、5-Aza-CdR+HBX-LE6三组中SMARCB1、CYLD、ZBTB16、USP18的蛋白表达比较/
注:LE6为正常大鼠肝卵圆细胞,HBX-LE6为转染肝细胞癌基因HBV X(HBX)发生恶性转化的大鼠肝卵圆细胞,5-Aza-CdR+HBX-LE6为培养基中加入5-Aza-CdR处理72h后的HBX-LE6卵圆细胞,SMARCB1为SWI/SNF染色质重塑复合物,CYLD为肿瘤抑制因子,ZBTB16为含16的锌指和BTB结构域蛋白,USP18为泛素特异性蛋白酶18基因。与LE6组比较,aP<0.01;与HBX-LE6组比较,bP<0.01
USP18 8.45±0.21 8.32±0.14 8.29±0.19 11.734 0.075组别LE6 HBX-LE6 5-Aza-CdR+HBX-LE6 F值P值重复次数3 3 3 SMARCB1 6.26±0.25 1.53±0.34a 7.55±0.32b 34 309.000<0.001 CYLD 1.62±0.22 1.58±0.17 1.72±0.23 10.331 0.082 ZBTB16 4.33±0.03 4.31±0.15 4.29±0.09 2.400 0.172
2.4 MSP检测5-Aza-CdR+HBX-LE6、HBX-LE6和LE6三组中SAMRCB1基因的甲基化状态分别用“M”(甲基化特异性引物)和“U”(非甲基化特异性引物)进行扩增。LE6、HBX-LE6用U引物扩增都有特异性扩增产物,M引物仅在HBX-LE6有特异性扩增产物。在5-Aza-CdR干预后,5-Aza-CdR+HBXLE6中U引物有特异性扩增产物,M引物无特异性扩增产物。见图2。

图2 甲基化特异性聚合酶链反应(MSP)检测LE6、HBX-LE6和5-Aza-CdR+HBX-LE6三组中SWI/SNF染色质重塑复合物(SMARCB1)基因的甲基化状态
3 讨论
DMR指在不同样本之间,甲基化修饰水平具有显著差异的基因组区域,这些区域在基因表达调控方面发挥重要作用。本研究结果共获得DMR 1 434个,其中高甲基化DMR 623个(位于启动子128个),低甲基化DMR 811个(位于启动子216个)。通过DMR基因注释获得DMG 1 987个。从中挑选出高甲基化相关基因 USP18、MAP3K6、SMARCB1、EGFR、CYLD、RNF39、ZBTB16、HOXD8进行验证。结果表明:CYLD、ZBTB16、USP18在HBX-LE6中的mRNA表达水平显著降低(P<0.05)。已知USP18与肺癌关系密切,改变USP18水平会影响肺癌细胞cyclinD1蛋白的稳定性[8]。ZBTB16蛋白含有一个锌指结构和一个BTB结构,被认为与调控细胞自噬有关[9]。CYLD被认为是抑癌基因,其去泛素化活性调控NF-κb及JNK等信号途径,在抑制肿瘤方面发挥重要作用[10]。在5-Aza-CdR抑制其甲基化后,三种基因mRNA表达水平并未明显上调。表明启动子高甲基化并非其mRNA表达下调的单一因素。USP18、ZBTB1、CYLD的蛋白表达在两组间差异无统计学意义(P>0.05),可能与基因转录后水平、翻译水平等多重调控有关。
与LE6相比,SMARCB1在HBX-LE6中的蛋白表达显著下降(P<0.05),与其mRNA表达水平下调一致。进一步研究表明,5-Aza-CdR完全抑制了SMARCB1启动子的甲基化,且抑制后HBX-LE6细胞中SMARCB1的mRNA与蛋白表达均显著升高(P<0.05),表明启动子的高甲基化可能是下调抑癌基因SMARCB1表达的主要因素。SMARCB1基因编码的蛋白是ATP依赖性染色质调节复合物SWI/SNF的核心亚基,参与基因的表观修饰和转录调控[11]。SMARCB1基因突变与多种肿瘤的发生相关,其作为抑癌基因可以诱导细胞G1停滞、抑制染色体非整倍性等发挥肿瘤抑制的作用[12-13]。SMARCB1与肝癌发生的关系密切。SMARCB1在肝组织中的表达与肝癌发生的风险呈负相关。敲除SNF5(SMARCB1/INI1/BAF47)的肝癌细胞系Hep3B和HCCLM3生长和迁移能力明显增强[14-16]。
表观遗传学认为,表观遗传改变在肿瘤发生发展过程中起着主要作用,是细胞恶性转化早期的主要驱动力[17]。在哺乳动物基因组中,DNA甲基化的主要位点是CpG二核苷酸,常位于基因上游调控区的启动子区域。启动子区的CpG岛通常处于非甲基化状态,基因能正常表达;当其发生甲基化时,影响基因转录调控,使基因表达发生沉默。因此,抑癌基因SMARCB1启动子的高甲基化可能参与了LE6卵圆细胞发生恶性转化的分子机制。但其下游靶基因或效应分子为何,以及在体内如何影响卵圆细胞的生物学特征均需进一步深入研究。
综上所述,本研究应用RRBS技术,获得转化后大鼠卵圆细胞与未转化卵圆细胞的DMR与DMG,并对相关基因进行验证,为研究卵圆细胞发生恶性转化的表观遗传学机制提供了重要线索与理论依据。
